2. 第二军医大学药学院海洋药物研究中心, 上海 200433;
3. 沈阳药科大学基于靶点的药物设计与研究教育部重点实验室, 沈阳 110016
2. Research Center for Marine Drugs, School of Pharmacy, Second Military Medical University, Shanghai 200433, China;
3. Key Laboratory of Structure-Based Drug Design and Discovery of Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, Liaoning, China
软柳珊瑚属(Subergorgia)属于八放珊瑚亚纲(Octocorallia)柳珊瑚目(Gorgonacea)软柳珊瑚科(Subergorgiidae)动物,主要分布在印度洋-太平洋的热带、亚热带海域,附着在深15~20 m处的暗礁坡面上,具有扇形或刷状的分枝[1]。关于该属动物的化学成分研究报道只涉及4个物种,即网状软柳珊瑚(S. reticulate) [2]、侧扁软柳珊瑚(S. suberosa) [3]、S. hicksoni[4]和网扇软柳珊瑚(S. mollis)[5],其中前2种珊瑚的文献报道相对较多。该属珊瑚中分离得到的化学成分主要包括甾体[6, 7, 8, 9, 10]、倍半萜[11, 12, 13]、生物碱[14, 15]、嘌呤与嘧啶衍生物[16]等类型,以甾体类化合物最为典型。在体外筛选实验中,这些化合物显示细胞毒、抗氧化、抗病原微生物及抗污损等多种活性。
侧扁软柳珊瑚俗名红海树,据报道该种珊瑚的次生代谢产物主要包括甾醇类化合物(包括9,11-开环甾醇类[10]、孕甾烷类[3]及其他多羟基甾醇类[17])、倍半萜类化合物(包括suberosane型[18],subergane型[19]和石竹烯型倍半萜[12] )及嘌呤类生物碱[16]等化合物。部分化合物显示了细胞毒、抗菌、抗胆碱酯酶及对抗天敌捕食等活性。
在对南海珊瑚化学成分的系统研究中,我们对采自我国广西北海的侧扁软柳珊瑚的化学成分进行了研究,共分离得到10个开环甾醇类化合物,结构见图 1。
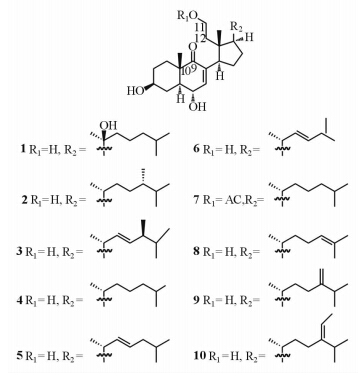
|
图 1 化合物1~10的结构式 Fig 1 Structures of compounds 1-10 |
侧扁软柳珊瑚样品(编号ZH-18)于2011年10月采自中国南海广西北海,立即冷冻备用。种属由中国科学院南海海洋研究所李秀保博士鉴定为Subergorgia suberosa。样品标本保存于第二军医大学药学院海洋药物研究中心。
1.2 主要仪器与试剂Varian Inova-400核磁共振仪;MAT-212质谱仪;SGW-1自动旋光仪;Agilent1100高效液相色谱仪[RID检测器,Zorbax 300-C18柱(250 mm×9.4 mm,5 μm)];Sephadex LH-20凝胶由Amersham Pharmacia Biotech生产;TLC薄层板和柱色谱硅胶均由烟台黄务硅胶开发实验厂提供;开放柱色谱所用溶剂为分析纯,高效液相色谱(HPLC)所用试剂为色谱纯,由国药集团上海化学试剂公司生产。
1.3 化合物的提取与分离侧扁软柳珊瑚湿质量1.75 kg,剪碎,丙酮超声提取6次(3 L/次,30 min),合并丙酮提取液,减压浓缩得粗浸膏17.7 g。粗浸膏混悬分散于水中,分别用等体积乙醚、正丁醇萃取5次,减压浓缩,分别得5.7 g和3.3 g浸膏。乙醚层浸膏经Sephadex LH-20凝胶柱色谱(CH2Cl2∶MeOH = 1∶1)分为Fr.A和Fr.B两部分;其中Fr.A经开放ODS柱层析梯度洗脱(从MeOH∶H2O = 10∶90至纯甲醇)分成6个部分(Fr.A1~Fr.A6)。其中Fr.A2(11.8 mg)用HPLC(流动相:70%乙腈-水;流速:2 mL/min)分离纯化得到化合物 2 (2.7 mg,35 min)和 10 (1.6 mg,40 min);Fr.A3(2.6 mg)用HPLC(流动相:77%乙腈-水;流速:2 mL/min)分离纯化得到化合物 8 (1.3 mg,39 min);Fr.A5(42.1 mg)用HPLC(流动相:80%甲醇-水;流速:2 mL/min)分离纯化得到化合物 7 (2.1 mg,26 min)、 1 (1.8 mg,52 min)、 4 (2.4 mg,57 min)、 5 (2.7 mg,62 min)、 6 (2.2 mg,67 min)、 3 (2.6 mg,81 min)和 9 (1.2 mg,85 min)。
1.4 生物活性测试本实验采用常规的MTT法(四氮唑盐还原法)对化合物 1 ~ 10 进行肿瘤细胞增殖抑制试验;采用CLSI(美国临床实验室标准化协会)推荐的微量液基稀释法检测化合物 1 ~ 10 对白假丝酵母菌(Candida albicans)和烟曲霉菌(Aspergillus fumigatus)的抑制活性。
2 结果和讨论本实验从中国南海侧软扁柳珊瑚的丙酮提取物乙醚萃取物中共分离得到10个开环甾醇类化合物,其中化合物 2 和 7 为首次从该属珊瑚中分离得到。
2.1 化合物 1 的结构鉴定白色粉末,[α]25D= +30.75°(c 0.16,CH3OH); ESI-MS (m/z): 451.65 [M+H]+。1HNMR (400 MHz,CD3OD): 6.53 (1H,d,J = 1.8 Hz,H-7),4.18 (1H,dd,J = 9.8,1.8 Hz,H-6),3.69 (2H,m,H2-11),3.45 (1H,m,H-3),3.25 (1H,m,H-14),2.22 (1H,br d,J = 12.5 Hz,H-4),2.05 (1H,t,J = 9.8 Hz,H-17),1.27 (3H,s,H3-21),1.10 (3H,s,H3-19),0.84 (3H,s,H3-18),0.86 (3H,d,J=6.6 Hz,H3-27),0.85 (3H,d,J = 6.6 Hz,H3-26); 13CNMR (100 MHz,CD3OD) : 206.2 (s,C-9),149.9 (d,C-7),136.9(s,C-8),76.3 (s,C-20),70.1 (d,C-3),69.7 (d,C-6),59.1 (t,C-11),53.1 (d,C-17),47.3 (d,C-5),47.3 (s,C-13),43.5 (d,C-14),42.1 (s,C-10),40.9 (t,C-22),40.0 (t,C-12),40.0 (t,C-24),33.2 (t,C-4),31.3 (t,C-1),30.7 (t,C-2),30.5 (d,C-25),27.5 (t,C-15),26.6 (q,C-21),23.9 (t,C-16),22.5 (t,C-23),20.0 (q,C-27),19.7 (q,C-26),19.6 (q,C-18),16.5 (q,C-19)。以上数据与文献[6]对照一致,故化合物 1 鉴定为subergorgol B [(20S*)-3β,6α,11,20-tetrahydroxy-9,11-seco-5α-cholest-7-en-9-one]。
2.2 化合物 2 的结构鉴定白色粉末,[α]25D = +11.24° (c 0.23,CH3OH); ESI-MS (m/z): 449.68 [M+H]+。1HNMR (400 MHz,CD3OD): 6.58 (1H,s,H-7),4.28 (1H,dd,J = 9.9,1.8 Hz,H-6),3.88 (1H,m,H-11),3.67 (1H,m,H-11),3.63 (1H,m,H-3),3.43 (1H,t,J = 10.1,9.6 Hz,H-14),2.31 (1H,br d,J = 11.0 Hz,H-4),1.14 (3H,s,H3-19),0.96 (3H,d,J = 6.8 Hz,H3-21),0.86 (3H,d,J = 7.0 Hz,H3-28),0.83 (3H,d,J = 6.6 Hz,H3-27),0.82 (3H,d,J = 6.6 Hz,H3-26),0.64 (3H,s,H3-18); 13CNMR (100 MHz,CD3OD): 206.6 (s,C-9),148.6 (d,C-7),136.6 (s,C-8),69.7 (d,C-3),68.8 (d,C-6),59.0 (t,C-11),49.7 (d,C-17),48.5 (t,C-5),46.1 (s,C-13),45.0 (s,C-10),42.7 (d,C-14),40.9 (t,C-12),39.1 (d,C-24),35.3 (d,C-20),33.1 (t,C-22),32.5 (t,C-4),31.9 (t,C-1),31.6 (d,C-25),31.4 (t,C-23),30.2 (t,C-2),26.6 (t,C-15),26.3 (t,C-16),20.5 (q,C-27),18.9 (q,C-21),17.7 (q,C-26),17.4 (q,C-18),16.1 (q,C-19),15.5 (q,C-28)。以上数据与文献[20]对照一致,故化合物 2 鉴定为sarcomilasterol。
2.3 化合物 3 的结构鉴定白色粉末,[α]25D= +23.44° (c 0.24,CH3OH); ESI-MS (m/z): 447.66 [M+H]+。1HNMR (400 MHz,CD3OD): 6.55 (1H,d,J = 5.8,1.8 Hz,H-7),5.24 (2H,m,H-22,H-23),4.17 (1H,br d,J = 9.9 Hz,H-6),3.72 (1H,m,H-11),3.60 (1H,m,H-11),3.45 (1H,m,H-3),3.25 (1H,ov,H-14),2.23 (1H,br d,J = 12.8 Hz,H-4),1.11 (3H,s,CH3-19),1.04 (3H,d,J = 6.8 Hz,H3-21),0.91 (3H,d,J = 6.8 Hz,H3-28),0.85 (3H,d,J = 7.0 Hz,H3-27),0.85 (3H,d,J = 7.0 Hz,H3-26),0.69 (3H,s,H3-18); 13CNMR (100 MHz,CD3OD): 206.1(s,C-9),149.3 (d,C-7),137.4 (s,C-8),136.2 (d,C-22),134.2 (d,C-23),70.8 (d,C-3),69.7 (d,C-6),59.2 (t,C-11),51.7 (d,C-17),49.6 (d,C-5),47.2 (s,C-13),46.1 (s,C-10),44.4 (t,C-24),43.8 (d,C-14),42.3 (t,C-12),40.2 (d,C-20),33.7 (t,C-4),33.2 (t,C-1),31.3 (t,C-2),29.1 (d,C-25),28.2 (t,C-15),27.1 (t,C-16),22.1 (q,C-21),20.6 (q,C-27),20.0 (q,C-26),18.1 (q,C-28),17.7 (q,C-18),16.5 (q,C-19)。 侧链C-24位手性依据C-28的化学位移来判断:C-28的化学位移为17.7 ppm左右时为24R构型,C-28的化学位移为18.1 ppm左右时则为24S构型[20]。本化合物的C-28的化学位移为18.1 ppm,所以其C-24的构型鉴定为S。以上数据与文献[10]对照一致,故化合物 3 鉴定为(24S)-methyl-3β,6α,11-trihydroxy-9,11-seco-5α-cholest-7,22(E)-diene-9-one。
2.4 化合物 4 的结构鉴定白色粉末,[α]25D=+20.12° (c 0.22,CH3OH); ESI-MS (m/z): 435.65 [M+H]+。1HNMR (400 MHz,CD3OD): 6.59 (1H,s,H-7),4.20 (1H,dd,J = 10.0,1.8 Hz,H-6),3.74 (1H,m,H2-11),3.60 (1H,m,H2-11),3.48 (1H,m,H-3),3.27 (1H,ov,H-14),2.27 (1H,br d,J = 11.6 Hz,H-4),1.01 (3H,d,J = 6.8 Hz,H3-21),1.15 (3H,s,H3-19),0.89 (3H,d,J = 6.5 Hz,H3-27),0.88 (3H,d,J = 6.5 Hz,H3-26),0.72 (3H,s,H3-18)。本化合物1HNMR图谱中,化学位移为3.48 ppm质子信号为典型的A环H-3仲醇质子信号,与邻位4个质子相互耦合形成多重峰;位于H-7的双键质子由于受到9-C=O的影响,强烈向低场位移到6.59 ppm;同样,H-6 由于受到邻位α,β-不饱和酮的影响,也显著向低场位移到4.20 ppm;3.74 ppm (m)及3.60 ppm (m)为9,11-开环导致的末端伯醇质子。以上特征信号说明化合物 4 具有与 1 ~ 3 相同的母核结构。与化合物 2 相比,本化合物结构的变化在于侧链的不同,化合物 2 的28-甲基氢信号在本化合物中消失,本化合物的结构因而鉴定为3β,6α,11-trihydroxy-9,11-seco-5α-cholest-7-ene-9-one。化合物的ESI-MS数据支持推导的结构,其1HNMR数据与文献[10]报道完全一致,化合物 4 的结构因此得以确定。
2.5 化合物 5 的结构鉴定白色粉末,[α]25D= +30.18° (c 0.25,CH3OH); ESI-MS (m/z): 433.64 [M+H]+。1HNMR (400 MHz,CD3OD): 6.54 (1H,d,J = 1.7 Hz,H-7),5.32 (1H,ddd,J = 15.4,6.8,6.6 Hz,H-23),5.25 (1H,dd,J = 15.4,6.6 Hz),4.16 (1H,dd,J = 9.8,1.8 Hz,H-6),3.71 (1H,m,H-11),3.59 (1H,m,H-11),3.45 (1H,m,H-3),3.25 (1H,ov,H-14),2.23 (1H,ov,H-4),1.11 (3H,s,H3-19),1.04 (3H,d,J = 6.8 Hz,H3-21),0.89 (3H,d,J = 6.6 Hz,H3-27),0.88 (3H,d,J = 6.6 Hz,H3-26),0.69 (3H,s,H3-18)。本化合物1HNMR图谱低场的α,β-不饱和酮特征双键信号(6.54 d,1.7)及中场区仲醇及伯醇质子信号(4.16 dd,9.8,1.8; 3.71 m; 3.59 m; 3.45 m)与化合物 1 ~ 4 完全一致,说明具有相同的9,11-开环甾醇母核结构。与化合物 4 相比,本化合物在低场区发现一对反式双键质子信号(5.32,ddd,15.4,6.6,6.6; 5.25,dd,15.4,6.6),说明侧链上具有22,23-双键取代,H-21则相应由1.01向低场位移到1.04 ppm,化合物的ESI-MS数据支持结构鉴定的结果。以上数据与文献[21]对照一致,化合物 5 因此鉴定为subergorgol I [3β,6α,11-trihydroxy-9,11-seco-5α-cholest-7,22(E)-dien-9-one]。
2.6 化合物 6 的结构鉴定白色粉末,[α]25D= +42.11° (c 0.21,CH3OH); ESI-MS (m/z): 419.61 [M+H]+。1HNMR (400 MHz,CD3OD): 6.53 (1H,d,J = 1.8 Hz,H-7),5.28 (1H,dd,J = 15.3,8.5 Hz,H-22),5.27 (1H,dd,J = 15.3,6.6 Hz,H-23),4.17 (1H,dd,J = 9.8,1.7 Hz,H-6),3.71 (1H,m,H-11),3.59 (1H,m,H-11),3.45 (1H,m,H-3),3.24 (1H,m,H-14),2.23 (1H,ov,H-4),1.11 (3H,s,H3-19),1.02 (3H,d,J = 6.8 Hz,H3-21),0.94 (3H,d,J = 6.7 Hz,H3-25),0.93 (3H,d,J = 6.7 Hz,H3-26),0.68 (3H,s,H3-18)。化合物 6 中低场区的质子同样表现出上述化合物的特征信号(6.53 d,1.8; 4.17 dd,9.8,1.7; 3.71 m; 3.59 m; 3.45 m),说明具有相同的9,11-开环甾醇母核结构。与化合物 5 相比,其侧链上的22,23-反式双键信号(5.28 dd,J = 15.3,8.5 Hz; 5.27 dd,J = 15.3,6.6 Hz)仍然存在,但其H3-26及H3-27的信号显著向低场位移(化合物5: 0.88 ppm及0.89 ppm;化合物 6 : 0.93 ppm及0.94 ppm),推测化合物 6 的C-25可能缺失。化合物的ESI-MS结果证实了对结构的推测。以上数据与文献[22]对照一致,故化合物 6 鉴定为24-nor-3β,6α,11-trihydroxy-9,11-seco-5α-cholest-7,22(E)-dien-9-one。
2.7 化合物 7 的结构鉴定白色粉末,[α]25D= +10.75° (c 0.20,CH3OH); ESI-MS (m/z): 477.69 [M+H]+。1HNMR (400 MHz,CD3OD): 6.54 (1H,s,H-7),4.24 (2H,m,H2-11),4.17 (1H,dd,J = 10.0,1.8 Hz,H-6),3.45 (1H,m,H-3),3.25 (1H,ov,H-14),2.23 (1H,br d,J = 11.6 Hz,H-4),1.96 (3H,s,-OAc),0.96 (3H,d,J = 6.8 Hz,H3-21),1.09 (3H,s,H3-19),0.66 (3H,s,H3-18),0.85 (3H,d,J = 6.6 Hz,H3-27),0.84 (3H,d,J = 6.6 Hz,H3-26)。化合物 7 同样具有9,11-开环甾醇母核结构,但其H2-11伯醇信号质子显著向低场移动至4.24 m (2H),结合高场区出现的乙酰甲基特征质子信号(1.96,s),说明11位羟基为乙酰氧基取代。其侧链1HNMR数据与化合物 4 一致,表明具有相同的侧链结构。ESI-MS结果支持对结构的推导。以上数据与文献[23]报道的数据一致,故化合物 7 鉴定为11-acetoxy-3β,6α-dihydroxy-9,11-seco-5α-cholest-7-en-9-one。
2.8 化合物 8 的结构鉴定白色粉末,[α]25D= +31.10° (c 0.12,CH3OH); ESI-MS (m/z): 433.64 [M+H]+。1HNMR (400 MHz,CD3OD): 6.58 (1H,d,J = 1.5 Hz,H-7),5.12 (1H,t,J = 6.5 Hz,H-24),4.28 (1H,br d,J = 8.4 Hz,H-6),3.88 (1H,m,H-11),3.66 (1H,m,H-11),3.62 (1H,m,H-3),3.43 (1H,t,J = 9.8,10.3 Hz,H-14),2.32 (1H,m,H-4),1.14 (3H,s,H3-19),0.96 (3H,d,J = 6.8 Hz,H3-21),1.68 (6H,s,H3-26,H3-27),0.65 (3H,s,H3-18)。本化合物与化合物 4 具有完全一致的母核特征信号,表明具有相同的母核结构。有意思的是化合物 4 的H3-26及27异丙甲基裂分信号(0.89,6H,d,J = 6.5 Hz)在本化合物中均变成单峰且向低场强烈位移 (1.68,6H,s),说明侧链上存在Δ24双键。1HNMR低场区出现的三重裂解烯氢质子信号(5.12,1H,t,J = 6.5 Hz),证实了对结构的推导。化合物8的ESI-MS和1HNMR数据与文献[6]对照一致。故化合物8 鉴定为subergorgol H [3β,6α,11-trihydroxy-9,11-seco-5α-cholest-7,24-dien-9-one]。
2.9 化合物 9 的结构鉴定白色粉末,[α]25D= +5.90° (c 0.12,CH3OH); ESI-MS (m/z): 447.66 [M+H]+。1HNMR (400 MHz,CD3OD) : 6.55 (1H,d,J = 1.8 Hz,H-7),4.71 (1H,s,H-28),4.64 (1H,s,H-28),4.17 (1H,dd,J = 10.0,2.0 Hz,H-6),3.71 (1H,m,H-11),3.57 (1H,m,H-11),3.45 (1H,m,H-3),3.25 (1H,ov,H-14),2.23 (1H,ov,H-4),1.12 (3H,s,H3-19),1.02 (3H,ov,H3-21),1.01 (3H,d,J = 6.6 Hz,H3-27),1.00 (3H,d,J = 6.6 Hz,H3-26),0.69 (3H,s,H3-18)。本化合物与化合物 4 显示相同的母核1HNMR信号,但支链1HNMR信号中多了一对典型的末端双键质子信号(4.71 s,4.64 s),H3-26及27异丙甲基裂分信号(0.89,3H; 0.89,3H)向低场显著位移(1.00,3H; 1.01,3H),因此推断分子中存在C-28末端双键。化合物 9 的ESI-MS以及1HNMR数据与文献[24]对照一致,故鉴定为3β,6α,11-trihydroxy-24-methylene-9,11-seco-5α-cholest-7-en-9-one。
2.10 化合物 10 的结构鉴定白色粉末,[α]25D= +35.10° (c 0.16,CH3OH); ESI-MS (m/z): 461.69 [M+H]+。1HNMR (400 MHz,CD3OD): 6.58 (1H,s,H-7),5.10 (1H,q,J = 6.7 Hz,H-28),4.28 (1H,d,J = 10.4 Hz,H-6),3.87 (1H,m,H-11),3.65 (1H,m,H-11),3.59 (1H,m,H-3),3.43 (1H,t,J = 10.3,9.8 Hz,H-14),2.31 (1H,m,H-4),1.59 (3H,d,J = 6.8 Hz,H3-29),1.14 (3H,s,H3-19),0.98 (3H,d,J = 6.8 Hz,H3-21),0.98 (3H,d,J = 6.8 Hz,H3-27),0.97 (3H,d,J = 6.8 Hz,H3-26),0.65 (3H,s,H3-18)。化合物10 的1HNMR数据与化合物 9 的非常相似,区别在于化合物 9 的末端烯氢在本化合物中被一个烯氢四重峰取代,结合出现的二重裂分甲基质子信号(1.59 d,6.8),说明本化合物中C-28位有一个烯键取代。以上数据与文献[6]对照一致,故化合物 10 鉴定为subergorgol J [(24Z)-3β,6α,11-trihydroxy-9,11-seco-5α-stigmast-7,24(28)-dien-9-one]。
2.11 生物活性测试结果表明,化合物 3 ~ 6及9 对A549和MG63表现出了不同程度的肿瘤细胞生长抑制活性,其IC50值分别为6.31、30.42、8.33、9.57、3.30 μg/mL和30.83、21.32、9.19、28.01、8.62 μg/mL;其他化合物不显示肿瘤细胞生长抑制活性。其中,化合物 9 的活性最强,它对A549的IC50值已达3.30 μg/mL,与阳性对照药多柔比星活性相似。初步的构效关系分析发现,化合物 4和7 侧链相同,仅母核上11位取代基由-OH变成-OAc,活性变化不大。除化合物 7 外的化合物均具有相同的母核结构,其化学多样性系由侧链的不同所致,这些化合物表现的肿瘤细胞生长抑制活性也相应不同。与化合物 4 相比,5 的侧链具有22,23-双键取代,活性显著增强,说明侧链Δ22取代可使活性显著增强;与化合物 5相比,8 侧链上的双键取代变成侧链Δ24活性消失,说明侧链双键取代的位置对活性也有影响;化合物 5和6 侧链都具有22,23-双键取代,6 侧链上C-24的降解对A549活性的活性没有影响,但导致化合物对MG63的抑制活性显著降低;活性很好的化合物 9 侧链24,28-末端双键变成24-烯丙基取代( 10 )时,活性完全消失。可见该类甾体化合物侧链的不同可对其活性产生重要影响。
对10个开环甾醇进行了抗真菌活性筛选,结果显示受试化合物对白假丝酵母菌和烟曲霉菌均没有表现出抑制作用,其最低抑制浓度(MIC)均大于64 μg/mL。
| [1] | 黄宗国. 中国海洋生物种类与分布[M]. 北京: 海洋出版社, 2008:300-326. |
| [2] | 李 俊,李永爱,许 晶,唐旭利,李平林,李国强. 中国南海网状软柳珊瑚化学成分研究[J]. 中国海洋药物, 2011, 30: 31-36. |
| [3] | Ning Q J, Chen M, Li X B, Wang C Y. Pregnane steroids from the South China Sea gorgonian coral Subergorgia suberosa [J]. Biochem Syst Ecol, 2013, 49: 58-61. |
| [4] | Tomas R, Lumir O H, Valery M D, Karel S. Identification of the eight-membered heterocycles hicksoanes A-C from the Gorgonian Subergorgia hicksoni[J]. Eur J Org Chem, 2008, 7: 1265-1270. |
| [5] | Kong W W, Shao C L, Wang C Y, Xu Y, Qian P Y, Chen A N, et al. Diterpenoids and steroids from Gorgonian Subergorgia mollis [J]. Chem Nat Compd, 2012, 48: 512-515. |
| [6] | Zhang G, Tang X L, Cheng C L, Gong K K, Zhang X W, Zhu H Y, et al. Cytotoxic 9,11-secosteroids from the South China Sea gorgonian Subergorgia suberosa [J]. Steroids, 2013, 78: 845-850. |
| [7] | Zhang J, Liang Y, Wang K L, Liao X J, Deng Z, Xu S H. Antifouling steroids from the South China Sea gorgonian coral Subergorgia suberosa [J]. Steroids, 2014, 79: 1-6. |
| [8] | Yang J, Qi S H, Zhang S, Wu J, Xiao Z H. Three polyoxygenated steroids from the South China Sea gorgonian coral Subergorgia reticulate[J]. Chin J Chem, 2005, 23: 1218-1222. |
| [9] | Wu S L, Wang G H, Dai C F, Sheu J H. Pregnane-based steroids from a Formosan gorgonian Subergorgia mollis[J]. J Chin Chem Soc, 2004, 51: 205-208. |
| [10] | Aknin M, Costantino V, Mangon A, Fattorusso E, Gaydou E M. New 9,11-secosterols from gorgonia Subergorgia suberosa of the Indian Ocean [J]. Steroids, 1998, 63: 575-578. |
| [11] | Mol V P L, Raveendran T V, Naik B G, Kunnath R J, Parameswaran P S. Calamenenes, aromatic bicyclic sesquiterpenes from the Indian gorgonian Subergorgia reticulate (Ellis and Solander,1786) [J]. Nat Prod Res, 2011, 25: 169-174. |
| [12] | Wang G H, Ahmed A F, Sheu J H, Duh C Y, Shen Y C, Wang L T. Suberosols A-D, four new sesquiterpenes with β-caryophyllene skeletons from a Taiwanese gorgonian coral Subergorgia suberosa [J]. J Nat Prod, 2002, 65: 887-891. |
| [13] | Wang G H, Ahmed A F, Kuo Y H, Sheu J H. Two new subergane-based sesquiterpenes from a Taiwanese gorgonian coral Subergorgia suberosa [J]. J Nat Prod, 2002, 65: 1033-1036. |
| [14] | Qi S H, Zhang S, Huang H. Purine alkaloids from the South China Sea gorgonian Subergorgia suberosa [J]. J Nat Prod, 2008, 71: 716-718. |
| [15] | Qi S H, Zhang S, Gao C H, Li Q X. A cytotoxic sesquiterpene alkaloid from the South China Sea gorgonian Subergorgia suberosa [J]. J Nat Prod, 2005, 68: 1288-1289. |
| [16] | Qi S H, Zhang S, Gao C H, Li Q X. Purine and pyrimidine derivatives from the South China Sea gorgonian Subergorgia suberosa [J]. Chem Pharm Bull, 2008, 56: 993-994. |
| [17] | Liao X J, Tang L D, Liang Y W, Jian S L, Xu S H, Liu Y H. New pentahydroxylated steroids from the South China Sea gorgonian Subergorgia suberosa [J]. Chem Biodivers, 2012, 9: 370-375. |
| [18] | Bokesch H R, McKee T C, Cardellina J H, Boyd M R. Suberosenone, a new cytotoxin from Subergorgia suberosa [J]. Tetrahedron Lett, 1996, 37: 3259-3262. |
| [19] | Subrahmanyam C, Kumar S R, Reddy G D. Bioactive compounds from the Indian Ocean gorgonian Subergorgia suberosa (Pallas) [J]. Indian J Chem Sec B, 2005, 44B: 2186-2188. |
| [20] | Sright J L C, McInnes A G, Shimizu S, Smith D G, Walter J A,Idler D, et al. Identification of C-24 alkyl epimers of marine sterols by 13C nuclear magnetic resonance spectroscopy [J]. Can J Chem, 1978, 56: 1898-1903. |
| [21] | Chau V M, Nguyen X C, Tran A T, Eun M C, Young H K, Phan V K. A new 9,11-secosterol from the Vietnamese sea soft coral, Sarcophyton mililatensis, increases the function of osteoblastic MC3T3-E1 cells [J]. Nat Prod Commun, 2007, 2: 1095-1100. |
| [22] | Jäälaid R, Järving I, Pehk T, Lille U. First partial synthesis of 9,11-secosterols with the modified side chain [J]. Proc Estonian Acad Sci Chem, 1998, 47: 196-199. |
| [23] | Ioannou E, Abdel-Razik A F, Alexi X, Vagias C, Alexis M N, Roussis V. 9,11-Secosterols with antiproliferative activity from the gorgonian Eunicella cavolini [J]. Bioorg Med Chem, 2009, 17: 4537-4541. |
| [24] | Migliuolo A, Piccialli V, Sica D. Two new 9,11-secosterols from the marine sponge Spongia officinalis. Synthesis of 9,11-seco-3β,6α,11-trihydroxy-5α-cholest-7-en-9-one [J]. Steroids, 1992, 57: 344-347. |
 2015, Vol. 36
2015, Vol. 36


