急性脊髓损伤在创伤领域的发病率非常高,由于病情急、病残率高,一直是困扰医学工作者的难题。相关学者发现脊髓损伤后脊髓内的神经元会发生凋亡,使神经信号的传导不通畅,导致机体无法完成大脑所发出的指令。因此,研究者认为,对脊髓神经进行保护,延缓和阻断神经细胞的凋亡是治疗脊髓损伤的主要目标[1]。
研究发现,很多中草药中的单体或混合物对脊髓损伤具有一定的保护作用,其中合欢花总黄酮和三七皂苷Rg1能够促进大鼠脊髓损伤后损伤段脊髓的脑源性神经营养因子(brain derived eeurotrophic factor,BDNF)和脊髓内的神经生长因子(nerve growth factor,NGF)表达,从而起到脊髓保护的作用[2]。刺五加皂苷(acanthopanax senticosus saponins,ASS)是从刺五加中提取出的黄酮类制剂,在大脑缺血的相关研究中发现刺五加皂苷对脑缺血后脑组织具有较好的保护作用[3],而刺五加皂苷对脊髓损伤的作用如何却少有报道。若刺五加皂苷对损伤脊髓具有较好的保护作用,无疑将为临床脊髓损伤的救治提供一种新的思路。本研究探讨刺五加皂苷对脊髓损伤后组织内NGF和BDNF两种蛋白表达的影响,以期在传统中草药中寻找一种利于损伤脊髓保护的新途径。
1 材料和方法 1.1 试剂及仪器刺五加皂苷(上海纯优生物科技有限公司),动物组织全蛋白提取试剂盒(北京鼎国试剂有限公司),BDNF和NGF山羊抗鼠一抗(Abcam 公司),丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测试试剂盒(碧云天试剂有限公司),高速低温离心机、酶标仪、核酸蛋白分析仪(Eppendorf公司),生物显微镜(日本奥林巴斯公司)。
1.2 动物分组SPF级雄性SD大鼠45只,体质量220~240 g,由长海医院实验动物中心[动物生产许可证号:SCXK(沪)X2012-0024]提供。 将SD大鼠随机分成3组:假手术组、模型组和刺五加皂苷干预组,每组15只。
1.3 动物模型的建立所有大鼠用10%水合氯醛以 0.3 mL/100 g 的剂量麻醉,后固定于小动物手术台上,于无菌的环境下显露大鼠T8~T11,然后咬除棘突暴露出脊髓,剔除外部硬膜,采用Allen’s改良的方法进行垂直打击大鼠,打击后鼠尾出现无规则的痉挛性摆动,双下肢呈回缩性扑动,硬膜表面充血水肿,说明造模成功[4]。假手术组仅咬除棘突后缝合,正常饲养;模型组造模后进行生理盐水腹腔注射,持续7 d;刺五加皂苷干预组造模后每日腹腔注射100 mg/kg刺五加皂苷,持续7 d。实验过程中每天测量动物体质量,观察动物体态、被毛、运动恢复等变化,造模后第8天进行解剖取材。
1.4 ELISA法检测血清中MDA含量和SOD活性动物解剖时用10%水合氯醛麻醉,打开腹腔进行腹主动脉采血,将所采血液中的血清分离并放入-20℃环境保存,按试剂盒说明书的操作步骤进行血清中MDA含量和SOD活性的检测。
1.5 H-E染色观察脊髓组织病理变化解剖时将动物第7~11段脊髓组织取出,将脊髓损伤处横向切下置于10%中性甲醛中固定,3 d后进行取材(脊髓背侧损伤区域)、脱水、石蜡包埋、切片、染色等步骤,然后对封片镜检,观察动物脊髓的病理学变化。
1.6 蛋白质印迹法检测脊髓组织BDNF、NGF蛋白的表达按照全蛋白提取试剂盒提取击碎组织的全蛋白,作蛋白质浓度检测、定量,然后将各组所提取蛋白进行垂直电泳、转膜、封闭,封闭后进行一抗孵育、二抗孵育,显影定影后用化学凝胶成像系统进行拍照,用图像分析软件进行分析。
1.7 统计学处理采用SPSS 17.0软件进行统计学分析,计量资料用x±s表示,应用单因素方差分析进行检验,检验水准(α)为0.05。 2 结 果 2.1 动物生理学变化
假手术组大鼠麻醉恢复后即能够正常饮食;模型组于造模后第3天开始逐渐恢复运动,动物被毛无光泽,状态差;刺五加皂苷干预组在造模后第3天开始逐渐恢复运动,较模型组大鼠活跃,饮食量也较模型组大,被毛光泽度不佳。
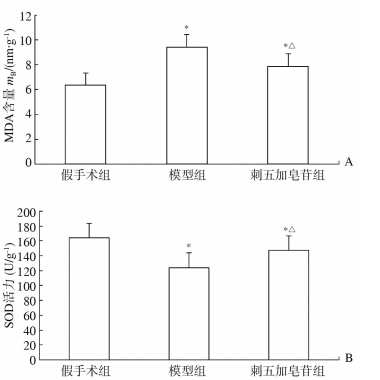
2.2 血清中MDA含量及SOD活性ELISA法检测结果显示,与假手术组比较,模型组大鼠和刺五加皂苷干预组大鼠血清中MDA含量升高(P<0.05),SOD活性下降(P<0.05);与模型组相比,刺五加皂苷干预组大鼠血清中的MDA含量降低(P<0.05),SOD活性升高(P<0.05)。见图 1。
|
图 1 各组间大鼠血清中MDA含量(A)、SOD活性(B)比较 MDA:丙二醛;SOD:超氧化物歧化酶.*P<0.05与假手术组比较;△P<0.05与模型组比较 |
假手术组大鼠脊髓内神经组织细胞染色均匀,神经细胞被内膜均匀包裹,未见明显异常(图 2A)。模型组灰白质界限不清,结构散乱,有片状出血灶;灰质区有部分溶解坏死,神经纤维水肿,轴索与髓鞘间隙增大,神经细胞减少、退变,髓鞘散乱、破裂,细胞充盈血管;胞质中尼氏小体稀疏浅染,部分神经元变性、坏死、胞质尼氏小体几乎消失(图 2B)。刺五加皂苷干预组脊髓灰白质界限清楚,结构完整,有点状出血灶,神经元部分水肿变性,尼氏小体密度降低,轴索水肿(图 2C)。

|
图 2 各组大鼠脊髓组织H-E染色结果 A:假手术组;B:模型组;C:刺五加皂苷组. Original magnification:×40 |
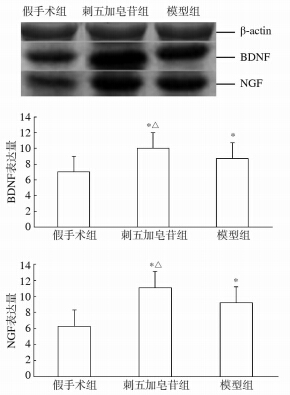
蛋白质印迹检测结果(图 3)显示,与假手术组比较,模型组和刺五加皂苷干预组的BDNF、NGF蛋白相对表达量均上升(P<0.05),且刺五加皂苷干预组的BDNF、NGF蛋白相对表达量高于模型组(P<0.05)。
|
图 3 各组大鼠脊髓组织BDNF和NGF相对表达量 BDNF:脑源性神经营养因子;NGF:神经生长因子。*P<0.05与假手术组比较;△P<0.05与模型组比较 |
脊髓损伤是脊柱外科一种常见病,不同原因造成的直接或间接损伤均会产生诸多神经症状,治疗时间及损伤的严重程度对患者的预后具有较大影响。当脊髓损伤时,可造成损伤平面以下脊髓神经支配的肢体发生感觉和运动障碍,甚至截瘫,如果没有得到及时、有效的治疗,这种损伤会导致较高的病残率甚至病死率,给患者带来严重的生理、心理负担,亦是一种社会经济学问题[5, 6]。
中药在我国具有几千年的历史,对人参、刺五加等中药材的研究已较深入,刺五加具有非常高的药用价值。刺五加对机体应激反应的调节较强,其改善睡眠缺乏导致的疲劳状态效果强于人参,刺五加还具有中枢神经兴奋和抑制双向调节的作用,能够改善记忆力,提高大脑劳动效能和镇静安神的效果[7]。因脊髓组织属于中枢神经系统,我们猜想刺五加对脊髓神经亦可能起到一定的保护作用,而这种保护作用的机制是否会通过调节某些神经营养因子而实现,这成为我们关注的重点。
研究表明,神经元的存活及其功能的正常维持需要依赖于神经营养因子,NGF和BDNF是神经营养因子中的重要成员,通过与神经元细胞膜上的受体结合从而发挥生物学活性,对神经正常的功能和结构以及对大脑功能的保护具有重要的作用[8, 9, 10]。当神经元外源性损伤产生时,会引起内源性神经营养因子的释放增加,从而对神经元的正常功能和结构进行维持和保护。NGF有3个亚型,这3个亚型中β亚单位是活性区,具有高度同源性的结构和明显的中间特异性[11]。NGF既能够促突起生长又具有神经元营养的作用,是一种具有双重功能的神经细胞的生长调节因子,对神经元的分化生长和功能特性具有重要的调控作用。BDNF是神经营养家族的重要成员,在海马和脊髓组织中呈现出高表达,具有促进神经元的生长、分化、再生等营养作用[12, 13, 14]。
本研究结果显示,刺五加皂苷干预组大鼠在干预后第3天开始逐渐恢复运动,较模型组动物活跃。且刺五加皂苷干预组大鼠血清中的MDA含量低于模型组大鼠,血清中SOD活性高于模型组,说明刺五加皂苷能够降低大鼠血清中的MDA含量,使SOD的活性升高,这对损伤的脊髓组织修复具有促进作用,脊髓病理结果证实了这一点。 大鼠脊髓组织的蛋白质印迹检测结果显示,模型组和刺五加皂苷干预组的BDNF和NGF蛋白相对表达量较假手术组上升(P<0.05),说明损伤后脊髓损伤组启动了自我修复机制;刺五加皂苷干预组的BDNF和NGF蛋白相对表达量高于模型组(P<0.05),考虑可能是由于刺五加皂苷的干预作用使NGF和BDNF表达增加,从而对机体修复神经损伤起到促进作用。
通过本研究,我们可以看出刺五加皂苷对大鼠损伤脊髓具有一定的保护作用,促进了脊髓组织中星形胶质细胞和神经元细胞内BDNF和NGF的表达,使受损的神经元修复,降低脊髓组织的损伤程度。
| [1] | Dong Y, Yang L, Yang L, Zhao H, Zhang C, Wu D.Transplantation of neurotrophin-3-transfected bone marrow mesenchymal stem cells for the repair of spinal cord injury[J].Neural Regen Res,2014,9:1520-1524. |
| [2] | 黄纯海,王廷华,李 群.脊髓全横断大鼠神经生长因子和脑源性神经营养因子表达及三七皂苷的干预效应[J]. 中国组织工程研究与临床康复,2007,11:8276-8279. |
| [3] | 睢大员,于晓风,曲绍春,徐丽华,王志才,陈燕萍. 刺五加叶皂苷对实验性脑缺血大鼠的保护作用[J].中草药,2005,36:561-563. |
| [4] | Wang F, Huang S L, He X J, Li X H. Determination of the ideal rat model for spinal cord injury by diffusion tensor imaging[J].Neuroreport,2014,25:1386-1392. |
| [5] | Wang T, Wang S W, Zhang Y, Wu X F, Peng Y, Chao Z,et al. Related citations scorpion venom heat-resistant peptide (SVHRP) enhances neurogenesis and neurite outgrowth of immature neurons in adult mice by up-regulating brain-derived neurotrophic factor (BDNF)[J].PLoS One,2014,9:e109977. |
| [6] | Salam E A, Abdel-Meguid I E, Shatla R, Korraa S. Evaluation of neural damage in Duchenne muscular dystrophy patients[J].Acta Myol,2014,33:13-18. |
| [7] | 朱 蕾,张 茹,李廷利.刺五加对睡眠剥夺大鼠学习记忆及海马单胺类神经递质的影响[J].中国实验方剂学杂志,2012,18:219-222. |
| [8] | Xiang J, Pan J, Chen F, Zheng L, Chen Y, Zhang S, et al. L-3-n-butylphthalide improves cognitive impairment of APP/PS1 mice by BDNF/TrkB/PI3K/AKT pathway[J].Int J Clin Exp Med,2014,7:1706-1713. |
| [9] | Han K, Jia N, Li J, Yang L, Min L Q. Chronic caffeine treatment reverses memory impairment and the expression of brain BNDF and TrkB in the PS1/APP double transgenic mouse model of Alzheimer's disease[J].Mol Med Rep,2013,8:737-740. |
| [10] | Meng D, Wu T, Rao U, North C S, Xiao H, Javors M A, et al. Serum NPY and BNDF response to a behavioral stressor in alcohol-dependent and healthy control participants[J].Psychopharmacology (Berl), 2011,218:59-67. |
| [11] | Ilag L L, Lönnerberg P, Persson H, Ibáñez C F.Role of variable beta-hairpin loop in determining biological specificities in neurotrophin family[J].J Biol Chem,1994,269:19941-19946. |
| [12] | Kir H M, Sahin D, Oztaş B, Musul M, Kuskay S.Effects of single-dose neuropeptide Y on levels of hippocampal BDNF, MDA, GSH, and NO in a rat model of pentylenetetrazole-induced epileptic seizure[J].Bosn J Basic Med Sci,2013,13:242-247. |
| [13] | Kim G, Kim E.The effects of antecedent exercise on motor function recovery and brain-derived neurotrophic factor expression after focal cerebral ischemia in rats[J].J Phys Ther Sci,2013,25:553-556. |
| [14] | Maghsoudi N, Ghasemi R, Ghaempanah Z, Ardekani A M, Nooshinfar E, Tahzibi A.Effect of chronic restraint stress on HPA axis activity and expression of BDNF and Trkb in the hippocampus of pregnant rats: possible contribution in depression during pregnancy and postpartum period[J].Basic Clin Neurosci,2014,5:131-137. |
 2015, Vol. 36
2015, Vol. 36


