2. 杭州奥默医药股份有限公司, 杭州 310011
2. Hangzhou Adamerck Pharmlabs Inc., Hangzhou 310011, Zhejiang, China
罗库溴铵和维库溴铵是非去极化神经肌肉阻滞剂,它们起效较慢,作用持续时间却长,因此药物一旦使用过量,则会造成肌肉无力、急性呼吸衰竭,甚至导致永久性脑损伤。环糊精(cyclodextrins,CD)是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下所生成的一系列环状低聚糖的总称[1]。由于环糊精的外缘亲水而内腔疏水,因此它最显著的分子特征是能够提供一个疏水空腔,作为主体包合各种适当的客体[2]。药物作为客体分子经包合后,溶解度增大,稳定性提高,释药速率得到改变,进一步可以提高药物的生物利用度,降低药物毒副作用等。γ-环糊精(γ-CD)分子具有较大的孔洞空隙,能包合较大的客体分子。奥美克松钠Aom0498-16(HS-7)和舒更葡糖(Sugammadex)是γ-CD的衍生物,目前临床上已采用Sugammadex对肌松药进行包合,但Sugmmadex仅在欧盟国家上市,并且其昂贵的价格限制了它的广泛应用。本研究拟考察这3种γ-CD与罗库溴铵、维库溴铵的相互作用,并为环糊精与药物之间的相互作用研究提供可行的技术方法。
环糊精包合常数的测定方法主要有紫外-可见分光光度法、荧光法、核磁共振法、毛细管电泳法、高效液相色谱法、相溶解度法以及等温滴定量热法(ITC)等,它们具有各自的优缺点和适用范围[3]。等温滴定量热法对被研究体系的溶剂性质、光谱性质和电学性质等没有任何限制条件,具有样品用量小、方法灵敏度和准确度高的优点,是鉴定分子间相互作用的首选方法[4, 5, 6]。紫外-可见分光光度法适用于测定k值范围为102~105 L/mol的药物,并且该药物必须具有较强的紫外吸收[3],实验操作同样快速、简便、成本低。核磁共振波谱法准确度高、重现性好、可利用数据多,但由于仪器昂贵而受到限制[7]。本研究采用等温滴定量热法、紫外-可见分光光度法和核磁共振谱二维相关谱和氢谱法3种方法从不同的侧面对γ-CD及其2种衍生物进行表征。 1 材料和方法 1.1 仪器与试剂
仪器:MicroCal iTC200型等温滴定量热仪(通用电气医疗集团);CARY 50 Conc型紫外-可见分光光度计(美国瓦里安公司);AVANCEⅡ600型核磁共振波谱仪(瑞士布鲁克公司);SPD121P型离心浓缩仪(美国赛默飞世尔科技);Fresco 17 型Heraeus®微量离心机(美国赛默飞世尔科技)。
试剂:Sugammadex[8]注射剂(含量:100 mg/mL,批号:439090,荷兰欧加农生物科技),HS-7(含量:91.7%,批号:ST130601,杭州奥默医药股份有限公司),γ-CD(含量:98.8%,批号:20130423,江苏丰园生物技术有限公司),罗库溴铵(含量:99.3%,批号:X1-130101,杭州奥默医药股份有限公司),维库溴铵(含量:100.5%,批号:X1-120902,杭州奥默医药股份有限公司);其余试剂均为国产分析纯试剂,实验用水为二次蒸馏水。 1.2 等温滴定量热法 1.2.1 受试化合物溶液的制备
用去离子水溶解并配制3种环糊精及2种肌松药,使HS-7浓度为0.19 mmol/L时罗库溴铵、维库溴铵浓度为 1 mmol/L,Sugammadex、γ-CD浓度为0.16 mmol/L时罗库溴铵、维库溴铵浓度为1.6 mmol/L。 1.2.2 检测条件及操作过程
在样品池中注入500 μL被滴定的环糊精溶液,肌松药40 μL装入注射器,恒温至25℃,控制搅拌速率为300 r/min,待仪器自动平衡后,记录60 s后分别开始滴定,各连续滴定25滴,首滴0.4 μL,后24滴1.5 μL,间隔时间为100 s;其中维库溴铵滴定γ-CD时,连续滴定20滴,首滴0.4 μL,后19滴2 μL,间隔时间为120 s[9]。 1.2.3 数据处理
使用Origin7.0软件中one binding site model对每组滴定数据分别进行拟合,得到每组滴定反应的结合常数及相关热力学常数。 1.3 紫外光谱法 1.3.1 储备液的配制
精密称取适量罗库溴铵、维库溴铵标准品及γ-CD,置于10 mL容量瓶内,加入去离子水溶解并稀释到刻度,得到质量浓度为1 mg/mL的罗库溴铵、维库溴铵储备液及浓度为100 mmol/L的γ-CD储备液,备用。 1.3.2 药物浓度和测定波长的选择
以二次蒸馏水为空白,在200~400 nm对药物溶液和γ-CD作紫外光谱扫描,结果表明在207.0 nm处罗库溴铵有最大吸收峰,γ-CD无紫外吸收,故选择207.0 nm为罗库溴铵的测定波长。控制最大吸收峰对应的光密度值在0.4~0.7,此时罗库溴铵的质量浓度0.25 mg/mL为测定浓度;维库溴铵的测定波长为210.0 nm,测定浓度为0.5 mg/mL。 1.3.3 结合比例测定
固定药物和γ-CD的总摩尔浓度,使二者摩尔比分别为1∶3、1∶2、2∶3、1∶1、3∶2、2∶1、3∶1。由于γ-CD在207.0、210.0 nm处无紫外吸收,以去离子水为空白,于207.0、210.0 nm处测定光密度值,计算γ-CD包合物与相同浓度的溶液光密度之差ΔD,ΔD最大处对应的摩尔比即为γ-CD与药物的结合比例[10]。 1.3.4 γ-CD与药物结合常数的测定
固定药物溶液浓度,取γ-CD的浓度为0.01、0.012 5、0.016 7、0.02、0.025 mol/L。对各组溶液在200~400 nm作紫外扫描,测定其光密度的变化。 1.4 核磁共振法
称取罗库溴铵、维库溴铵、γ-CD、HS-7和Sugammadex各0.01 mmol,分别置于直径为5 mm的核磁管中,加入500 μL D2O溶解,测定一维氢谱(1HNMR)。
按照摩尔比1∶1的比例,制备罗库溴铵、维库溴铵与3种环糊精的固体包合物,加入500 μL D2O溶解,测定1HNMR。
称取0.01 mmol的γ-CD、HS-7和Sugammadex置于直径为5 mm的核磁管中,各加入500 μL的D2O溶解,测定其核磁共振二维相关谱(COSY)。 2 结 果 2.1 等温滴定量热法测定结果
根据表 1数据,可知HS-7、Sugammadex与罗库溴铵、维库溴铵均为1∶1包合,γ-CD与罗库溴铵为2∶1包合,HS-7、Sugammadex与罗库溴铵有非常强的结合,其结合常数k均大于107 L/mol。对比HS-7、Sugammadex和γ-CD,HS-7对于维库溴铵和罗库溴铵的结合都是最强烈的。对比HS-7、Sugammadex与维库溴铵以及HS-7、Sugammadex与罗库溴铵的结合,两种环糊精与罗库溴铵的结合常数均大于两种环糊精与维库溴铵的结合常数[11, 12](γ-CD与维库溴铵结合的拟合效果不佳,数据不准确,不予采纳)。
|
|
表 1 HS-7、Sugammadex和γ-CD与维库溴铵、罗库溴铵结合相关热力学参数 Tab 1 Thermodynamic parameters of HS-7,Sugammadex,and γ-CD combined with vecuronium and rocuronium |
连续递变实验结果表明,γ-CD与罗库溴铵或维库溴铵以2∶1摩尔比包合时,光密度相差最大(表 2)。紫外扫描显示,药物在200~400 nm范围内有强吸收,可以用紫外光谱法测定包合物的结合常数k。γ-CD与药物在水溶液中的结合是一个平衡过程,形成2∶1结合物时,其结合常数k可用下式求得:

式中,D是加入γ-CD后药物的紫外光密度值;[CD]0是γ-CD的总浓度;[G]0是药物的总浓度;ε是γ-CD与药物形成包合物的摩尔吸收系数。以1/D对1/[CD]02作图得一直线,其所得截距/斜率即为γ-CD与药物的结合常数k[10]。
|
|
表 2 一系列不同浓度的γ-CD与药物包合物的光密度之差 Tab 2 Difference of absorption values in series of drugs/γ-CD solutions |
随着γ-CD浓度的增加,γ-CD与罗库溴铵的包合物光密度随之增大,根据公式( 1 ),以1/D对1/[CD]02回归,线性方程为:y=0.000 04 x+2.771 1(r2=0.986 1),k=6.93×104 L/mol。
随着γ-CD浓度的增加,γ-CD与维库溴铵的包合物光密度随之增大,根据公式( 1 ),以1/D对 1/[CD]02回归,线性方程为:y=0.000 05x+2.586 64 (r2=0.978 9),k=5.17×104L/mol。
2.3 核磁共振法测定结果
结合二维相关谱与一维氢谱,可以判断环糊精的H3和H5位于空腔内,H2、H4位于空腔外[13],并得到γ-CD H1(d峰)、H2(dd峰)、H3(t峰)、H4(t峰)、H5(m峰)的化学位移。根据1HNMR谱图(图 1)可以看出H2、H3、H4发生了明显的位移变化,并且图 2B中H3和H5重合在了一起,证明γ-CD与罗库溴铵发生了包合作用。从表 3可以看出γ-CD与罗库溴铵包合时的H3、H5的化学位移变化比γ-CD与维库溴铵的大,说明γ-CD与罗库溴铵的包合作用略大于γ-CD与维库溴铵;同样HS-7与罗库溴铵的包合作用略大于HS-7与维库溴铵;Sugammadex与罗库溴铵包合作用略大于Sugammadex与维库溴铵。HS-7和Sugammadex与肌松药的包合作用远大于γ-CD,HS-7包合罗库溴铵时的H3化学位移变化略大于Sugammadex包合罗库溴铵,但H5的化学位移变化略小,因此无法准确判断HS-7与罗库溴铵的包合作用是否略大于Sugammadex与罗库溴铵的包合作用;同样HS-7、Sugammadex分别与维库溴铵的包合作用大小也无法准确比较。
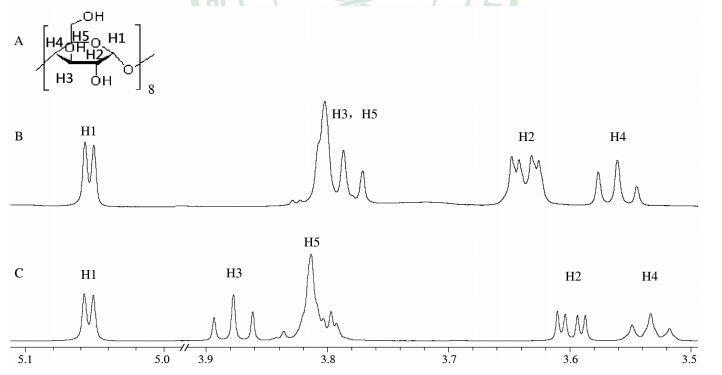 | 图 1 γ-CD、γ-CD与罗库溴铵包合物的一维氢谱图 Fig 1 1HNMR spectrum of γ-CD and the inclusion complex of γ-CD with rocuronium A:Hydrogen peak position of γ-CD corresponding to its structure;B,C:1HNMR spectrum of the inclusion complexes of γ-CD with rocuronium (B) and γ-CD (C). γ-CD:γ-Cyclodextrin |
|
|
表 3 3种环糊精包合罗库溴铵、维库溴铵前后的位移变化 Tab 3 Chemical shift changes of rocuronium and vecuronium before and after inclusion in three cyclodextrins |
本研究通过等温滴定量热法拟合所得结果分析发现,γ-CD及其衍生物HS-7、Sugammadex与肌松药罗库溴铵、维库溴铵结合的ΔH均为负值,ΔS均为正值,由于ΔG=ΔH-TΔS[10],因此ΔG均为负值,由此可判断环糊精与药物的反应是自发进行的[14];若|ΔH |>T|ΔS |,则该反应为焓驱动反应,即为化学反应,因此可推断出3种环糊精与药物均发生了化学反应,其物质基础发生了改变[10]。这种较强的结合在小分子相互作用中非常少见,能达到这种结合的通常是生物大分子的结合,如蛋白与其配体。
根据1HNMR及COSY结果分析,在环糊精与药物发生包合作用时,H2、H4向低场移动,可能是由于肌松药部分裸露在空腔外,从而外表面的空间结构发生变化并产生了局部屏蔽效应[15];环糊精的H3和H5向高场移动可能是由于肌松药结构中的苯环在CD空腔内表面产生了较强的π-π电子流,从而对H3和H5产生了较强的屏蔽作用[16]。当γ-CD与肌松药形成包合物后,根据ΔH3>ΔH5可推断药物分子是从环糊精的小口端进入;HS-7、Sugammadex与肌松药形成包合物后,根据ΔH3>ΔH5可推断药物分子是从环糊精的大口端进入[17]。
综上所述,3种环糊精均与两种肌松药发生了包合作用,HS-7、Sugammadex以1∶1包合、γ-CD以2∶1包合罗库溴铵和维库溴铵。比较等温滴定量热法和紫外光谱法的结果可知,γ-CD均以2∶1包合罗库溴铵,紫外光谱法测得γ-CD包合罗库溴铵的结合常数k与等温滴定量热法所测相近,两种方法所得结果基本一致。比较等温滴定量热法和核磁共振法数据可知,HS-7和Sugammadex的结合常数远大于γ-CD,等温滴定量热法所测结合常数是HS-7略大于Sugammadex,而核磁共振法所得结果表明HS-7与Sugammadex的包合能力无法准确判断。比较3种方法结果可知,3种环糊精包合罗库溴铵的能力都大于包合维库溴铵,而3种环糊精包合肌松药能力大小为HS-7≥Sugammadex>γ-CD。3种方法所得结果基本相同,互相佐证。但等温滴定量热法在拟合效果不佳的情况下,数据偏差较大并不可靠;紫外光谱法须在药物有较强的紫外吸收[3]而环糊精无紫外吸收的条件下才能测定结合常数,限制了HS-7及Sugammadex的研究;一维核磁共振法虽能判断包合物的形成,但无法测定结合常数。每种方法从不同侧面表征了包合物,结合多种方法能更全面地研究环糊精与药物的包合作用。
| [1] | 姚 虹,魏太保,徐维霞,张有明.β-环糊精与二苯硫脲、二苯脲包结作用的紫外光谱研究[J].光谱学与光谱分析,2006,26:1664-1667. |
| [2] | 余晓东,邱燕子,黄宗华,陈 玉,宋发军.羟丙基-β-环糊精与青霉素酶的相互作用[J].华中师范大学学报:自然科学版,2014,48:532-537. |
| [3] | 王亚娜,孙俊梅,余丽丽,陆亚鹏,任 勇.环糊精及衍生物/药物包合常数的测定方法及其应用[J]. 药学进展,2004,28:23-28. |
| [4] | Karima N, Kidokoro S. Precise and continuous observation of cellulase-catalyzed hydrolysis of cello-oligosaccharides using isothermal titration calorimetry[J]. Thermochim Acta, 2004, 412:91-96. |
| [5] | Todd M J, Gomez J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity[J]. Anal Biochem, 2001, 296:179-187. |
| [6] | 宋熙熙,邵 爽,雷群芳,方文军,林瑞森.等温滴定量热法测定脲酶催化尿素水解反应动力学[J].浙江大学学报:理学版,2009,36:175-179. |
| [7] | 李 香,林秀丽.环糊精包合物表征手段的研究进展[J].食品与药品,2007,9(7A):35-39. |
| [8] | 杨卫红,闻大翔,杭燕南.Sugammadex拮抗肌松药神经肌肉阻滞作用的临床研究进展[J].国际麻醉学与复苏杂志,2007,28:548-551. |
| [9] | 鄢 丹,陈龙虎,冯 雪,邱玲玲,闫 谈,张 萍,等.基于等温滴定量热技术的清开灵注射液临床联合用药相互作用表征研究[J]. 中草药,2012,43:2217-2221. |
| [10] | 王亚娜,任 勇,陆亚鹏,杨星昊,涂荣华,周 灿,等.苯丙醇/β-环糊精包合作用研究[J]. 中国药科大学学报,2005,36:13-17. |
| [11] | Illapakurthy A C, Wyandt C M, Stodghill S P. Isothermal titration calorimetry method for determination of cyclodextrin complexation thermodynamics between artemisinin and naproxen under varying environmental conditions [J]. Eur J Pharm Biopharm, 2005, 59:325-332. |
| [12] | di Cagno M, Stein P C, Skalko-Basnet N, Brandl M, Bauer-Brandl A. Solubilization of ibuprofen with β-cyclodextrin derivatives: energetic and structural studies[J]. J Pharm Biomed Anal, 2011, 55:446-451. |
| [13] | 施介华,徐 艳.光谱法研究辅酶Q10与环糊精衍生物的相互作用[J].浙江工业大学学报,2013,41:490-494. |
| [14] | 李月生,夏详翔,李新怀,吕小婉,李耀会,李小定.微量热技术在生命科学研究中的应用[J].化工时刊,2007,21:64-67. |
| [15] | 郑美青,赵淑锐,吴英婷,王耀楠,王玉记.β-环糊精和3-羧基四氢异喹啉包合物的核磁共振研究[J].波谱学杂志,2013,30:264-268. |
| [16] | Ribeiro L, Carvalho R A, Ferreira D C, Veiga F J. Multicomponent complex formation between vinpocetine, cyclodextrins, tartaric acid and water-souble polymers monitored by NMR and solubility studies[J]. Eur J Pharm Sci, 2005, 24:1-13. |
| [17] | de Araujo M V, Macedo O F, Nascimento Cda C, Conegero L S, Barreto L S, Almeida L E, et al. Characterization, phase solubility and molecular modeling of alpha-cyclodextrin/pyrimethamine inclusion complex[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2009, 72:165-170. |
 2015, Vol. 36
2015, Vol. 36


