2. 解放军309医院检验科, 北京 100091
2. Department of Laboratory Medicine, No. 309 Hospital of PLA, Beijing 100091, China
肺癌是呼吸系统最常见的恶性肿瘤,其发病率在发达国家和发展中国家均排在第1位,预计到2020年,肺癌仍是中国新增发病和死亡人数最多的癌症[1]。目前,肺癌的主要治疗手段包括手术治疗、放疗、化疗和靶向治疗等,尽管近年来上述治疗措施已取得很大进步,但其复发率和病死率仍很高,主要原因在于其发病、转移及复发等相关机制尚不明确。
DNA甲基化是表观遗传修饰的主要机制,其不改变DNA序列,但影响基因转录调控,是导致抑癌基因失活的重要原因[2]。CpG岛甲基化表型(CIMP)的概念于1999年首次被提出,研究发现某些结直肠癌CpG岛位点启动子被广泛甲基化,造成某些抑癌基因和其他一些肿瘤相关基因的失活[3]。这些CIMP被发现有不同临床表现和分子特征,可以用于研究和评估CIMP相关肿瘤[4]。肺癌起源于一系列遗传和表观遗传的变化,也是CIMP相关肿瘤之一[5]。目前肺癌CIMP的相关报道较少,究竟哪些甲基化基因可以作为肺癌CIMP分型的基因标记尚不清楚。
在前期研究中,我们利用DNA甲基化结合蛋白(MBP)沉淀+二代测序的方法,比较了3对CIMP阳性和非阳性肿瘤组织的差异[6]。本研究拟在此基础上,挑选4个仅在CIMP肿瘤甲基化的基因SHISA3、CTSL1、C1ORF103和TMEM200B进行研究,并和经典的CIMP筛选基因CACNA1G、IGF2、NEUROG1、RUNX3进行比较,旨在找到更准确的CIMP肺癌筛选的基因组合,探讨CIMP肺癌的临床病理特征,为肺癌的CIMP分型和个体化诊疗奠定基础。 1 材料和方法 1.1 研究对象
依据病理检验结果,选取50例第二军医大学长海医院2013—2014年收治的肺癌患者,收集临床病例资料。所有肺癌患者术前均未接受任何抗肿瘤治疗,未患有其他肿瘤疾病。男39例,女11例,年龄(54.8±8.6)岁。所有参与本研究的肺癌患者或其家属均签署授权进行基因检测的知情同意书。 1.2 肿瘤组织和血浆游离DNA提取
手术切除肿瘤标本后立即转移至-80℃低温冰箱中保存。经病理检查肿瘤细胞>70%的标本方进行基因组抽提。组织DNA提取采用Wizard Genomic DNA Purification Kit(Progmega,USA)。抽提DNA测D260/D280和琼脂糖凝胶进行质量鉴定。 1.3 CIMP分型
采用500 ng提取的基因组DNA用Zymo EZ DNA Methylation Gold Kit (Zymo Research,Orange,USA)进行亚硫酸氢盐处理,具体操作按照试剂盒的说明进行,处理后的DNA置于-20℃冻存,保存时间少于1个月。 CIMP分型选用文献[7]中的基因CACNA1G、IGF2、NEUROG1、RUNX3 (经典组合)和我们筛选的基因SHISA3、CTSL1、C1ORF103、TMEM200B(新基因组合)作为筛选标记。扩增甲基化和非甲基化的引物采用MethPrimer软件进行设计(http://www.urogene.org/methprimer/),引物由Invitrogen公司合成。
上述基因位点的甲基化状态运用甲基化特异性PCR(MSP)[8]进行分析,因DNA经C-T转换后Tm降低,因此退火温度选择53℃,其他反应条件同普通PCR。PCR反应体系内含2×PCR Buffer 10 μL,上、下游引物各0.5 μL(20 μmol/L),模板DNA 2 μL,以去离子水补足至20 μL。为防止假阳性或假阴性,每次PCR扩增时均采用阳性甲基化基因组DNA对照(Chemicon-CpGenome universal Methylated DNA,Millipore,USA)、阴性外周血淋巴细胞(PBMC)基因组DNA对照和阴性无RNA酶水对照。
取5 μL MSP产物,加入1 μL 10×Loading Buffer,于含0.5 mg/L溴化乙啶的2.5%琼脂糖凝胶上电泳,凝胶成像系统拍照观察。提纯并扩增凝胶上的条带,再取产物进行电泳。MSP产物电泳时只出现未甲基化条带时,该样本计为未甲基化;MSP产物电泳时出现甲基化条带,无论是否出现未甲基化条带,均计为甲基化。4个基因中3个或3个以上基因同时出现甲基化条带者,则该样本定义为CIMP阳性[9]。 1.4 统计学处理
采用SPSS 20.0 统计软件包分析,GraphPad Prism 5软件绘图。用χ2检验及Fisher确切概率法分析CIMP表型与肺癌患者临床病理因素的关系。检验水准(α)为0.05。 2 结 果 2.1 MSP检测DNA甲基化
图 1为CACNA1G和IGF2两个基因在5个样品中的MSP检测结果。 阴性无RNA酶水对照无条带扩增,证明引物和反应体系无污染。外周血淋巴细胞(PBMC)阴性对照(-control)仅能扩增非甲基化条带,阳性对照能扩增甲基化和非甲基化条带,说明该基因在外周血淋巴细胞中无甲基化,也证明了引物扩增的特异性。
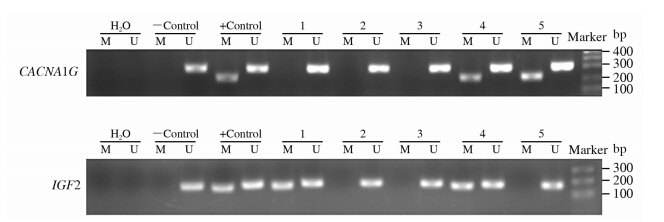 | 图 1 MSP检测甲基化示意图 H2O:阴性无RNA酶水对照;-Control: 阴性外周血淋巴细胞基因组DNA对照;+Control: 阳性甲基化基因组DNA对照;1~5: 样品1~5. M:甲基化引物扩增的条带;U:非甲基化引物扩增的条带 |
在经典的4个基因中,CACNA1G、IGF2、NEUROG1、RUNX3在癌组织和癌旁组织的甲基化率分别为46.0%(23/50) vs 22.0%(11/50)、28.0%(14/50) vs 8.0%(4/50)、58.0%(29/50)vs 18.0%(9/50)和50.0%(25/50) vs 18.0% (9/50),4个基因在癌组织中的甲基化率均高于癌旁组织。由表 1可见,RUNX3基因的甲基化与淋巴结转移(P=0.017)和功能状态(PS)评分(P=0.018)相关,IGF2基因的甲基化与淋巴结转移相关(P=0.026),CACNA1G基因的甲基化与年龄相关(P=0.011)。
|
|
表 1 经典CIMP分型基因启动子甲基化与临床病理特征的关系 |
利用CACNA1G、IGF2、NEUROG1、RUNX3 4个基因进行CIMP分型,在50例肿瘤组织中,15例(30%)有3个或4个基因甲基化,即CIMP(+);而癌旁组织中也有2例CIMP(+),且这2例患者对应的肿瘤组织也呈CIMP (+)。同CIMP(-)患者相比,CIMP(+)患者发病年龄偏大(P=0.031),其他病理特征差异无统计学意义(表 1)。 2.3 新的CIMP分型基因的甲基化阳性率及与临床病理特征的关系
4个新的甲基化基因SHISA3、CTSL1、C1ORF103、TMEM200B在50例肺癌的癌组织和癌旁组织的甲基化率分别为76.0%(38/50) vs 52.0%(26/50)、38.0%(19/50) vs 10.0%(5/50)、72.0%(36/50) vs 56.0%(28/50) 和48.0%(24/50) vs 20.0%(10/50),该4个基因在癌组织中的甲基化率均高于癌旁组织。其中CTSL1基因的甲基化与吸烟史有关(P=0.018,表 2)。
利用SHISA3、CTSL1、C1ORF103、TMEM200B 4个基因进行CIMP分型,在50例肿瘤组织中,23例(46%)属于 CIMP(+)肺癌;而癌旁组织中也有3例CIMP(+),这3例患者对应的肿瘤组织也呈CIMP(+)。同CIMP(-)患者相比,CIMP(+)患者发病年龄偏大(P=0.031),有吸烟史的患者CIMP(+)比例较大[36%(18/50)],但差异无统计学意义(P=0.053,表 2)。
|
|
表 2 新的CIMP分型基因启动子甲基化与临床病理特征的关系 |
目前肺癌发病率及死亡率都较高,主要原因为肺癌发生发展的分子机制尚不明确,同时肺癌起病隐匿,早期无特异性症状,大多数肺癌患者就诊时已进入晚期。因此,迫切需要进一步探讨其分子发生机制,寻找理想的早期诊断和分子分型标记物。从遗传的角度讲,肺癌也是环境因素和遗传因素相互作用的结果。环境因素包括吸烟、环境污染等;遗传因素则主要包括一系列遗传和表观遗传的变化,前者如染色体畸变、基因突变等,后者如DNA甲基化、miRNAs和组蛋白修饰等的改变。CIMP肿瘤是一类特殊的、主要由于DNA甲基化导致的肿瘤。CIMP是一种特殊的分子亚型,具有独特的临床病理特征:如好发于近端结肠、女性、黏液性癌、低分化、高微卫星不稳定性(MSI)、高BRAF突变和低TP53突变[10, 11]等。
Hughes等[12]建议检测MINT1、MINT2、MINT31、CDKN2A和MLH1启动子的甲基化来判断是否为CIMP肿瘤;Weisenberger等[13]在295个肿瘤中检测了92个基因的CpG岛DNA甲基化情况,最后选择了5个基因 (CACNA1G、IGF2、NEUROG1、RUNX3、SOCS1)的CpG岛作为CIMP筛选的标记。但这些CIMP筛选标记基因都是基于结直肠癌提出的,是否适合于肺癌尚不清楚。
本研究发现经典的CIMP分型标记基因CACNA1G、IGF2、NEUROG1和RUNX3在肺癌中的甲基化率高于癌旁组织,且与肺癌临床病理特征关系密切。其中CACNA1G与年龄有一定的关系,>60岁的患者该基因甲基化阳性率升高。IGF2和RUNX3在淋巴结转移上具有一定的意义,发生淋巴结转移的患者此两个基因甲基化率升高。提示可利用这两个基因甲基化检测来判断是否发生肺癌的淋巴结转移。Harden等[14]研究也有类似发现。另外,RUNX3甲基化与临床PS评分具有一定的关系,当PS评分>0时,此基因甲基化阳性率增高。
本研究还以4个新基因SHISA3、CTSL1、C1ORF103和TMEM200B作为CIMP分型标记进行研究,发现年龄越大CIMP阳性率越高。另外发现CTSL1基因与吸烟史有一定的关系,有吸烟史的患者此基因阳性率升高。这与Ostrow等[15]的研究相符,也符合CIMP在其他肿瘤如结直肠癌中的临床病理特征。
之前的研究已明确DNA的超甲基化与在启动子区域具有高水平胞嘧啶的基因沉默有关,这种基因通常沉默转录[16]。肺癌病理类型不同,其基因甲基化率可能也会存在差异。Yanagawa等[17]报道p16的甲基化与鳞癌密切相关,而APC和RUNX3基因的甲基化则与腺癌密切相关。van der Weyden等[18]和Talikka等[19]认为,CIMP肺癌与非小细胞肺癌密切相关。然而本研究的8个基因甲基化与病理类型无明显相关性。本研究还发现,性别对甲基化结果没有影响,这也不同于Vaissière等[20]的报道。虽然本研究也发现CIMP肿瘤与年龄、淋巴结转移等有关,但其他的临床病理特征未发现明显差异,这可能与样本数较小、甲基化检测手段不够灵敏有关,需要进一步深入研究。
| [1] | 代 敏,任建松,李 霓,李 倩,杨 琳,陈玉恒.中国2008年肿瘤发病和死亡情况估计及预测[J].中华流行病学杂志,2012,33:57-61. |
| [2] | Toyota M, Ahuja N, Ohe-Toyota M, Herman J G, Baylin S B, Issa J P. CpG island methylator phenotype in colorectal cancer[J]. Proc Natl Acad Sci USA,1999,96: 8681-8686. |
| [3] | Ng J M, Yu J.Promoter hypermethylation of tumour suppressor genes as potential biomarkers in colorectal cancer[J]. Int J Mol Sci,2015,16:2472-2496. |
| [4] | Falahi F, Sgro A, Blancafort P.Epigenome engineering in cancer: fairytale or a realistic path to the clinic?[J]. Front Oncol,2015,5:22. |
| [5] | Baylin S B, Jones P A.A decade of exploring the cancer epigenome-biological and translational implications[J]. Nat Rev Cancer,2011,11:726-734. |
| [6] | Xu Y, Hu B, Choi A J, Gopalan B, Lee B H, Kalady M F.Unique DNA methylome profiles in CpG island methylator phenotype colon cancers[J]. Genome Res,2012,22:283-291. |
| [7] | Pickard B S, Malloy M P, Clark L, Lehellard S, Ewald H L, Mors O, et al. Candidate psychiatric illness genes identified in patients with pericentric inversions of chromosome 18[J]. Psychiatr Genet,2005,15:37-44. |
| [8] | Nawaz I, Qiu X, Wu H, Li Y, Fan Y, Hu L F, et al.Development of a multiplex methylation specific PCR suitable for (early) detection of non-small cell lung cancer[J]. Epigenetics,2014,9:1138-1148. |
| [9] | Kim H,Kim Y H,Kim S E, Kim N G, Noh S H, Kim H.Concerted promoter hypermethylation of hMLH1,p16INK4A,and E-cadherin in gastric carcinomas with microsatellite instability[J].J Pathol,2003, 200:23-31. |
| [10] | Nazemalhosseini Mojarad E, Kuppen P J, Aghdaei H A, Zali M R.The CpG island methylator phenotype (CIMP) in colorectal cancer[J]. Gastroenterol Hepatol Bed Bench,2013,6:120-128. |
| [11] | Samowitz W S, Albertsen H, Herrick J, Levin T R, Sweeney C, Murtaugh M A, et al. Evaluation of a large,population-based sample supports a CpG island methylator phenotype in colon cancer[J]. Gastroenterology,2005,129:837-845. |
| [12] | Hughes L A, Khalid-de Bakker C A, Smits K M, van den Brandt P A, Jonkers D, Ahuja N, et al. The CpG island methylatorphenotype in colorectal cancer: progress and problems[J]. Biochim Biophys Acta,2012,1825:77-85. |
| [13] | Weisenberger D J, Siegmund K D, Campan M, Young J, Long T I. CpG island methylator phenotype underlies sporadic microsatellite instability and is tightly associated with BRAF mutation in colorectal cancer[J]. Nat Genet, 2006,38: 787-793. |
| [14] | Harden S V,Tokumaru Y,Westra W H, Goodman S, Ahrendt S A, Yang S C, et al.Gene promoter hypermethylation in tumors and lymph nodes of stage Ⅰ lung cancer patients[J].Clin Cancer Res,2003, 9:1370-1375. |
| [15] | Ostrow K,Michailidi C,Guerrero-Preston R, Hoque M O, Greengerg A, Rom W, et al.Cigarette smoke induces methylation of the tumor suppressor gene NISCH[J].Epigenetics,2013, 8:383-388. |
| [16] | Lao V V, Grady W M. Epigenetics and colorectal cancer[J]. Nat Rev Gastroenterol Hepatol,2011,8:686-700. |
| [17] | Yanagawa N,Tamura G, Oizumi H, Takahashi N, Shimazaki Y, Motoyama T.Promoter hypermethylation of tumor suppressor and tumor-related genes in non-small cell lung cancers[J].Cancer Sci,2003, 94:589-592. |
| [18] | van der Weyden L, Adams D J. The Ras-association domain family (RASSF) members and their role in human tumourigenesis[J]. Biochim Biophys Acta,2007,1776:58-85. |
| [19] | Talikka M, Sierro N, Ivanov N V, Chaudhary N, Peck M J, Hoeng J, et al. Genomic impact of cigarette smoke, with application to three smoking-related diseases[J]. Crit Rev Toxicol,2012,42:877-889. |
| [20] | Vaissière T, Hung R J, Zaridze D, Moukeria A, Cuenin C, Fasolo V, et al. Quantitative analysis of DNA methylation profiles in lung cancer identifies aberrant DNA methylation of specific genes and its association with gender and cancer risk factors[J]. Cancer Res,2009,69: 243-252. |
 2015, Vol. 36
2015, Vol. 36


