2. 第二军医大学东方肝胆外科医院肝外四科, 上海 200438
2. Department of Hepatobiliary Surgery Ⅳ, Eastern Hepatobiliary Surgery Hospital,Second Military Medical University,Shanghai 200438, China
肝细胞癌(hepatocellular carcinoma,HCC)是目前世界上第6大最常见的恶性肿瘤,是肿瘤相关性的第3大死因[1],同时也是导致肝硬化患者死亡的主要原因之一[2]。手术切除是目前公认的HCC最有效的治疗方法。肝切除术主要有两种方法,即解剖性肝切除术(anatomic resection,AR)和非解剖性肝切除术(non-anatomic resection,NAR)[3, 4]。前者主要是指按照肝脏分段进行肝切除,包含了单肝段切除及多肝段切除;而后者是指主要考虑完整切除肿瘤,而不考虑肝内解剖,但是要求肝断面至肿瘤边缘的距离至少为1.0 cm。
虽然治疗HCC(尤其是早期HCC)的首选方案是手术切除,但是手术方式的选择仍然没有统一的标准。本研究纳入721例肝癌手术患者,通过倾向性得分匹配(propensity score matching,PSM)的方法来消除影响术者手术方式选择的偏倚因素[5, 6],从而更加客观地评估两种手术方式的预后。 1 资料和方法 1.1 病例入组
收集2008年7月至2009年7月1090例于东方肝胆外科医院行肝切除术的原发性肝癌患者资料。符合下列标准的患者纳入本研究:(1)病理证实为HCC;(2)未合并其他恶性肿瘤;(3)无肝外远处转移和淋巴结转移;(4)无门静脉、肝静脉等大血管侵犯及胆管癌栓形成;(5)术前未进行过抗肿瘤治疗;(6)R0切除。排除混合性肝癌(HCC-ICC)45例;肝外远处转移25例;术前接受抗肿瘤治疗68例;术前影像学资料或术中证实有胆管癌栓12例、门静脉癌栓64例、肝静脉癌栓13例;术中或术后病理证实有淋巴结转移34例;R1和R2切除72例;病例资料不全20例,3个月内失访16例。最终共有721例肝癌患者纳入研究,研究对象均为巴塞罗那分期(BCLC)0期、A期或B期患者。 1.2 相关检查
术前均使用增强MRI或增强CT评估肿瘤大小、个数及与血管之间的关系;肝功能评估均在非急性炎症期下完成;组织学评估由术后病理或肝组织活检完成;术中情况变化或新发现由术者及麻醉师记录。术后2年内每2个月随访1次,以后每3个月随访1次,常规复查肝功能全套、甲胎蛋白(AFP)及肝脏彩超。根据AFP改变水平和肝脏彩超情况,对怀疑复发的患者行增强CT、增强MRI或PET-CT证实,在实验室检查与影像学检查相结合的情况下,发现肝内外出现结节或者AFP以倍增速度上升,排除其他相关疾病影响,均认为肝癌复发。对于复发的患者,根据其身体状况、复发类型、复发部位等因素综合考虑后,采取肝移植、射频消融、经导管肝动脉化疗栓塞(TACE)、索拉菲尼和放疗等治疗措施。 1.3 手术方式
(1)AR:取右侧肋缘下切口,充分暴露肝脏。初步探查结合术中B超确定有无播散灶,并确定拟切除的肝叶或肝段。解剖第一肝门,按照解剖平面采用钳夹法切肝。胆管常规在切肝时与Glissonian鞘一起结扎、切断,不预先在肝门处游离。对半肝切除和(或)合并胆囊切除病例,通过胆囊管或左肝管断端插管注入美蓝溶液来检测肝断面是否有胆漏。肝断面不予缝合,并注意胆漏及出血点处理。于创面处放置腹腔引流。(2)NAR:探查和暴露步骤同AR,根据肿瘤位置选择血流阻断方法,采用第一肝门阻断法,部分合用第二肝门阻断法(如肿瘤邻近下腔静脉时)。距离肿瘤边界1~2 cm,用电刀预先设定切除线。沿切除线用指捏、钳夹法切除肿瘤。肝断面用肝针对拢缝合,引流放置及其他处理同AR。 1.4 预后观察指标
随访截止日期为2014年8月31日。以总体生存时间(overall survival,OS)和无瘤生存时间(disease free survival,DFS)作为预后的观察指标。OS是指从患者手术日期开始到患者死亡日期(或随访日期),DFS是指手术日期开始到医院随访中重新出现病灶为止。手术期间的并发症使用Clavein分级[7]进行统计。 1.5 统计学处理
全部统计分析采用SPSS 19.0 及 R 2.10.1软件实现。连续性变量的描述用中位数(范围)表示,分类变量用百分数表示;分类变量的差异比较用χ2检验或Fisher精确概率检验,连续变量差异比较用Mann-Whitney U检验,OS和DFS使用Kaplan-Meier曲线描述和 log-rank检验(对数秩检验)比较,影响预后的单因素和多因素分析使用Cox比例风险回归模型完成。检验水准(α)为0.05(双侧)。为了消除AR组及NAR组影响手术方式选择的变量间的选择偏倚,采用PSM方法,通过对两组间存在差异的变量进行logistic 多因素分析,最终用年龄、影像学肿瘤大小、影像学肿瘤数目和影像学肝硬化4个因素进行配对(1∶1最邻近法配对),卡尺(standard deviation,SD)为0.05。 2 结 果 2.1 病例临床特征 721例原发性HCC患者中,317例行AR,404例行NAR。全组中位年龄52岁,男性比例为83.6%(603/721),HBsAg阳性患者占85.6%(617/721),61.4%(443/721)的患者术后病理证实伴肝硬化,80.9%(583/721)的患者为单发肿瘤,有微血管侵犯的比例为34.0%(245/721),14.8%(107/721)的患者术中接受输血。5例围手术期死亡,其中AR组3例,NAR组2例。
与NAR组比较,AR组的患者年龄较小(P=0.010),白蛋白水平较高(P=0.004),谷氨酸转氨酶水平较低(P=0.024),肿瘤数目较少 (P<0.001),肿瘤直径较小(P<0.001),合并肝硬化的患者更少(P=0.001),BCLC分期较好(P=0.002);其他指标差异无统计学意义(表 1)。
|
|
表 1 解剖性肝切除术和非解剖性肝切除术患者一般临床资料比较 Tab 1 Comparison of clinicopathological data between AR and NAR groups |
中位随访时间31.2(3.9~70.0)个月。共486例患者复发,AR组局部复发率为48.3%(153/317),远处复发率为10.4%(33/317);NAR组局部复发率为64.4%(260/404),远处复发率为9.9%(40/404)。两组局部复发率差异有统计学意义(P<0.001)。
全部患者1、3、5年总体生存率为85.9%、64.7%和51.5%,中位生存时间为29.6 (1.1~70.0)个月;1、3、5年无瘤生存率为59.3%、34.0%和25.5%,中位无瘤生存时间为17.9 (1.1~70.0)个月。AR组的1、3、5年总体生存率为93.1%、74.5%和62.5%,中位生存时间为35.9 (1.5~70.0)个月;NAR组的1、3、5年总体生存率为80.2%、56.8%和42.9%,中位生存时间为 23.1(1.3~63.2)个月。 AR组1、3、5年无瘤生存率为69.3%、41.3%和34.9%,中位无瘤生存时间为21.4(1.0~70.0)个月;NAR组1、3、5年无瘤生存率为51.4%、38.3%和18.7%,中位无瘤生存时间为12.4(1.0~63.2)个月。AR组的总体生存率和无瘤生存率均高于NAR组 (P<0.001,P<0.001;图 1)。
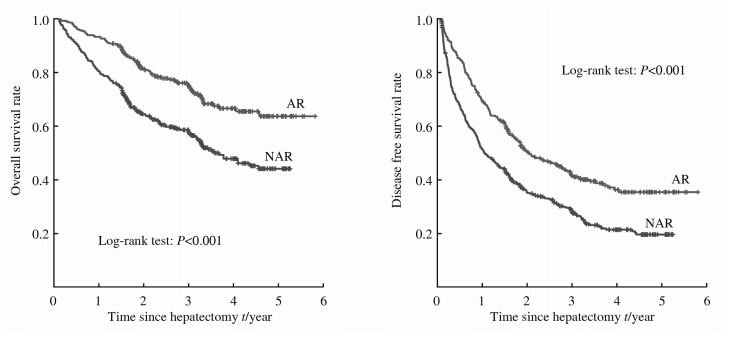 | 图 1 解剖性肝切除(n=317)和非解剖性肝切除(n=404)的总体生存和无瘤生存 Fig 1 Overall survival and disease free survival rates of AR (n=317) and NAR (n=404) groups AR: Anatomic liver resection; NAR: Non-anatomic liver resection |
鉴于AR组和NAR组在肝硬化、肿瘤大小等临床特征方面差异明显,且上述指标对肝癌预后有较大影响[8],我们用PSM的方法来消除组间变量的偏倚。 通过对组间差异变量的logistic回归多因素分析,最终用年龄、影像学肿瘤大小、数目和影像学肝硬化进行PSM,最后得到临床指标无明显差异的两组队列(AR组278例、NAR组278例)。PSM后共368例患者复发,AR组局部复发率为52.2%(145/278),远处复发率为9.7%(27/278);NAR组局部复发率为62.9%(175/278),远处复发率为7.6%(21/278)。两组局部复发率差异有统计学意义(P=0.036)。
PSM后AR组的1、3、5年总体生存率为93.9%、73.3%和59.4%,中位生存时间为34.9 (1.5~70.0)个月;NAR组的1、3、5年总体生存率为86.0%、62.8%和52.8%,中位生存时间为 28.6(1.3~62.8)个月。PSM后AR组1、3、5年无瘤生存率为67.9%、37.5%和31.3%,中位无瘤生存时间为19.8(1.0~70.0)个月;NAR组的1、3、5年无瘤生存率为56.8%、33.1%和22.6%,中位无瘤生存时间为17.4(1.0~62.8)个月。经统计学分析发现,PSM后AR组的总体生存率和无瘤生存率均高于NAR组(P=0.010,P=0.024;图 2)。
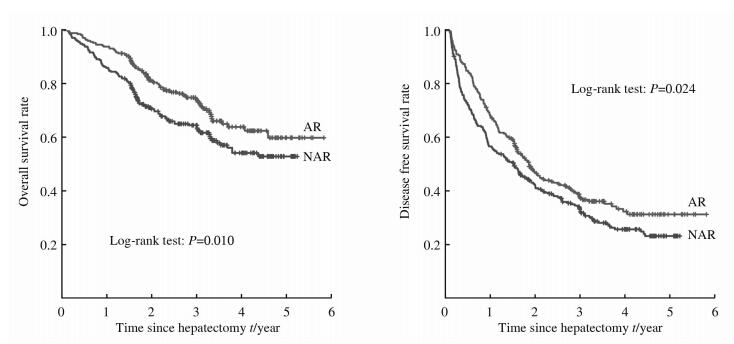 | 图 2 PSM后解剖性肝切除(n=278)和非解剖性肝切除(n=278)的总体生存和无瘤生存 Fig 2 Overall survival and disease free survival rates of AR (n=278) and NAR (n=278) after PSM AR: Anatomic liver resection; NAR: Non-anatomic liver resection; PSM: Propensity score matching |
对PSM后总体生存和无瘤生存的影响因素进行Cox回归单因素和多因素分析,最终发现肿瘤大小(HR: 2.186,95%CI:1.607~2.974)、肿瘤数目(HR: 1.811,95%CI: 1.232~2.661)、包膜 (HR:1.400,95%CI: 1.046~1.873)、肝硬化(HR:1.463,95%CI: 1.075~1.990)、微血管侵犯(HR:1.739,95%CI: 1.298~2.330)、AR(HR:0.634,95%CI: 0.473~0.850) 是影响总体生存的独立危险因素,输血(HR:1.417,95%CI: 1.070~1.878)、肿瘤大小(HR:1.760,95%CI: 1.419~2.183)、肿瘤数目(HR:1.731,95%CI: 1.282~2.336)、包膜(HR:1.310,95%CI: 1.064~1.614)、肝硬化(HR:1.447,95%CI: 1.161~1.804)、微血管侵犯(HR:1.282,95%CI: 1.029~1.596)、AR(HR:0.767,95%CI: 0.620~0.947)是影响肿瘤无瘤生存的独立危险因素。 2.5 肝硬化与否对手术方式选择的影响
PSM后的肝硬化HCC患者中:NAR组的1、3、5年生存率为85.8%、62.2% 和55.6%,中位生存时间为 29.6(1.6~62.2)个月;AR组的1、3、5年生存率为 93.5%、64.1% 和 51.7%,中位生存时间为28.6(1.5~61.1)个月。NAR组的1、3、5年无瘤生存率为58.0%、33.1% 和22.7%,中位无瘤生存时间为16.8(1.1~62.0)个月;AR组的1、3、5年无瘤生存率为62.6%、25.6%和21.8%,中位无瘤生存时间为18.2(1.0~59.7)个月。AR组和NAR总体生存率和无瘤生存率差异均无统计学意义 (P=0.767,P=0.638;图 3)。
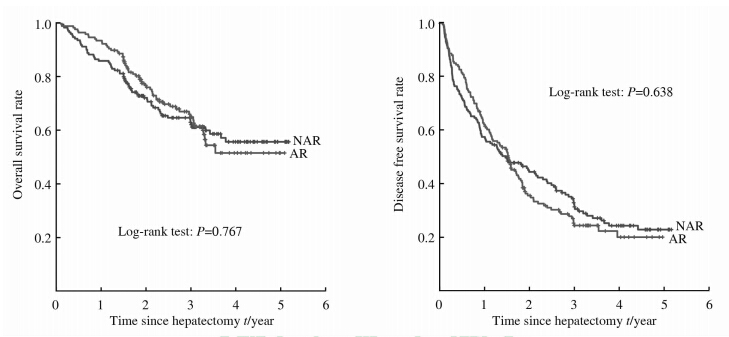 | 图 3 PSM后肝硬化肝癌患者中解剖性肝切除(n=167)与非解剖性肝切除(n=170)的总体生存和无瘤生存 Fig 3 Overall survival and disease free survival rates of AR (n=167) and NAR (n=170) in HCC patients with cirrhosis after PSM AR: Anatomic liver resection; NAR: Non-anatomic liver resection; HCC: Hepatocellular carcinoma; PSM: Propensity score matching |
非肝硬化肝癌患者中:NAR组的1、3、5年总体生存率为86.2%、63.9%和47.9%,中位生存时间为 27.8(1.3~62.8)个月;AR组的1、3、5年总体生存率为 94.5%、86.5%和72.2%,中位生存时间为39.3(1.8~70.0)个月。NAR的1、3、5年无瘤生存率为54.8%、33.1%和22.6%,中位无瘤生存时间为18.4(1.0~62.8)个月;AR组的1、3、5年无瘤生存率为76.1%、55.5%和46.4%,中位无瘤生存时间为27.6(1.4~70.0)个月。AR组总体生存率和无瘤生存率均高于NAR组(P<0.01,P<0.01;图 4)。
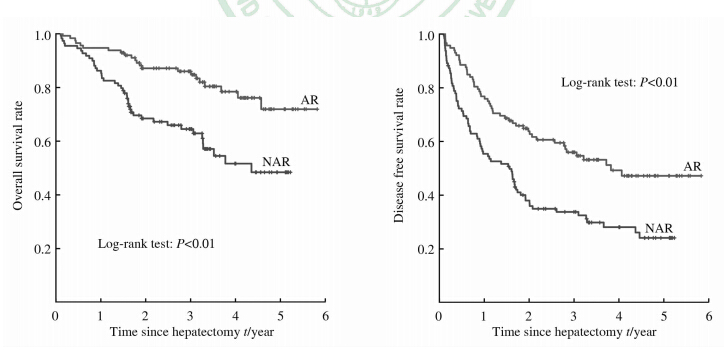 | 图 4 PSM后非肝硬化肝癌患者中解剖性肝切除(n=111)与非解剖性肝切除(n=108)的总体生存和无瘤生存 Fig 4 Overall survival and disease free survival rates of AR (n=111) and NAR (n=108) in HCC patients without cirrhosis after PSM AR: Anatomic liver resection; NAR: Non-anatomic liver resection; HCC: Hepatocellular carcinoma; PSM: Propensity score matching |
肝切除术是目前公认的HCC的主要治疗方法。手术切除是BCLC分期0期及A期患者的首选治疗方案[9],其5年生存率约为50%~70%[10, 11]。随着对肝脏解剖更深刻的认识及外科手术技术的进一步发展,越来越多的外科医生选择AR,但目前AR在预后方面是否优于NAR仍存在争议。相关学者发现AR术后生存及复发均优于NAR[12, 13],然而另一些学者则认为AR切除肝脏范围较大,容易使得伴有慢性肝炎或肝硬化的患者发生围手术期肝衰竭,从而增高手术死亡率[14],因此需要慎重选择手术方式。但是目前相关研究大多为回顾性分析,且患者的手术标准不一,术前肝功能、肿瘤大小、有无肝硬化等因素不同,患者的临床病理特征可能存在选择偏倚,这可能是导致研究结论不尽相同的原因之一[15]。本研究采用PSM方法减少接受AR和NAR治疗的HCC患者的临床病理特征的偏倚,比较两种术式的预后,以期得到更为准确的结论。
单纯从解剖学和肿瘤学的角度来看,AR较NAR有许多优势,首先,AR能同时把肿瘤及肝内播散的微转移一并切除[16],尤其是术前未能通过影像学发现的微血管侵犯;其次,能够减少术中意外出血和意外损伤所导致的正常肝脏细胞缺血坏死[17, 18];最后还能降低术中对肿瘤挤压造成的癌组织或细胞脱落导致肝内播散与远处转移。既往一些研究证实与NAR相比,实施AR的HCC患者术后复发率更低,生存率更高,预后更好[19, 20]。本研究通过对721例肝切除术患者进行研究,发现AR的预后优于NAR。
在临床工作中,AR切除受到多种因素的限制,外科医生倾向于对肝功能好(Child A级)、肿瘤较小、无肝硬化的患者选择AR。而这些因素在本研究中也得到证实,我们发现AR组与NAR组间在年龄、血清白蛋白、谷氨酸转氨酶、影像学肿瘤大小、影像学肿瘤数目、影像学肝硬化等6个方面差异存在统计学意义。因此,我们采用PSM方法来减少组间变量的差异、降低回顾性观察研究中的选择偏倚后,再次比较了AR与NAR的总体生存率和无瘤生存率。结果发现AR的预后仍优于NAR,其中AR的局部复发率较低,而两组远处复发并无明显差异,推测AR主要是通过扩大切除范围、减少肿瘤细胞在门脉系统中的扩散,降低了局部瘤的可能性,从而延长了患者的无复发生存时间。
虽然手术是治疗HCC的主要方案,但是5年生存率依然较差,主要原因是复发与转移率较高[21]。我们对PSM后HCC的生存和复发进行多因素分析后发现,除了肿瘤大小、肿瘤数目、肝硬化、微血管侵犯、包膜完整性以外,手术方式的选择(AR)也是影响HCC患者远期预后的一个重要因素。鉴于AR是影响HCC患者远期预后的一个重要因素,临床上应当扩大手术切除范围,尽量减少肿瘤残留的可能性。而肝硬化是影响HCC手术预后的重要因素[22, 23],合并肝硬化的HCC患者多数肝功能已经受到一定损害,一般不能耐受切除过多的肝组织。因此,为了防止术后肝衰竭的发生,外科医生常常倾向于选择NAR[24],在本研究中也证实了NAR组的患者经术后病理证实的肝硬化比例更高(65.1% vs 56.8%,P=0.023)。我们在PSM后对肝硬化组和非肝硬化组分别比较了AR和NAR的手术预后。结果表明,非肝硬化组中AR可以明显改善远期生存和无瘤生存(P<0.001),而肝硬化组中AR并未改善远期生存和无瘤生存(P=0.767,P=0.638)。因此我们认为肝硬化肝癌患者更适合施行NAR,以降低肝衰竭发生的可能,使患者预后及生活质量更佳。
综上,本研究采用PSM方法减少接受AR和NAR治疗的HCC患者的临床病例特征的偏倚,比较两种术式的预后,结果表明AR可以获得更好的远期生存。对于伴肝硬化的HCC患者来说,AR并未明显改善其远期生存,为避免术后肝衰竭的可能性,建议对此类患者施行NAR。
| [1] | Ferlay J, Shin H R, Bray F, Forman D, Mathers C, Parkin D M. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008 [J]. Int J Cancer, 2010, 127: 2893-2917. |
| [2] | Alazawi W, Cunningham M, Dearden J, Foster G R. Systematic review: outcome of compensated cirrhosis due to chronic hepatitis C infection [J]. Aliment Pharmacol Ther, 2010, 32: 344-355. |
| [3] | Arii S, Tanaka S, Mitsunori Y, Nakamura N, Kudo A, Noguchi N, et al. Surgical strategies for hepatocellular carcinoma with special reference to anatomical hepatic resection and intraoperative contrast-enhanced ultrasonography [J]. Oncology, 2010, 78 (Suppl 1): 125-130. |
| [4] | Tomimaru Y, Eguchi H, Marubashi S, Wada H, Kobayashi S, Tanemura M, et al. Equivalent outcomes after anatomical and non-anatomical resection of small hepatocellular carcinoma in patients with preserved liver function [J]. Dig Dis Sci, 2012, 57: 1942-1948. |
| [5] | Hsu C Y, Huang Y H, Chiou Y Y, Su C W, Lin H C, Lee R C, et al. Comparison of radiofrequency ablation and transarterial chemoembolization for hepatocellular carcinoma within the Milan criteria: a propensity score analysis [J]. Liver Transpl, 2011, 17: 556-566. |
| [6] | Ruzzenente A, Guglielmi A, Sandri M, Campagnaro T, Val-degamberi A, Conci S, et al. Surgical resection versus local ablation for HCC on cirrhosis: results from a propensity case-matched study [J]. J Gastrointest Surg, 2012, 16: 301-311. |
| [7] | Dindo D, Demartines N, Clavien P A. Classification of surgical complications:a new proposal with evaluation in a cohort of 6336 patients and results of a survey [J]. Ann Surg, 2004, 240: 205-213. |
| [8] | 刘鹏飞,刘荣华,徐 荷,吴孟超.原发性肝癌术后预防性TACE的意义(附433例病例随访) [J]. 中华肝胆外科杂志, 2005, 11: 81-82. |
| [9] | Forner A, Llovet J M, Bruix J. Hepatocellular carcinoma [J]. Lancet, 2012, 379:1245-1255. |
| [10] | Llovet J M, Schwartz M, Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma [J]. Semin Liver Dis, 2005, 25: 181-200. |
| [11] | Ishizawa T, Hasegawa K, Aoki T, Takahashi M, Inoue Y, Sano K, et al. Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma [J]. Gastroenterology, 2008, 134: 1908-1916. |
| [12] | Zhou Y, Xu D, Wu L, Li B. Meta-analysis of anatomic resection versus nonanatomic resection for hepatocellular carcinoma[J]. Langenbecks Arch Surg, 2011, 396:1109-1117. |
| [13] | Chen J, Huang K, Wu J, Zhu H, Shi Y, Wang Y, et al. Survival after anatomic resection versus nonanatomic resection for hepatocellular carcinoma: a meta-analysis[J]. Dig Dis Sci, 2011, 56:1626-1633. |
| [14] | Yamanaka N, Okamoto E, Oriyama T, Fujimoto J, Furukawa K, Kawamura E, et al. A prediction scoring system to select the surgical treatment of liver cancer. Further refinement based on 10 years of use[J]. Ann Surg, 1994, 219:342-346. |
| [15] | Cucchetti A, Cescon M, Ercolani G, Bigonzi E, Torzilli G, Pinna A D. A comprehensive meta-regression analysis on outcome of anatomic resection versus nonanatomic resection for hepatocellular carcinoma [J]. Ann Surg Oncol, 2012, 19:3697-3705. |
| [16] | Ochiai T, Sonoyama T, Kikuchi S, Okayama T, Konishi H, Kitagawa M, et al.Anatomic wide hepatectomy for treatment of hepatocellular carcinoma [J]. J Cancer Res Clin Oncol, 2007, 133:563-569. |
| [17] | Aragon R J, Solomon N L. Techniques of hepatic resection [J]. J Gastrointest Oncol, 2012, 3:28-40. |
| [18] | Tanaka S, Noguchi N, Ochiai T, Kudo A, Nakamura N, Ito K, et al. Outcomes and recurrence of initially resectable hepatocellular carcinoma meeting milan criteria: Rationale for partial hepatectomy as first strategy[J]. J Am Coll Surg, 2007, 204:1-6. |
| [19] | Cho Y B, Lee K U, Lee H W, Cho E H, Yang S H, Cho J Y, et al.Anatomic versus non-anatomic resection for small single hepatocellular carcinomas [J]. Hepatogastroenterology, 2007, 54:1766-1769. |
| [20] | Jing-Dong L, Yun-Hong T, Kanduri H K, Quan-Lin L, De-Xing L, Qiang L. Prognosis in patients with small hepatocellular carcinoma: a meta-analysis [J]. Hepatogastroenterology, 2011, 58(110-111):1708-1712. |
| [21] | Wakai T, Shirai Y, Yokoyama N, Nagakura S, Hatakeyama K. Hepatitis viral status affects the pattern of intrahepatic recurrence after resection for hepatocellular carcinoma [J]. Eur J Surg Oncol, 2003, 29:266-271. |
| [22] | Portolani N, Coniglio A, Ghidoni S, Giovanelli M, Benetti A, Tiberio G A, et al. Early and late recurrence after liver resection for hepatocellular carcinoma: prognostic and therapeutic implications[J]. Ann Surg, 2006, 243:229-235. |
| [23] | Llovet J M, Burroughs A, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2003, 362:1907-1917. |
| [24] | Cucchetti A, Cescon M, Trevisani F, Pinna A D. Current concepts in hepatic resection for hepatocellular carcinoma in cirrhotic patients [J]. World J Gastroenterol, 2012, 18:6398-6408. |
 2015, Vol. 36
2015, Vol. 36


