2. 同济大学附属上海第十人民医院药学部, 上海 200072
2. Department of Clinical Pharmacy, the 10th People's Hospital of Shanghai, Tongji University, Shanghai 200072, China
脑缺血性损伤发病率高,可致死致残或造成脑损伤和功能障碍;其主要表现形式是神经元活性降低、凋亡和死亡[1]。因此,研究脑缺血性损伤机制及保护药物,对预防缺血性脑血管疾病的发生、发展具有重要意义。PNU-282987是α7烟碱型乙酰胆碱受体(α7nAchR)的激动剂,胆碱能抗炎通路通过迷走神经作用于α7nAchR从而抑制炎症细胞因子的产生和释放,抑制炎症反应。应用PNU-282987可减少神经细胞死亡,降低脑水肿,改善蛛网膜下隙出血(subarachnoid hemorrhage,SAH)的神经功能状态[2]。本实验利用原代培养的氧糖剥夺 (oxygen-glucose deprivation,OGD) 大脑皮质神经元模型,研究α7nAChR激动剂PNU-282987对氧糖剥夺损伤后大脑皮质神经元的影响及可能机制,以期为脑缺血性损伤的治疗提供新的潜在靶点。 1 材料和方法 1.1 实验动物、药物和试剂
孕15~18 d的SD大鼠由上海西普尔-必凯实验动物有限公司[动物生产许可证号:SCXK (沪) 2013-0016]提供。Neurobasal medium、B27、胎牛血清、胰蛋白酶 (Gibco公司),PNU-282987、多聚赖氨酸、阿糖胞苷 (Sigma公司),乳酸脱氢酶 (lactate dehydrogenate,LDH)试剂盒(Promega公司),AnnexinⅤ-FITC试剂盒(BD公司),血红素氧化酶(HO-1,ENZO公司),缺氧诱导因子1α(HIF-1α,Abcam公司),GAPDH、活性氧(ROS)检测试剂盒(碧云天生物技术研究所),CCK-8试剂盒 (日本同仁化学研究所)。 1.2 原代大脑皮质神经元的培养
无菌环境下,取孕15~18 d大鼠,分离大脑皮质,将其剪成1 mm3的组织块,用0.125%胰蛋白酶在37℃条件下消化8 min,每间隔2 min轻摇1次。FBS终止消化后,轻轻吹打数次,352×g离心5 min,弃上清。用DMEM吹打混匀,取细胞悬液,用细胞计数板计数。调整细胞密度为每毫升1×106个,接种于预先用0.1 mg/mL多聚赖氨酸溶液包被的96孔培养板或6孔培养板中(96孔板每孔100 μL,6孔板每孔 2 mL),置于37℃、5% CO2培养箱孵育。于培养36 h 在培养液中加入阿糖胞苷以抑制神经胶质细胞的增殖。培养7 d后,以微管相关蛋白2 (microtubule-associated protein-2,MAP-2) 单克隆一抗和含绿色荧光的二抗标记神经元,Hoechst 33258标记细胞核进行免疫荧光细胞化学分析。 1.3 大脑皮质神经元氧糖剥夺损伤模型
取原代培养的大脑皮质神经元,随机分为正常对照组 (control)、氧糖剥夺组、PNU-282987组。在氧糖剥夺前24 h,在培养液中加入PNU-282987,使其终浓度为10 μmol/L,更换无糖DMEM培养液,然后将除对照组外的各组细胞同时移至恒温 (37℃) 密闭容器内,连续充以无氧气体 (90% N2,10% CO2),在氧糖剥夺条件下培养12 h后,进行各项实验。 1.4 大脑皮质神经元存活率检测
将原代培养的大鼠大脑皮质神经元接种入96孔板中,每孔接种100 μL,使每孔细胞数为每毫升106个。7 d后,将细胞分为正常对照组 (control)、氧糖剥夺组、PNU-282987组。PNU-282987组加入PNU-282987干预24 h后,以氧糖剥夺损伤神经元,并于损伤后12 h加入CCK-8检测各组细胞活性。每孔加入10 μL CCK-8,置37℃孵箱孵育1 h,酶联免疫检测仪选取490 nm波长,测定光密度值。记录对照组及各实验组的光密度值,计算各组大脑皮质神经元存活率。 1.5 大脑皮质神经元LDH含量检测
将原代培养的大鼠大脑皮质神经元接种入96孔板中,每孔接种100 μL,细胞密度为每毫升106个。分组同前,在氧糖剥夺12 h后,取细胞培养上清测定LDH含量。 1.6 大脑皮质神经元凋亡检测
将原代培养的大鼠大脑皮质神经元以每毫升105个的细胞密度接种于6孔板中,培养7 d后,分组及给药同前,在氧糖剥夺12 h后,收集细胞悬液,用AnnexinⅤ-FITC和PI室温避光染色,15 min后终止反应,流式细胞仪分析细胞凋亡情况。 1.7 大脑皮质神经元ROS产量检测
将原代培养的大鼠大脑皮质神经元接种入6孔板中,每孔接种2 mL,细胞密度为每毫升106个。分组同前,在氧糖剥夺12 h后,收集细胞悬液,加入2’,7’-二氯荧光黄双乙酸盐(dichloro-dihydro-fluorescein diacetate,DCFH-DA)于37℃避光染色20 min,终止反应,流式细胞术测定细胞内ROS产量。 1.8 大脑皮质神经元HIF-1α和HO-1蛋白表达检测
取各组大脑皮质神经元,提取细胞蛋白,取蛋白样品用10% SDS-PAGE分离后,用湿转法转移至硝酸纤维素膜上,用5% BSA于37℃封闭1 h,用抗HIF-1α、HO-1和GAPDH等抗体4℃孵育过夜,加入二抗室温孵育30 min,用Odyssey仪器扫描、分析各蛋白质条带,蛋白激活水平以免疫印迹中条带的灰度值与内参的比值来表示。 1.9 统计学处理
采用GraphPad Prism 5软件作为作图和数据分析工具,组间比较采用单因素方差分析(one-way ANOVA),数据以 x±s 表示,检验水准(α)为0.05。 2 结 果 2.1 大鼠原代大脑皮质神经元鉴定
取培养至7 d的神经元,以神经元树突标记物MAP-2抗体对培养的细胞进行免疫荧光染色,并使用Hoechst 33258标记细胞核,以MAP-2阳性细胞占Hoechst 33258染色细胞的比例进行大脑皮质神经元的纯度鉴定。如图 1所示,Hoechst染色细胞为蓝色荧光,MAP-2染色细胞为绿色荧光,merge图的细胞纯度鉴定结果显示大脑皮质神经元纯度在95%以上。
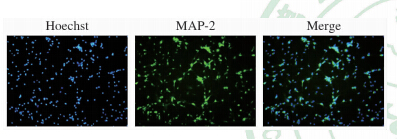 | 图 1 大鼠大脑皮质神经元鉴定 Fig 1 Identification of cultured rat cerebral cortical neurons MAP-2: Microtubule-associated protein-2. Original magnification: ×100 |
与对照组相比,氧糖剥夺12 h后细胞存活率下降[(42.8±1.6)% vs (100.0±2.9)%,P<0.01],提示氧糖剥夺能够导致明显的大脑皮质神经元损伤;给予PNU-282987处理后,细胞存活率上升[(50.6±1.2)% vs (42.8±1.6)%,P<0.01],表明PNU-282987对氧糖剥夺损伤的大脑皮质神经元具有保护作用。 2.3 PNU-282987降低氧糖剥夺损伤诱导的大脑皮质神经元培养上清LDH含量
氧糖剥夺12 h后,检测各孔培养上清中LDH,结果发现氧糖剥夺可导致大脑皮质神经元LDH释放增加 (1.92±0.18 vs 1.00±0.09,P<0.01),而PNU-282987可抑制氧糖剥夺损伤神经元LDH的释放 (0.80±0.10 vs 1.92±0.18,P<0.05)。 2.4 PNU-282987降低氧糖剥夺损伤诱导的大脑皮质神经元凋亡率
AnnexinⅤ-FITC流式细胞仪分析结果(图 2)显示,与正常对照组相比,氧糖剥夺损伤12 h后凋亡细胞数明显增加[(27.70±8.50)% vs (6.30±0.83)%,P<0.01],PNU-282987给药后可明显减少氧糖剥夺引起的细胞凋亡[(12.30±1.98)% vs (27.70±8.50)%,P<0.05]。结果表明经过PNU-282987处理后,大脑皮质神经元对氧糖剥夺的耐受性明显增强。
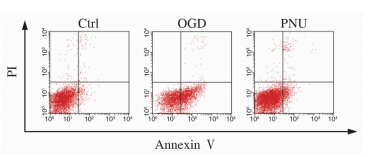 | 图 2 PNU-282987降低氧糖剥夺损伤诱导的大脑皮质神经元凋亡率 Fig 2 PNU-282987 decreased the apoptosis rate in cerebral cortical neurons exposed to OGD Ctrl: Control; OGD: Oxygen-glucose deprivation: PNU: PNU-282987; PI: Propidium iodide |
流式细胞术分析结果(图 3)显示,氧糖剥夺损伤可使大脑皮质神经元ROS产量增加 (1.24±0.02 vs 1.00±0.04,P<0.01);PNU-282987可抑制氧糖剥夺损伤神经元ROS产量的升高 (0.99±0.03 vs 1.24±0.02,P<0.01)。
 | 图 3 PNU-282987降低氧糖剥夺损伤诱导的大脑皮质神经元ROS产量 Fig 3 PNU-282987 reduced OGD-induced ROS production in cerebral cortical neurons Ctrl: Control; OGD: Oxygen-glucose deprivation: PNU: PNU-282987; ROS: Reactive oxygen species |
与对照组比较,氧糖剥夺后大脑皮质神经元HIF-1α蛋白表达增加(12.9±4.24 vs 1.00±0.04,P<0.05),HO-1蛋白表达减少 (0.15±0.08 vs 1.00±0.01,P<0.01)。与氧糖剥夺组相比,PNU-282987给药后HIF-1α蛋白表达减少(1.4±0.09 vs 12.9±4.24,P<0.05),HO-1蛋白表达增加 (0.47±0.07 vs 0.15±0.08,P<0.01)。结果表明PNU-282987可抑制氧化应激,对神经元具有保护作用。详见图 4。
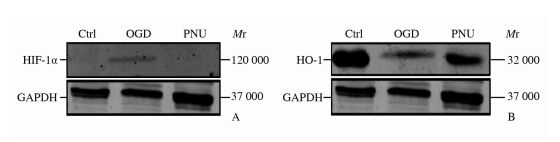 | 图 4 PNU-282987对氧糖剥夺损伤诱导的大脑皮质神经元HIF-1α(A)和HO-1(B)蛋白表达的影响 Fig 4 Effect of PNU-282987 on expression of HIF-1α (A) and HO-1 (B) protein in cerebral cortical neuron exposed to OGD Ctrl: Control; OGD: Oxygen-glucose deprivation; PNU: PNU-282987; HIF-1α: Hypoxia inducible factor-1α; HO-1: Hemeoxygenase-1 |
本实验采用原代培养大鼠大脑皮质神经元,接近于体内细胞生物学特性,而氧糖剥夺模型是体外研究脑缺血性损伤的主要细胞模型,是细胞水平研究脑缺血性损伤的基本方法[3]。近年来,脑缺血性损伤发病率逐年上升,给社会和家庭造成沉重的负担,因此研发神经元保护药物具有重要的临床意义。神经保护剂干预可阻断脑缺血性损伤的不同环节,起到神经保护作用[4]。脑缺血性损伤涉及的级联反应包括兴奋性氨基酸毒性、梗死周围去极化、炎性反应、细胞凋亡等过程[5]。脑缺血发生后,氧和葡萄糖供应减少,从而导致脑内氧化磷酸化过程发生障碍,能量减少甚至衰竭。而能量衰竭后又引起无氧糖酵解增加,产生的大量乳酸可引起组织酸中毒。LDH作为参与机体能量代谢的酶,当细胞受到损伤时,细胞膜破裂,LDH释放到细胞外,LDH浓度越高,说明机体受损伤的程度就越大。因此,LDH的活性改变可作为评价脑缺血程度的一个重要生化指标。有研究显示,神经元氧糖剥夺12 h时细胞凋亡明显[6],PNU-282987在氧糖剥夺条件下10 μmol/L为最佳浓度[7]。本研究结果表明,在大脑皮质神经元细胞氧糖剥夺12 h后LDH含量增加,而PNU-282987能降低LDH含量。
脑组织作为代谢最为活跃的器官,其自身能量和氧储备很少,能量来源完全依赖于血液所提供的氧和葡萄糖的有氧代谢,因而对缺血缺氧损伤极为敏感。脑缺血发生后,产生的大量乳酸引起组织酸中毒,进而引起细胞死亡。Binienda[8]研究证实,凋亡是神经元氧糖剥夺损伤后的重要死亡方式,并且凋亡率与氧糖剥夺损伤的程度在一定范围内呈正相关,因此抑制脑缺血性损伤后的凋亡能够降低神经细胞死亡率,减少受损神经元数量。本实验结果显示,氧糖剥夺可诱导神经元凋亡,PNU-282987预处理后,细胞凋亡率下降,说明PNU-282987能抑制氧糖剥夺诱导的神经元凋亡。
脑缺血性损伤导致细胞凋亡涉及多种病理环节,氧化应激是其核心环节。氧糖剥夺损伤引起神经元细胞内产生大量自由基,导致氧化应激,产生ROS。ROS作为细胞内重要的信使,可活化多种信号通路,进而导致细胞损伤,其中包括HIF-1α和HO-1信号通路[9]。HIF-1α是氧化还原敏感的转录因子,它是异源二聚体结构,由缺氧性诱导亚基α和结构调节性亚基β组成;正常条件下HIF-1α的表达很少,缺氧时,α亚基作为主要的调节因子进入细胞核内与β亚基结合形成二聚体而活化,结合低氧效应元件发挥效应,调控下游基因的转录[10]。HO-1作为HIF-1α靶基因,可参与细胞凋亡和增殖调控,其表达可以减少细胞死亡、蛋白质氧化及脂质过氧化,抵抗氧化应激对神经元的损害,抑制细胞凋亡,促进细胞增殖[11]。本实验结果显示,氧糖剥夺损伤诱导大脑皮质神经元HIF-1α的表达增加,HO-1蛋白表达降低,PNU-282987可反馈性降低氧糖剥夺损伤诱导的大脑皮质神经元HIF-1α表达,增加HO-1蛋白表达。这提示PNU-282987可通过降低HIF-1α表达,增加HO-1表达,减少氧化应激损伤,从而对神经元起到抗凋亡的作用。
研究表明,应用α7nAchR激动剂可增加血肿区域小胶质细胞的数量,进而对脑内出血引起的损伤具有神经保护作用[12];Park等[13]研究证实,激活α7nAchR可降低小神经胶质细胞的活性和减少脂多糖诱导的TNF-α的释放;另有研究证实,激活α7nAchR可减轻早期脑损伤[2]。但激动α7nAchR对大脑皮质神经元的作用尚未见报道。本研究发现激活α7nAchR对氧糖剥夺损伤的大脑皮质神经元具有抗凋亡作用,同时降低氧化应激产生的ROS产量,调节HO-1与HIF-1α蛋白表达,以抵抗氧糖剥夺引起的氧化应激损伤,证实PNU-282987对神经元的保护作用至少部分通过抗氧化应激而实现,提示α7nAchR有望成为脑缺血性损伤研究的新靶点。
| [1] | Lu Y, Zhang J, Ma B, Li K, Bai H, Yang Q, et al. Glycine attenuates cerebral ischemia/reperfusion injury by inhibiting neuronal apoptosis in mice[J].Neurochem Int,2012,61:649-658. |
| [2] | Duris K, Manaenko A, Suzuki H, Rolland W B, Krafft P R, Zhang J H. α7 nicotinic acetylcholine receptor agonist PNU-282987 attenuates early brain injury in a perforation model of subarachnoid hemorrhage in rats[J]. Stroke,2011,42:3530-3536. |
| [3] | Ye R, Li N, Han J, Kong X, Cao R, Rao Z, et al. Neuroprotective effects of ginsenoside Rd against oxygen-glucose deprivation in cultured hippocampal neurons[J]. Neurosci Res,2009,64:306-310. |
| [4] | Kemmeren J M, Tanis B C, van den Bosch M A, Bollen E L, Helmerhorst F M, van der Graaf Y, et al. Risk of Arterial Thrombosis in Relation to Oral Contraceptives (RATIO) study: oral contraceptives and the risk of ischemic stroke[J]. Stroke,2002,33:1202-1208. |
| [5] | Sanderson T H, Reynolds C A, Kumar R, Przyklenk K, Hüttemann M. Molecular mechanisms of ischemia-reperfusion injury in brain: pivotal role of the mitochondrial membrane potential in reactive oxygen species generation[J].Mol Neurobiol,2013,47:9-23. |
| [6] | 陈江瑛,闫振文,张素平,尹义臣.氯沙坦对离体培养大鼠海马神经元缺糖缺氧损伤的保护作用[J].中国临床药理学与治疗学,2014,19:984-987. |
| [7] | Parada E, Egea J, Buendia I, Negredo P, Cunha A C, Cardoso S, et al. The microglial α7-acetylcholine nicotinic receptor is a key element in promoting neuroprotection by inducing heme oxygenase-1 via nuclear factor erythroid-2-related factor 2 [J].Antioxid Redox Signal, 2013,19:1135-1148. |
| [8] | Binienda Z. A fetal rat model of acute perinatal ischemia-hypoxia[J].Ann N Y Acad Sci,1995,765:28-38, 59-61. |
| [9] | Singh M, Thomas P, Shukla D, Tulsawani R, Saxena S, Bansal A. Effect of subchronic hypobaric hypoxia on oxidative stress in rat heart[J]. Appl Biochem Biotechnol,2013,169:2405-2419. |
| [10] | Semenza G L. Regulation of metabolism by hypoxia-inducible factor 1[J]. Cold Spring Harb Symp Quant Biol,2011,76:347-353. |
| [11] | Nakamura T, Matsushima M, Hayashi Y, Shibasaki M, Imaizumi K, Hashimoto N, et al. Attenuation of transforming growth factor-β-stimulated collagen production in fibroblasts by quercetin-induced heme oxygenase-1[J]. Am J Respir Cell Mol Biol, 2011,44:614-620. |
| [12] | Hijioka M, Matsushita H, Ishibashi H, Hisatsune A, Isohama Y, Katsuki H. α7 Nicotinic acetylcholine receptor agonist attenuates neuropathological changes associated with intracerebral hemorrhage in mice[J].Neuroscience,2012,222:10-19. |
| [13] | Park H J, Lee P H, Ahn Y W, Choi Y J, Lee G, Lee D Y, et al. Neuroprotective effect of nicotine on dopaminergic neurons by anti-inflammatory action[J].Eur J Neurosci,2007,26:79-89. |
 2015, Vol. 36
2015, Vol. 36


