磁共振成像(magnetic resonance imaging,MRI)具有良好的组织对比度,但正常与异常组织的弛豫时间有较大的重叠,MRI对比剂的应用可以有效克服普通成像的序列限制、调节成像信号强度,进一步增强正常组织与病变组织间的对比度,实现病灶部位的有效检测[1, 2]。巨噬细胞是人体对病原引发炎症反应进行自身免疫调节的关键细胞,病灶早期阶段及深入发展阶段都会诱发招募大量巨噬细胞,由此,通过MRI对比剂实现巨噬细胞的定位检测对于相关疾病的诊断与治疗监测意义重大[2, 3]。纳米磁性对比剂具有特殊的理化及生物学特性,容易被体内组织中巨噬细胞所吞噬,进而引起相关病灶部位MRI信号强度变化,提高组织可视化水平[3, 4, 5];图像信号变化的区域往往与所摄取的磁性元素数量相关,利于开展检测信息的定量评价,因此纳米磁性对比剂可在巨噬细胞相关疾病诊疗方面发挥重要作用,如检测肿瘤、淋巴结转移、心血管系统病变等。本文就纳米磁性对比剂在巨噬细胞相关疾病MRI诊断中的应用进行综述。 1 纳米磁性对比剂的特性 1.1 理化性质
磁性纳米颗粒通常包括磁芯和亲水性表面包衣(图 1),其中磁芯由铁氧化物Fe3O4、γ-Fe2O3等组成[1],外层包衣材料主要是亲水性高分子聚合物,如葡聚糖、羧基葡聚糖或PEG等(表 1)。这种磁性颗粒常具有高磁化强度、高弛豫率甚至高磁性,用途包括磁性分选、诊断传感以及体内热疗。当磁性颗粒粒径小于磁性微粒临界值(50 nm)时,可以出现超顺磁性[2]。在MRI磁场中产生顺磁性,会使T2加权和T2加权序列上信号减低,可作为MRI阴性(T2)对比剂使用。至今已有数种此类对比剂被批准应用于临床,如Ferucarbotran、Ferumoxtran-10、Ferumoxytol等,这些磁性对比剂的理化性质特点可概括为:(1)粒径小,一般小于50 nm;(2)血浆半衰期较长,超过100 min;(3)生物相容性好;(4)易富集于巨噬细胞丰富的组织和器官;(5)在外磁场下受磁化而具有磁性,即可在较弱的外磁场中产生巨大磁性信号。以磁性对比剂Ferumoxtran-10为例,它是以葡聚糖包被的超小磁性纳米颗粒,直径范围15~30 nm,在人体血液中半衰期为24~36 h,有充足时间通过毛细血管壁,进入深部组织的巨噬细胞内(如淋巴结、脑、血管斑块等组织)[3]。值得指出的是,磁性对比剂在体内半衰期的长短取决于多种因素,如粒子大小、所带电荷、浓度等[4],而不同的亲水外层包裹物也将影响其代谢半衰期,羧基葡聚糖的血中半衰期较非离子型葡聚糖短[3]。
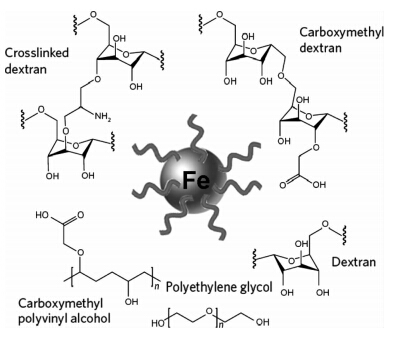 | 图 1 纳米磁性对比剂的结构示意图 Fig 1 Schematic structure of nano-magnetic contrast agent |
|
|
表 1 不同包衣类型的纳米磁性对比剂 Tab 1 Nano-magnetic contrast agents with different kinds of coatings |
临床应用的纳米磁性对比剂粒径主要分布在10~50 nm,在体内血循环过程中可被肝脏、脾脏、淋巴及骨髓内巨噬细胞所吞噬。 当磁性对比剂剂量超过肝、脾和骨髓等脏器的吞噬饱和能力时,其在血液中的半衰期也会延长,将有机会进入较深部位的器官,例如脑、肾、骨关节等。同时,这些磁性纳米材料也将会聚集在富含巨噬细胞的病变组织部位[3],如某些生长期的肿瘤组织、粥样硬化斑块以及缺血的心肌都可由于高通透性和滞留效应或被动吞噬而摄取磁性对比剂。
磁性对比剂可以有效进入巨噬细胞有关的组织及病变部位,但具体进入途径仍不明确,可能的机制包括[5]:(1)磁性对比剂被血管中巨噬细胞吞噬,随之转移到病理组织部位,例如PEG包衣的磁性造影剂具有长循环性质,使其有充分时间被血中巨噬细胞识别并吞噬;(2)磁性对比剂也会被渗漏的血管和受损的淋巴摄取并滞留;(3)磁性造影剂穿过内皮细胞进入组织,被组织中巨噬细胞吞噬;(4)磁性造影剂通过炎症新生血管进入组织巨噬细胞。这些机制也可能同时发生。
近年来,磁性对比剂Ferumoxtran-10的临床代谢报道相对较多,经体外验证,14C标记葡聚糖外衣的Ferumoxtran-10在被巨噬细胞吞噬后,其葡聚糖外衣会在胞内溶酶体作用下较快分解代谢[6]。而在59Fe示踪Ferumoxtran-10磁芯的体内代谢研究中发现,对比剂经体循环富集于肝、脾等组织[7, 8],葡聚糖包裹物降解后,磁芯的铁元素转变为铁离子,转运至骨髓系统后参与血红蛋白合成,并于Ferumoxtran-10注射后第28~56天血中59Fe达到峰值(约占注射总量65%~70%)[8]。因此在本质上,磁性对比剂没有长期的滞留毒性,磁芯铁元素渐进地转化为身体红血细胞的内生铁,并经过80 d以上的缓慢代谢由粪便途径排泄到体外[8]。 1.3 成像原理
目前临床应用广泛的钆螯合物MRI阳性对比剂Gd-DTPA,利用钆元素外层轨道上有不成对电子产生“分子磁矩”,促使氢质子弛豫加快,从而缩短组织弛豫时间,突出T1信号来增强造影效果。但Gd-DTPA存在体内消除过快、扫描时间窗很短的局限。而磁性对比剂作为T2对比剂具有超顺磁性,在较弱的外磁场中即可产生巨大顺磁性,干扰周围磁场,引起质子去相位而产生较强的负性增强(缩短T2信号)作用。同时,纳米磁性对比剂在血液中停留时间较长,可以数小时内使血管及富集部位保持较高的信号强度,而灌注期及增强期均有延长。除此之外,低浓度纳米磁性对比剂可与水分子结合,形成偶极子(dipole),偶极子相互作用可产生较高的R1弛豫率,即缩短T1信号值[9],Ferumoxytol造影表现为组织T2WI上信号降低的同时,T1WI信号显著增高,可兼具T1、T2对比剂效果[10, 11]。因此,临床上通过磁性对比剂增强后,经T1、T2和T2等不同MRI序列检测,将可获得更多的组织诊断及鉴别信息[12, 13]。 2 纳米磁性对比剂在巨噬细胞相关疾病MRI中的应用 2.1 心脑血管疾病 2.1.1 动脉粥样硬化(atherosclerosis,AS)
AS主要是炎症性疾病,起源于单核细胞,通过炎症趋化因子和黏附分子被动吸附于动脉内膜,经脂质沉积、细胞浸润分化为巨噬细胞与泡沫细胞,进一步形成硬化斑块。斑块破裂极易引起并发症,故对其稳定性的准确判断尤为关键。巨噬细胞在粥样硬化斑块的发生、演变及破裂过程中起重要作用[14]。因此,鉴别斑块中巨噬细胞的状态是临床评估斑块危险程度的重要依据。国内马小龙等[15]利用超顺磁纳米颗粒USPIO对兔动脉粥样斑块模型进行MRI成像研究,发现注射磁性对比剂后,破裂斑块中USPIO聚集明显增加,血管斑块T1WI信号显著强化,T2WI信号则显著降低,对比噪声比明显上升,并在注射48、72 h后信噪比(SNR)持续上升。这将有助于反映斑块炎性浸润程度,明确斑块性质,并有可能成为确定斑块稳定性的量化指标。 2.1.2 梗死
梗死多由易损斑块破裂所引发,即动脉硬化斑块外基质与血管壁分离,脱落斑块易在动脉细长或弯曲部位阻滞而形成局部梗死,严重时会导致心肌梗死或卒中。Nahrendorf等[16]采用磁性对比剂的T2WI信号定位由动脉斑块破裂引发的急性心肌梗死;Yilmaz等[17]采用Ferumoxytol与钆螯合对比剂分别定位左心室壁的梗死,二者信号区域相一致(图 2)。但相对而言,通过磁性纳米对比定位巨噬细胞可以更精确地检测梗死的状态,判断个体患者的风险状况。在脑卒中缺血的临床研究中,通过静脉注射USPIO,24 h后T2WI水肿区出现低信号,以第2、第3天信号降低最为明显[18]。说明磁性对比剂可以透过血脑屏障出现在巨噬细胞聚集较多的缺血灶边缘,对MRI及时诊断及监测中风存在、发展及脑组织的损伤具有重要作用。
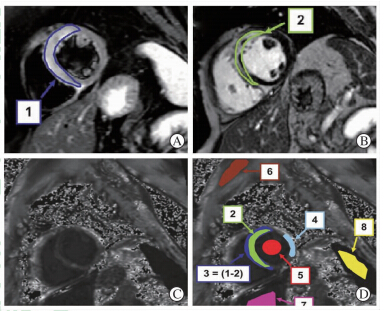 | 图 2 布左心室T2*-mapping图像[17] Fig 2 T2*-mapping images of the left ventricle[17] These regions of interest corresponded to the peri-infarct zone (3) which derived by the subtraction of the hyperenhanced area on T2-weighted short-tau inversion recovery-spin echo images (1) from the hyperenhanced area on late gadolinium enhancement images (2) (A and B),the infarct core (2),remote myocardium (4),blood pool (5),skeletal muscle (6),liver (7),and spleen (8) (C and D) |
主动脉瘤常发生在升主动脉及胸腹主动脉壁,通过局部异常扩张压迫周围器官而引起症状,瘤体破裂具有致命危险。当前临床诊疗方案为:影像测量动脉瘤超过一定体积后采用手术修补。但目前影像测量效果并不令人满意,如许多动脉瘤偏大但较稳定的患者,不必要承担手术风险;而许多动脉瘤很小却不稳定的患者,很可能因未手术而面临瘤体破裂的危险。由此可见,诊断动脉瘤所在动脉壁的成分比测量瘤体大小更具诊断意义[19]。磁性对比剂可对主动脉瘤中巨噬细胞的成像检测发挥巨大作用。Richards等[20]在临床研究中通过T2WI检测摄取USPIO后的动脉瘤炎性细胞,用以判断动脉瘤在血管壁中的浸润程度及生长速度。这意味着通过磁性对比剂成像不仅可以检测动脉瘤大小,更可对临床预判动脉瘤破裂风险和评估治疗效果产生积极影响。 2.1.4 心肌炎症
巨噬细胞在许多心脏炎症反应中也发挥着重要作用,如在心肌炎或心脏移植排斥反应中,均会出现巨噬细胞渗入心脏的现象。 由心肌梗死引发急性炎症的心脏中每克心肌中含巨噬细胞比例也会高于正常心肌[21]。由此,通过磁性对比剂对心肌巨噬细胞成像检测成为研究的热点之一[22],磁性造影剂T2图像信号变化与心肌炎症的严重性相关联。如果此项技术能成功应用于临床,将有利于实现无创诊断,避免目前心肌穿刺活检而造成心脏瓣膜损害等风险。另外,Wu等[23]发现磁性纳米粒对小鼠心脏移植排斥模型也具有检测意义。 2.2 肿瘤 2.2.1 肝肿瘤
正常肝组织富含大量巨噬细胞以及Kupffer细胞,可被动吞噬磁性对比剂而减低肝脏相应部位的T2信号强度。而恶性肝实质肿瘤中含有巨噬细胞极少,会导致静脉注射磁性对比剂增强后,在T1WI中,肿瘤与正常肝脏组织和血管相比呈低信号;而在T2WI中,正常肝脏组织和血管信号强度下降,瘤内组织呈现相对高信号。这种显著差异可大幅提高病灶检出率,有利于临床良、恶性肝脏病变的鉴别。另外,较大的肝脏转移瘤瘤体周围富含新生滋养血管,内部又常存在不同程度组织坏死,增强扫描可出现环形牛眼特征[24]。而利用USPIO增强扫描肝部血管瘤时,T1WI图像往往会出现高信号[24]。此方法对诊断肝硬化患者有一定局限性,原因在于严重的肝硬化会影响肝内细胞对磁性对比剂的摄取,造成T2WI背景肝脏信号混杂不均,易混淆肝内病灶[25]。因此,综合观察T1WI及T2/T2WI 能提供更多的病灶增强特点,从而有助于肝脏肿瘤鉴别诊断。 2.2.2 其他实体肿瘤
一般情况下,实体肿瘤会通过组织重塑和血管发生,浸润于人体各种器官的宿主细胞中。伴随着肿瘤的发生发展,瘤体自身的高通透性和滞留效应将会被动富集纳米磁性对比剂。除此之外,源于免疫系统的巨噬细胞也聚集在许多类型的肿瘤组织,它们被称为“肿瘤相关的巨噬细胞”(tumour-associated macrophages,TAMs)。TAMs的出现往往被认为与肿瘤的快速生长以及生存期降低密切相关,比如过表达CCL2的肿瘤可以召集炎症性单核细胞,并影响巨噬细胞分化生长[26]。这些TAMs也可摄取磁性纳米对比剂。Kircher等[27]发现通过磁性材料纳米粒的MRI造影以及近红外荧光诊断,可以实现脑胶质瘤模型的肿瘤边际定位。此外,应用磁性对比剂造影TAMs还对区分原位肿瘤与转移灶、指导组织活检等具有临床意义[28, 29]。 2.2.3 肿瘤淋巴结转移
精确判定淋巴结转移对于肿瘤分期、预后及治疗决策制定有着极其重要的参考意义。目前,常用的判定淋巴结转移的影像学诊断方法主要是CT和MRI。但由于临床上主要是根据淋巴结的大小及形态来进行判断,不能特异性判定增大的淋巴结是肿瘤转移或反应性增生等情况,因此MRI在淋巴诊断上仍然存在一定的局限。美国FDA已批准磁性对比剂Ferumoxtran-10用于淋巴结肿瘤的分期诊断,临床中经静脉注射磁性对比剂后,超顺磁性颗粒可通过毛细血管直接到达淋巴系统的高内皮小静脉进入淋巴结,对比剂的顺磁性将使正常的淋巴结组织T2/T2WI信号减低;而转移性淋巴结中的恶性组织难以摄取磁性对比剂而依然保持高的信号强度[30]。由此,利用MRI磁性对比剂造影可以获得更多的淋巴结信息,有效提高淋巴结的定性诊断。临床实践证明,在头、颈部、盆腔肿瘤淋巴结转移评价上,采用MRI磁性对比剂进行造影具有明显的优势[31]。 2.3 其他巨噬细胞相关炎性疾病
巨噬细胞浸润是炎症的核心环节,磁性纳米对比剂的特性使其在相关炎性疾病诊断中具有明显的优势,已有其在糖尿病[32]、关节炎[33]、神经炎症、多发性硬化[34]等疾病中的研究报道。其中,1型糖尿病的诊断研究颇具临床价值。Gaglia等[32]采用磁性对比剂Ferumoxtran-10富集于人体胰脏,在重建的T2伪彩图与3D-VIBE融合的图像上可有效地观测出1型糖尿病患者与健康人的胰腺区别(图 3),这种无创成像方式有望跟踪1型糖尿病进程,以及监测免疫调节剂对胰腺炎的治疗效果。在关节炎动物模型中,经静脉注入磁性对比剂,可见滑膜于T1WI上信号升高,T2WI及T2WI上信号减低,关节积液于T2WI上的信号也降低,组织学证实增生滑膜及积液中巨噬细胞吞噬了氧化铁颗粒[35]。
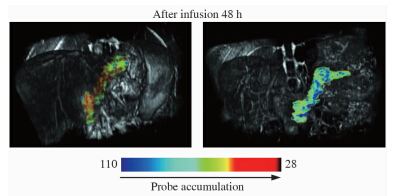 | 图 3 1型糖尿病患者注射磁性对比剂48 h后在重建的T2伪彩图与3D-VIBE融合的图像[32] Fig 3 T2-pseudocolor reconstructions of pancreas overlaid on 3D-VIBE images 48 h after ferumoxtran-10 infusion and accumulation into macrophages in insulitis islets[32] |
通过靶基因、靶分子修饰磁性纳米材料来构建靶向性MRI探针已经成为重要的影像学研究方向,靶向磁性对比剂可以识别特定活化的巨噬细胞,对于实现病灶部位的功能性诊断具有良好的应用潜力。Wen 等[36]制备血凝素样氧化低密度脂蛋白受体1(LOX-1)靶向的USPIO对比剂,针对ApoE基因缺陷小鼠MRI成像研究显示靶向性对比剂可靶向活化的RAW264.7巨噬细胞,并能运用于体内高脂血症诱导的肾脏炎症以及AS易损斑块的MRI检测。Bierry等[37]采用关节腔内注射靶向USPIO,对比剂可由活化的巨噬细胞选择性吞噬,利用MRI梯度回波图像可有效实现骨急性滑膜炎的无创早期检测和治疗监测。 3 总结及展望
纳米磁性对比剂已成为一种极具潜力的MRI对比剂,与传统的钆螯合对比剂相比,磁性对比剂在巨噬细胞相关疾病造影方面显示出特殊的诊断优势,尤其在心脑血管系统及淋巴、肿瘤方面,磁性对比剂的MRI影像可以提供难以替代的效果与信息。同时,为了更好地满足临床鉴别诊断需求,提高成像敏感性、增强影像效果仍是磁性对比剂重要的发展方向。相信随着材料学以及影像学的进步,还将有更多性质稳定、相容性良好、成像精确的磁性对比剂应用于临床。
| [1] | Chourpa I, Douziech-Eyrolles L, Ngaboni-Okassa L, Fouquenet J F, Cohen-Jonathan S, Souce M, et al. Molecular composition of iron oxide nanoparticles, precursors for magnetic drug targeting, as characterized by confocal Raman microspectroscopy[J].Analyst, 2005, 130: 1395-1403. |
| [2] | Di Marco M,Sadun C,Port M,Guilbert I,Couvreur P,Dubernet C. Physicochemical characterization of ultrasmall superparamagnetic iron oxide particles (USPIO) for biomedical application as MRI contrast agents[J].Int J Nanomedicine, 2007, 2: 609-622. |
| [3] | Xia X R,Monteiro-Riviere N A,Riviere J E. An index for characterization of nanomaterials in biological systems[J].Nat Nanotechnol, 2010, 5: 671-675. |
| [4] | Briley-Saebo K, Bjornerud A, Grant D, Ahlstrom H, Berg T, Kindberg G M. Hepatic cellular distribution and degradation of iron oxide nanoparticles following single intravenous injection in rats: implications for magnetic resonance imaging[J].Cell Tissue Res, 2004, 316: 315-323. |
| [5] | Kanno S, Wu Y J, Lee P C, Dodd S J, Williams M, Griffith B P, et al. Macrophage accumulation associated with rat cardiac allograft rejection detected by magnetic resonance imaging with ultrasmall superparamagnetic iron oxide particles[J].Circulation, 2001, 104: 934-938. |
| [6] | Freund B, Tromsdorf U I, Bruns O T, Heine M, Giemsa A, Bartelt A, et al. A simple and widely applicable method to 59Fe-radiolabel monodisperse superparamagnetic iron oxide nanoparticles for in vivo quantification studies[J].ACS Nano, 2012, 6: 7318-7325. |
| [7] | Bourrinet P, Bengele H H, Bonnemain B, Dencausse A, Idee J M, Jacobs P M, et al. Preclinical safety and pharmacokinetic profile of ferumoxtran-10, an ultrasmall superparamagnetic iron oxide magnetic resonance contrast agent[J].Invest Radiol,2006,41:313-324. |
| [8] | Islam T, Wolf G. The pharmacokinetics of the lymphotropic nanoparticle MRI contrast agent ferumoxtran-10[J].Cancer Biomark, 2009, 5: 69-73. |
| [9] | Corot C, Robert P, Idee J M, Port M. Recent advances in iron oxide nanocrystal technology for medical imaging[J].Adv Drug Deliv Rev, 2006, 58: 1471-1504. |
| [10] | Enden T, Storas T H, Negard A, Haig Y, Sandvik L, Gjesdal K I, et al. Visualization of deep veins and detection of deep vein thrombosis (DVT) with balanced turbo field echo (b-TFE) and contrast-enhanced T1 fast field echo (CE-FFE) using a blood pool agent (BPA)[J]. J Magn Reson Imaging, 2010, 31: 416-424. |
| [11] | Milot L, Haider M, Foster L, Mcgregor C, Law C. Gadofosveset trisodium in the investigation of focal liver lesions in noncirrhotic liver: early experience[J]. J Magn Reson Imaging, 2012, 36: 738-742. |
| [12] | Hasan D M, Chalouhi N, Jabbour P, Dumont A S, Kung D K, Magnotta V A, et al. Evidence that acetylsalicylic acid attenuates inflammation in the walls of human cerebral aneurysms: preliminary results[J]. J Am Heart Assoc, 2013, 2: e19. |
| [13] | Chen Y, Zhu W, Bollen A W, Lawton M T, Barbaro N M, Dowd C F, et al. Evidence of inflammatory cell involvement in brain arteriovenous malformations[J]. Neurosurgery, 2008, 62: 1340-1350. |
| [14] | Stoll G, Bendszus M. Inflammation and atherosclerosis: novel insights into plaque formation and destabilization[J]. Stroke, 2006, 37: 1923-1932. |
| [15] | 马小龙,陆建平,刘 崎,金爱国. 超微超顺磁性氧化铁和钆对比剂增强兔动脉硬化斑块之比较[J].放射学实践,2009,24: 976-981. |
| [16] | Nahrendorf M, Pittet M J, Swirski F K. Monocytes: protagonists of infarct inflammation and repair after myocardial infarction[J]. Circulation, 2010, 121: 2437-2445. |
| [17] | Yilmaz A, Dengler M A, van der Kuip H, Yildiz H, Rosch S, Klumpp S, et al. Imaging of myocardial infarction using ultrasmall superparamagnetic iron oxide nanoparticles: a human study using a multi-parametric cardiovascular magnetic resonance imaging approach[J].Eur Heart J, 2013, 34: 462-475. |
| [18] | Saleh A, Schroeter M, Ringelstein A, Hartung H P, Siebler M, Modder U, et al. Iron oxide particle-enhanced MRI suggests variability of brain inflammation at early stages after ischemic stroke[J]. Stroke, 2007, 38: 2733-2737. |
| [19] | Buxton D B. Molecular imaging of aortic aneurysms[J]. Circ Cardiovasc Imaging, 2012, 5: 392-399. |
| [20] | Richards J M, Semple S I, Macgillivray T J, Gray C, Langrish J P, Williams M, et al. Abdominal aortic aneurysm growth predicted by uptake of ultrasmall superparamagnetic particles of iron oxide: a pilot study[J].Circ Cardiovasc Imaging, 2011, 4: 274-281. |
| [21] | Alam S R, Shah A S, Richards J, Lang N N, Barnes G, Joshi N, et al. Ultrasmall superparamagnetic particles of iron oxide in patients with acute myocardial infarction: early clinical experience[J]. Circ Cardiovasc Imaging, 2012, 5: 559-565. |
| [22] | Moon H, Park H E, Kang J, Lee H, Cheong C, Lim Y T, et al. Noninvasive assessment of myocardial inflammation by cardiovascular magnetic resonance in a rat model of experimental autoimmune myocarditis[J]. Circulation, 2012, 125: 2603-2612. |
| [23] | Wu Y L, Ye Q, Sato K, Foley L M, Hitchens T K, Ho C. Noninvasive evaluation of cardiac allograft rejection by cellular and functional cardiac magnetic resonance[J]. JACC Cardiovasc Imaging, 2009, 2: 731-741. |
| [24] | Nasu K, Kuroki Y, Nawano S, Kuroki S, Tsukamoto T, Yamamoto S, et al. Hepatic metastases: diffusion-weighted sensitivity-encoding versus SPIO-enhanced MR imaging[J]. Radiology, 2006, 239: 122-130. |
| [25] | Tanabe M, Ito K, Shimizu A, Fujita T, Onoda H, Yamatogi S, et al. Hepatocellular lesions with increased iron uptake on superparamagnetic iron oxide-enhanced magnetic resonance imaging in cirrhosis or chronic hepatitis: comparison of four magnetic resonance sequences for lesion conspicuity[J].Magn Reson Imaging, 2009, 27: 801-806. |
| [26] | Mantovani A, Sica A. Macrophages, innate immunity and cancer: balance, tolerance, and diversity[J].Curr Opin Immunol, 2010, 22: 231-237. |
| [27] | Kircher M F, Mahmood U, King R S, Weissleder R, Josephson L. A multimodal nanoparticle for preoperative magnetic resonance imaging and intraoperative optical brain tumor delineation[J]. Cancer Res, 2003, 63: 8122-8125. |
| [28] | Weissleder R, Pittet M J. Imaging in the era of molecular oncology[J]. Nature, 2008, 452: 580-589. |
| [29] | Zimmer C, Wright S C Jr, Engelhardt R T, Johnson G A, Kramm C, Breakefield X O, et al. Tumor cell endocytosis imaging facilitates delineation of the glioma-brain interface[J].Exp Neurol, 1997, 143: 61-69. |
| [30] | Rockall A G, Sohaib S A, Harisinghani M G, Babar S A, Singh N, Jeyarajah A R, et al. Diagnostic performance of nanoparticle-enhanced magnetic resonance imaging in the diagnosis of lymph node metastases in patients with endometrial and cervical cancer[J].J Clin Oncol, 2005, 23: 2813-2821. |
| [31] | Saokar A, Islam T, Jantsch M, Saksena M A, Hahn P F, Harisinghani M G. Detection of lymph nodes in pelvic malignancies with computed tomography and magnetic resonance imaging[J]. Clin Imaging, 2010, 34: 361-366. |
| [32] | Gaglia J L, Guimaraes A R, Harisinghani M, Turvey S E, Jackson R, Benoist C, et al. Noninvasive imaging of pancreatic islet inflammation in type 1A diabetes patients[J].J Clin Invest, 2011, 121: 442-445. |
| [33] | Binstadt B A, Patel P R, Alencar H, Nigrovic P A, Lee D M, Mahmood U, et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack[J]. Nat Immunol, 2006, 7: 284-292. |
| [34] | Tourdias T, Roggerone S, Filippi M, Kanagaki M, Rovaris M, Miller D H, et al. Assessment of disease activity in multiple sclerosis phenotypes with combined gadolinium-and superparamagnetic iron oxide-enhanced MR imaging[J].Radiology, 2012, 264: 225-233. |
| [35] | Lutz A M, Seemayer C, Corot C, Gay R E, Goepfert K, Michel B A, et al. Detection of synovial macrophages in an experimental rabbit model of antigen-induced arthritis: ultrasmall superparamagnetic iron oxide-enhanced MR imaging[J].Radiology, 2004, 233: 149-157. |
| [36] | Wen S, Liu D F, Cui Y, Harris S S, Chen Y C, Li K C, et al. In vivo MRI detection of carotid atherosclerotic lesions and kidney inflammation in ApoE-deficient mice by using LOX-1 targeted iron nanoparticles[J]. Nanomedicine, 2014, 10: 639-649. |
| [37] | Bierry G,Lefevre S,Dietemann J L,Jehl F. In vivo macrophage imaging using MR targeted contrast agent for longitudinal evaluation of septic arthritis[J].J Vis Exp, 2013, 20: e50296. |
 2015, Vol. 36
2015, Vol. 36


