2. 上海体育学院运动科学院, 上海200438;
3. 上海中医药大学药学院, 上海 201210
2. School of Kinesiology, Shanghai University of Sport, Shanghai 200438, China;
3. College of Pharmacy, Shanghai University of Traditional Chinese Medicine, Shanghai 201210, China
抑郁症(depression)是一类全球性的神经精神系统疾病,具有高发病率、高死亡率和高致残率的特点。研究发现,女性群体的抑郁症发病率是男性的2~3倍,特别是在体内雌激素急剧减少的围绝经期,约有46%的女性罹患更年期抑郁症[1]。动物研究也表明,动物血清雌二醇(estradiol,E2)水平与抑郁样行为负相关[2]。众所周知,雌激素是由卵巢产生的一类类固醇类激素,包括E2、雌三醇和雌酮,其中E2是体内活性最强、最为重要的雌激素形式。E2不仅与机体的生殖功能有关,在中枢神经系统中还参与学习记忆、情绪反应等诸多生理过程,并与抑郁症等精神神经系统疾病密切相关。然而,关于雌激素调节抑郁情绪的机制尚未完全阐明。
近年来的研究提示,抑郁症是一种炎症性疾病。抑郁症患者以及抑郁症模型动物的脑组织呈炎性状态,如抑郁症患者脑脊液中促炎细胞因子水平明显升高,而应用抗炎药物能够明显改善其抑郁症状[3];在慢性应激导致的抑郁动物模型中,大脑皮质白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α) 等促炎细胞因子表达量增加[4]。因此,有人提出抑郁症的发生与脑内炎症反应有关。已有研究报道,雌激素可以抑制去卵巢(Ovx)大鼠心血管组织的炎症反应,发挥抗炎作用[5]。但雌激素缺乏所致抑郁样行为是否与脑内炎症反应有关尚无明确报道。
目前临床上常用三环类抗抑郁药合并雌激素替代疗法来治疗女性更年期抑郁症。但是这种治疗方案存在一定不足:一方面,三环类抗抑郁药具有明显的肝、肾毒性,还可引发心理依赖等问题;另一方面,雌激素可以直接导致子宫内膜癌和乳腺癌等恶性肿瘤的发病率增加[6]。因此,人们一直在寻求更为安全有效的治疗更年期抑郁症的新方法。
近年来,运动锻炼作为一种新型抗抑郁手段越来越受到学者们广泛关注。运动锻炼能够增强机体的心肺功能,调节机体代谢和神经内分泌,从而改善冠心病、神经官能症等多种疾病的临床症状[7, 8, 9]。运动锻炼也能够有效地缓解多种原因(如慢性应激、胎儿期糖皮质激素暴露等)所导致的抑郁样行为[10, 11, 12]。而有关运动锻炼能否调节雌激素缺乏所致抑郁样行为,以及其机制是否涉及脑内炎症状态尚无文献报道。
本研究旨在探讨雌激素缺乏对动物抑郁样行为的影响及其内在机制以及运动锻炼对此的作用,这将有助于阐明女性更年期抑郁症的发病机制,并为运动锻炼作为一种更安全有效的抗抑郁手段提供理论基础。 1 材料和方法 1.1 动物来源
60只成年雌性SPF级C57BL/6J 小鼠,购于上海西普尔-必凯实验动物有限公司[动物生产许可证号:SCXK(沪)2012-0003],于通风良好、卫生清洁的动物房内适应性饲养1周,自由饮食。动物房温度控制在(22±2)℃,相对湿度为40%~70%,光照度控制在150~300 lx,光照时间12 h(7:00~19:00)。本研究通过第二军医大学科学研究伦理委员会审核,所有操作均遵循国家《实验动物管理条例》及《国家实验动物管理实施细则》。 1.2 建立去卵巢小鼠模型
将小鼠随机分为A组和B组,每组30只。将A组小鼠腹腔注射10%水合氯醛0.1 mL,待动物麻醉后俯卧于手术板上并固定四肢,75%乙醇棉球擦拭消毒背部皮肤,沿正中剪开长约1.5 cm切口,剪开肌肉层找到卵巢(卵巢为粉红色球形组织团),结扎支配卵巢的血管后剪下卵巢,随后以同样方法去除另一侧卵巢。手术完成后分层缝合切口。B组小鼠的处理方法同A组,但在找到两侧卵巢后不予去除,仅去除卵巢附近一块与卵巢大小接近的脂肪组织,其余操作同A组。手术结束后将两组实验动物饲养于完全相同的环境中,自由饮食。 1.3 动物分组及运动锻炼
术后恢复1周,将A组平均分为去卵巢组(Ovx组)和去卵巢+运动组(Ovx+Ex组),将B组平均分为假手术组(Sham组)和假手术+运动组(Sham+Ex组),每组15只。对Sham+Ex组和Ovx+Ex组小鼠进行5周的运动锻炼,每周于固定时间点训练5 d,休息2 d。其中第1周为适应性跑台锻炼(方案:跑道倾角0°,第1天速度为12 m/min,时间为10 min;第2~4天训练强度不变,逐步增加训练时间分别至20、30、40 min;第5天速度为15 m/min,时间为40 min),后4周为正式跑台锻炼(方案:跑道倾角0°,跑步速度15 m/min,时间40 min)。 1.4 行为学测试 1.4.1 糖水实验
适应性实验:正式性糖水实验开始前1周进行糖水适应,即实验小鼠单只单笼饲养,每只笼子配2只分别装有自来水和1%糖水的饮水瓶,保证水瓶摆放的位置、高度一致,每隔12 h将2只饮水瓶的位置互换1次。适应性糖水实验持续1周,在这期间跑台运动锻炼时将小鼠拿出饲养笼,运动结束后放回。正式性实验:糖水适应实验1周后,分别向每只水瓶加入足量的糖水或自来水并称量,记录糖水和自来水总质量,24 h后再次称量糖水和自来水总质量,分别计算每只小鼠24 h消耗的糖水量占总水量(糖水量+自来水量)的百分比。 1.4.2 旷场实验
通过观察动物在开阔环境的行为反应,判断动物探索性行为的变化。安静环境下将实验小鼠放入测试箱中,动物在测试箱中自由活动5 min。待实验结束后选用中央活动路程、穿越场中心次数2个指标来判断动物是否出现抑郁样行为。 1.4.3 悬尾实验
通过测试动物逃脱的愿望来评价抑郁情绪。安静环境下用胶带在距实验鼠尾根1/3处将铁丝钩粘住并将其倒挂在测试设备上,测试时间为5 min。实验结束后,记录小鼠的不动时间作为评价抑郁样行为指标。 1.5 标本获取与检测
实验结束后采用快速断头法处死动物,用1.5 mL离心管收集血液,室温静置10 min,3 000×g离心10 min后吸取上层血清并及时放入-80℃低温冰箱保存备用。同时,冰上剥离脑组织,分离海马并装入冻存管中,用液氮将上述标本迅速冷冻后转移至-80℃冰箱中保存备用。用ELISA法(ELISA试剂盒购自上海西塘生物科技有限公司)测定血清E2及大脑海马组织5-HT、吲哚胺2,3-双加氧酶(IDO)、各炎性因子含量,具体操作按试剂盒说明书进行。
1.6 统计学处理
采用SPSS 18.0统计软件进行统计学分析,计量数据以x±s 表示,多组间比较采用双因素方差分析 (two-way ANOVA)。检验水准(α)为0.05。
2 结 果
2.1 Ovx小鼠体质量、子宫质量和血清E2浓度的变化
由表 1可见,与Sham组相比,Ovx组小鼠体质量增加(P<0.05),子宫质量减少(P<0.01),血清E2浓度降低(P<0.01),表明Ovx小鼠模型构建成功。
在糖水实验中,糖水消耗百分比下降情况可以反映动物快感缺失,这是抑郁症的典型症状之一。实验结果(图 1A)显示:与Sham组比较,Ovx组小鼠24 h糖水消耗百分比降低(P<0.01);较Ovx组,Ovx+Ex组24 h糖水消耗百分比上升(P<0.01);与Sham组比较,Sham+Ex组24 h糖水消耗百分比没有明显变化。可见运动锻炼能逆转Ovx小鼠糖水消耗量的下降。
在旷场实验中,中央活动路程和穿越场中心次数可以反映动物的探索性行为,这也是动物抑郁情绪的重要指标。实验结果(图 1B、图 1C)显示:与Sham组相比,Ovx组小鼠中央活动路程和穿越场中心次数降低(P<0.05);较Ovx组,Ovx+Ex组小鼠中央活动路程和穿越场中心次数增多(P<0.05);与Sham组相比,Sham+Ex组中心活动路程和穿越场中心次数没有明显变化。可见运动锻炼能够逆转Ovx小鼠中央活动路程和穿越场中心次数的改变。
在悬尾实验中,动物不动时间反映其绝望情绪,这也是判断动物是否出现抑郁情绪的重要指标。实验结果(图 1D)显示:与Sham组相比,Ovx组小鼠不动时间增加(P<0.05);较Ovx组,Ovx+Ex组小鼠不动时间减少(P<0.05);与Sham组比较,Sham+Ex组不动时间没有明显差异。可见运动锻炼能够逆转Ovx小鼠不动时间增加。
2.3 运动锻炼对Ovx小鼠大脑海马组织炎性因子表达的影响
经检测各组小鼠海马组织中促炎细胞因子(IL-1β、IL-6和IFN-γ)以及抑炎细胞因子(IL-4和IL-10)的表达后发现,与Sham组相比,Ovx组小鼠海马组织中IL-1β、IL-6、IFN-γ含量增加,而IL-4、IL-10含量降低(P<0.05或P<0.01); 与Ovx组比较,Ovx+Ex组小鼠海马组织中IL-1β、IFN-γ含量减少,而IL-4含量增加(P<0.05或P<0.01);与Sham组相比,Sham+Ex组IL-1β、IL-6、IFN-γ以及IL-4、IL-10都没有明显的差异(表 2)。
实验结果显示,与Sham组比较,Ovx组小鼠海马中5-HT含量降低(P<0.01),IDO含量升高(P<0.05);与Ovx组比较,Ovx+Ex组小鼠海马中5-HT含量升高(P<0.05),IDO含量降低(P<0.01);与Sham组相比,Sham+Ex组5-HT和IDO含量没有明显差异(图 2)。说明运动锻炼能够逆转Ovx小鼠5-HT和IDO含量的改变。
E2是一类类固醇类激素,它不仅参与调节机体的生殖活动,还与学习记忆、神经保护和情绪反应等生理功能密切相关。流行病学调查显示,抑郁症的发病有着明显的性别差异,女性抑郁症的发病率是男性的2~3倍[1],这被认为与血清E2含量密切相关[13]。动物研究也表明,在一个动情周期中,动情间期动物血清E2水平较低而抑郁样行为增加[2]。卵巢是合成雌激素的主要场所,摘除小鼠双侧卵巢能够降低体内雌激素水平并能很好地模拟绝经期妇女雌激素的缺乏。在Ovx模型上,我们观察到在糖水实验中糖水消耗百分比下降,旷场实验中中央活动路程和穿越场中心的次数降低,悬尾实验中小鼠不动时间增加,提示Ovx组小鼠发生了快感缺失、探究性行为减少、绝望情绪增加,说明其出现了抑郁样行为。
众所周知,适量的体育锻炼能够改善机体的不良情绪。临床研究证实,运动锻炼可以改善抑郁症状并且也作为一种治疗手段被应用[10],然而其中的生物学机制目前还未阐明。动物实验也证实,运动锻炼可以明显改善慢性应激和胚胎期受到应激刺激等多种因素所导致动物的抑郁样行为[10, 11, 12]。然而运动锻炼对雌激素缺乏所导致的抑郁样行为具有怎样的影响?目前尚无相关报道。与之前的研究结果相类似,在本实验中,给予Ovx小鼠跑台锻炼后能够改善它们的抑郁样行为,提示运动锻炼对雌激素缺乏所致抑郁样行为同样有着积极的改善作用。而其中的机制尚未阐明。要想了解运动锻炼是如何改善雌激素缺乏所致的抑郁样行为,必须先明确雌激素缺乏产生抑郁样行为的机制。不同运动锻炼时间对炎症因子水平的影响可能不同。Masson等[14]研究发现,运动锻炼2周后才开始引起自发性高血压大鼠下丘脑室旁核中炎细胞因子TNF-α、IL-6等表达降低,运动锻炼8周仍维持在较低水平,提示运动锻炼2周后即可以改变脑内炎症因子水平。本研究中,我们选取运动锻炼5周后观察雌激素缺乏所致小鼠抑郁样行为的炎症机制。
近年来的研究提示,抑郁症是一种炎症性疾病,抑郁症患者以及抑郁症动物模型的脑组织呈现炎性状态。临床研究发现,抑郁症患者血清中一些促炎细胞因子水平升高,而一些抑炎细胞因子在应用抗抑郁药物后表达上升[15]。有研究报道,雌激素可以抑制Ovx大鼠心血管组织的炎症反应发挥抗炎作用[5]。我们的研究结果显示,Ovx组小鼠海马促炎细胞因子IL-1β、IL-6和IFN-γ含量增加,而抑炎细胞因子IL-4和IL-10含量降低,提示雌激素缺乏可能是打破了促炎性细胞因子和抑炎细胞因子之间的平衡导致动物抑郁样行为。
研究认为,促炎细胞因子如IFN-γ、IL-1β和IL-6等能够增加IDO的表达[16]。而抑制脑内IDO的水平能够改善各种急性、慢性炎症诱发的抑郁样行为[17, 18]。Sublette等[19]认为,抑郁症与脑中单胺类神经递质如5-HT等含量低下有关,而IDO作为色氨酸代谢过程中关键的限速酶,能够催化色氨酸循犬尿氨酸途径代谢降解,间接导致5-HT含量减少。Liu等[11]研究认为,IDO水平增加可导致犬尿氨酸增加,脑组织中5-HT 含量降低,从而诱发抑郁样行为。在本实验中发现,Ovx小鼠不仅出现了抑郁样行为,同时海马5-HT含量降低,IDO含量升高,提示雌激素缺乏通过调节脑内炎症反应导致IDO增加,引起色氨酸代谢异常,从而导致动物抑郁样行为。
为了探讨运动锻炼改善雌激素缺乏所致抑郁症状的机制是否涉及脑内炎症反应和5-HT、IDO改变,我们在Ovx小鼠运动锻炼的模型中进行了研究,发现Ovx小鼠跑台锻炼后可以逆转海马炎性细胞因子IL-1β、IFN-γ和IL-4表达的改变,提示运动锻炼可能通过平衡促炎性细胞因子和抑炎细胞因子表达而改善雌激素缺乏所致的抑郁样行为。同样运动锻炼也可以逆转Ovx小鼠海马5-HT含量的降低和IDO含量的升高,提示运动锻炼可能通过脑内炎症反应调节中枢单胺类神经递质系统以及色氨酸代谢来改善雌激素缺乏所致的抑郁样行为。
综上所述,雌激素缺乏可导致小鼠出现抑郁样行为,给予运动锻炼可缓解这一现象。雌激素缺乏导致海马组织中促炎细胞因子IL-1β、IL-6、IFN-γ升高,抑炎细胞因子IL-4、IL-10降低,以及5-HT含量降低,IDO含量升高。给予运动锻炼能够逆转炎性细胞因子以及5-HT、IDO改变。因此,本研究结果提示,运动锻炼可能通过调节脑内炎症反应,降低IDO含量,维持中枢单胺类神经递5-HT的正常水平,从而改善雌激素缺乏所致的抑郁样行为。
![]()
表 1 两组小鼠体质量、子宫质量和血清E2浓度
Tab 1 Body weight,uterus weight and serum E2 in mice of Sham group and Ovx group
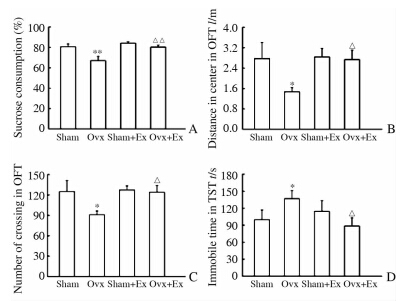
图 1 各组小鼠的行为学测试结果
Fig 1 Behavior test results of mice in each group
A:Sucrose consumption test; B,C: Open field test (OFT); D:Tail suspension test (TST). Ex: Exercise. P<0.05,* *P<0.01 vs Sham group; P<0.05,P<0.01 vs Ovx group. n=15,x±s
![]()
表 2 各组小鼠海马炎性细胞因子的表达
Tab 2 Production of inflammatory cytokines in hippocampus of mice in each group
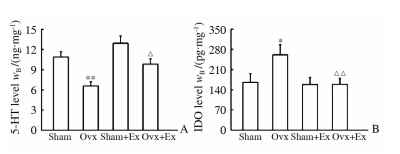
图 2 各组小鼠海马组织5-HT(A)和IDO(B)含量
Fig 2 Levels of 5-HT (A) and IDO (B) in hippocampus of mice in each group
Ex: Exercise; 5-HT: 5-Hydroxytryptamine; IDO: Indoleamine 2,3-dioxygenase.
P<0.05,* *P<0.01 vs Sham group; P<0.05,P<0.01 vs Ovx group. n=15,x±s
| [1] | Kessler R C, McGonagle K A, Swartz M, Blazer D G, Nelson C B.Sex and depression in the National Comorbidity Survey. Ⅰ: Lifetime prevalence, chronicity and recurrence[J].J Affect Disord,1993,29(2-3):85-96. |
| [2] | Gambarana C, Ghiglieri O, Tagliamonte A, D'Alessandro N, de Montis M G.Crucial role of D1 dopamine receptors in mediating the antidepressant effect of imipramine[J].Pharmacol Biochem Behav,1995,50:147-151. |
| [3] | Levine J, Barak Y, Chengappa K N, Rapoport A, Rebey M, Barak V.Cerebrospinal cytokine levels in patients with acute depression[J].Neuropsychobiology,1999,40:171-176. |
| [4] | Kumar B, Kuhad A, Chopra K.Neuropsychopharmacological effect of sesamol in unpredictable chronic mild stress model of depression: behavioral and biochemical evidences[J].Psychopharmacology (Berl),2011,214:819-828. |
| [5] | de Medeiros A R, Lamas A Z, Caliman I F, Dalpiaz P L, Firmes L B, de Abreu G R, et al.Tibolone has anti-inflammatory effects in estrogen-deficient female rats on the natriuretic peptide system and TNF-alpha[J].Regul Pept,2012,179(1-3):55-60. |
| [6] | Davey D A.HRT: some unresolved clinical issues in breast cancer, endometrial cancer and premature ovarian insufficiency[J].Womens Health (Lond Engl),2013,9:59-67. |
| [7] | Golbidi S, Mesdaghinia A, Laher I.Exercise in the metabolic syndrome[J].Oxid Med Cell Longev,2012:349710. |
| [8] | Fragala M S, Kraemer W J, Denegar C R, Maresh C M, Mastro A M, Volek J S.Neuroendocrine-immune interactions and responses to exercise[J].Sports Med, 2011,41:621-639. |
| [9] | Rimer J, Dwan K, Lawlor D A, Greig C A, McMurdo M, Morley W, et al.Exercise for depression[J].Cochrane Database Syst Rev,2012,7:CD004366. |
| [10] | Liu W, Xu Y, Lu J, Zhang Y, Sheng H, Ni X.Swimming exercise ameliorates depression-like behaviors induced by prenatal exposure to glucocorticoids in rats[J].Neurosci Lett,2012,524:119-123. |
| [11] | Liu W, Sheng H, Xu Y, Liu Y, Lu J, Ni X.Swimming exercise ameliorates depression-like behavior in chronically stressed rats: relevant to proinflammatory cytokines and IDO activation[J].Behav Brain Res,2013,242:110-116. |
| [12] | Jiang P, Dang R L, Li H D, Zhang L H, Zhu W Y, Xue Y, et al.The impacts of swimming exercise on hippocampal expression of neurotrophic factors in rats exposed to chronic unpredictable mild stress[J].Evid Based Complement Alternat Med,2014:729827. |
| [13] | Borrow A P, Cameron N M.Estrogenic mediation of serotonergic and neurotrophic systems: implications for female mood disorders[J].Prog Neuropsychopharmacol Biol Psychiatry,2014,54:13-25. |
| [14] | Masson G S, Costa T S, Yshii L, Fernandes D C, Soares P P, Laurindo F R, et al.Time-dependent effects of training on cardiovascular control in spontaneously hypertensive rats: role for brain oxidative stress and inflammation and baroreflex sensitivity[J].PLoS One,2014,9:e94927. |
| [15] | Catena-Dell'Osso M, Bellantuono C, Consoli G, Baroni S, Rotella F, Marazziti D.Inflammatory and neurodegenerative pathways in depression: a new avenue for antidepressant development?[J].Curr Med Chem, 2011,18:245-255. |
| [16] | Maj J, Rogóz Z.Pharmacological effects of venlafaxine, a new antidepressant, given repeatedly, on the alpha 1-adrenergic, dopamine and serotonin systems[J].J Neural Transm,1999,106:197-211. |
| [17] | O'Connor J C, Lawson M A, André C, Moreau M, Lestage J, Castanon N, et al.Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice[J].Mol Psychiatry,2009,14:511-522. |
| [18] | Maes M, Leonard B E, Myint A M, Kubera M, Verkerk R.The new '5-HT' hypothesis of depression: cell-mediated immune activation induces indoleamine 2,3-dioxygenase, which leads to lower plasma tryptophan and an increased synthesis of detrimental tryptophan catabolites (TRYCATs), both of which contribute to the onset of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35:702-721. |
| [19] | Sublette M E, Postolache T T.Neuroinflammation and depression: the role of indoleamine 2,3-dioxygenase (IDO) as a molecular pathway[J].Psychosom Med,2012,74:668-672. |
 2015, Vol. 36
2015, Vol. 36


