2. 上海交通大学医学院附属第三人民医院麻醉科, 上海 201999
2. Department of Anesthesiology, the 3rd People's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 201999, China
脓毒症是严重感染导致的全身炎症反应综合征。急性肺损伤是脓毒症最常见的并发症之一[1]。肺微血管内皮细胞(PMVEC)损伤引起的肺通透性增高在脓毒症急性肺损伤的发生发展中起着关键作用[2, 3]。热休克蛋白A12B(HSPA12B)是热休克蛋白HSP70超家族中的一员,主要表达于血管内皮细胞,与血管的生成和稳定有关[4]。研究表明,HSPA12B对脂多糖(LPS)诱导的小鼠PMVEC具有一定保护作用(可抑制内皮细胞的炎症反应)[5]。探讨HSPA12B对血管内皮通透性的直接影响,对临床脓毒症急性肺损伤的研究更具价值。本研究拟通过体外实验,构建高表达HSPA12B的人脐静脉内皮细胞(HUVEC),检测该细胞经LPS诱导后的跨内皮电阻抗 (TEER)和血管内皮钙黏素(VE-cadherin)的表达,探讨HSPA12B对血管内皮通透性的影响。 1 材料和方法 1.1 细胞培养与主要试剂
HUVEC由第二军医大学长海医院中心实验室保存。 HUVEC用DMEM高糖培养基(含10% FBS、1‰青/链霉素双抗)培养于37℃、5% CO2培养箱中,根据细胞生长状态进行传代。DMEM培养基和10%胎牛血清购自Gibco公司;LPS、PrimeSTAR酶购自Sigma公司;脂质体Lipofectamine2000购自Invitrogen公司;TRIzol、Rever Tra Ace qPCR RT Kit(FSQ-101)均购自ToYoBo公司;HSPA12B抗体购自Santa Cruz公司;Actin抗体、RIPA Buffer购自Cell Signaling Technology公司;VE-cadherin流式抗体购自BD公司;其他相关试剂购自生工生物工程(上海)股份有限公司。 1.2 HSPA12B高表达质粒的构建
从GenBank中查询目的基因HSPA12B及其上、下游的序列,用VectorNTI软件进行引物设计。扩增目的基因所用的上、下游引物序列分别为5′-GAACCGTCAGAT- CCGCTAGCGCCACCATGTTGGCTGTCCCGGAG-3′ 和5′-ATTCGAAGCTTGAGCTCGAGGTTGGA-AAGAAAGTCGATGGA-3′。使用高保真的PrimeSTAR酶扩增目的基因,目的基因PCR扩增成功后,进行琼脂糖凝胶电泳检测,把目的基因条带从琼脂糖凝胶电泳后的胶中割下来,并做胶回收(按胶回收试剂盒说明进行)。用限制性内切酶Nhe Ⅰ-HF和XhoⅠ对表达载体及目的基因片段进行双酶切,酶切产物进行琼脂糖凝胶电泳,回收目的基因。将酶切后的目的基因与表达载体进行同源重组,然后转化E.coli DH5α感受态细胞。用PCR筛选阳性克隆。经测序鉴定无误后进行质粒抽提,用于后续实验。 1.3 HSPA12B高表达HUVEC细胞的获得及LPS处理方法
将HSPA12B高表达质粒转染至HUVEC。具体步骤如下:转染前1 d将HUVEC接种到6孔板,待细胞达到70%~80%融合度时,采用Lipofectamine2000将每孔2 μg的HSPA12B高表达质粒及阴性质粒瞬时转染入HUVEC细胞。转染后6~8 h更换完全培养基,于37℃、5% CO2培养箱中培养,36 h后加入终浓度为1 μg/mL的LPS。 1.4 HSPA12B mRNA表达的检测
细胞进行处理后,用TRIzol试剂充分裂解细胞,进一步提取细胞总RNA,采用 Rever Tra Ace qPCR RT Kit 将1 μg总RNA在37℃ 30 min、98℃ 5 min的条件下反转录成cDNA,再以cDNA为模板,用半定量PCR法检测HSPA12B的mRNA表达水平。反应体系:10×PCR Buffer 2 μL,2.5 mmol/L dNTP、25 mmol/L MgCl2各1.2 μL,10 μmol/L上、下游引物各1 μL,cDNA 1 μL,Taq酶0.25 μL,补充ddH2O至总反应体系20 μL。反应条件:94℃ 3 min;94℃ 30 s,58℃ 45 s,72℃ 20 s,共28个循环;72℃ 7 min。扩增HSPA12B所用的上、下游引物序列分别为5′-CCTTCATTGACTTCTACCGC-3′和5′-GGCTTCACAAGACATTCGG-3′,扩增内参GAPDH所用上、下游引物序列分别为5′-GAAATCCCATCACCATCTTC-3′和5′-CTTGAGGCTGTTGTCATACTTC-3′。扩增产物进行1.5%琼脂糖凝胶电泳。 1.5 HSPA12B蛋白表达的检测
细胞处理后,用含蛋白酶抑制剂的RIPA蛋白裂解液裂解细胞,提取总蛋白。采用Pierce蛋白定量试剂盒BCA法测定每个蛋白样本的总蛋白浓度。每个样本上等量总蛋白进行SDS-PAGE分离目的蛋白,再用湿转法将蛋白转移至PVDF膜,以5%脱脂牛奶封闭,用鼠抗HSPA12B抗体(1∶100)和兔抗鼠的二抗(1∶2 000)孵育,ECL显色曝光。 1.6 TEER的检测
实验分为4组:空白组(未进行任何处理),LPS(1 μg/mL)诱导组,LPS(1 μg/mL)+HSPA12B高表达组(转染pIRES2-EGFP-HSPA12B-3Flag质粒)和LPS(1 μg/mL)+空质粒对照组(转染pIRES2-EGFP-3Flag)。细胞以1×105接种于Transwell的0.4 μm孔径的培养皿,用只加入相同培养基而不接种细胞的样品作为空白对照。待相应处理后,使用MERSST×01 Electrode (美国Millipore) 检测HUVEC细胞的TEER值[6]。 1.7 VE-cadherin表达的检测
实验分为3组:空白组,LPS(1 μg/mL)+HSPA12B高表达组和LPS(1 μg/mL)+空质粒对照组。细胞进行相应处理后,用胰酶将细胞消化,离心收集细胞,用1×PBS洗涤1次,再用1×PBS重悬细胞,按说明书加入流式抗体避光反应30 min,离心弃上清,加入1×PBS,上机前震荡均匀,使用流式细胞仪(BD Calibur)检测细胞VE-cadherin表达,通过计量抗体-荧光染料的平均荧光强度来反映其表达量。 1.8 统计学处理
相同实验进行3次生物学重复。采用GraphPad Prism5软件进行数据统计学处理与分析。计量数据以x±s表示,多组间比较用ANOVA方差分析。检验水准(α)为0.05。 2 结 果 2.1 LPS诱导后HUVEC中HSPA12B的表达
用1 μg/mL LPS分别处理HUVEC细胞0、3、6、9、12和24 h后,用RT-PCR和蛋白质印迹法检测HSPA12B在mRNA和蛋白质水平的表达。结果显示:HSPA12B在0~12 h内表达上调,12 h达到高峰(图 1)。
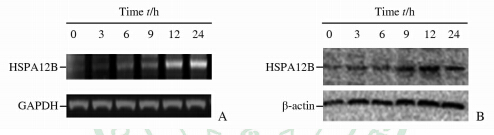 | 图 1 LPS(1 μg/mL)诱导后HUVECs中HSPA12B在不同时间点的表达 Fig 1 Expression changes of HSPA12B in HUVECs exposed to 1 μg/mL LPS at various time points A: RT-PCR; B: Western blotting analysis. LPS: Lipopolysaccharide; HUVEC: Human umbilical vein endothelial cell |
蛋白质印迹结果显示,HSPA12B高表达质粒pIRES2-EGFP-HSPA12B-3Flag构建成功,能够使HUVEC高表达HSPA12B(图 2)。TEER值检测结果显示:空白组、LPS组、LPS+HSPA12B高表达组、LPS+空质粒对照组的TEER值分别为(36±2)、(25±1)、(45±2)、(28±1)Ω,说明HSPA12B能使HUVEC的TEER值升高(P<0.001),并能完全对抗LPS诱导造成的TEER值的下降(P<0.001)。
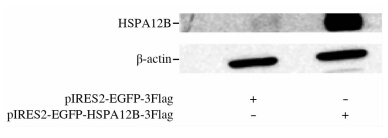 | 图 2 HSPA12B高表达质粒在HUVECs中的表达(蛋白质印迹分析) Fig 2 Verification of pIRES2-EGFP-HSPA12B-3Flag expression in HUVECs (Western blotting analysis) HUVEC: Human umbilical vein endothelial cell |
分别处理12 h后,空白组、LPS+HSPA12B高表达组和LPS+空质粒对照组中HUVEC细胞表面VE-cadherin的阳性百分比分别为(2.48±0.38)%、(4.53±0.89)%、(1.47±0.28)%(图 3)。LPS+HSPA12B高表达组的VE-cadherin表达水平较LPS+空质粒对照组高,差异有统计学意义(P<0.001)。
 | 图 3 HSPA12B对LPS诱导的HUVEC细胞表面VE-cadherin表达的影响 Fig 3 Effects of HSPA12B on VE-cadherin expression in HUVECs exposed to LPS A: Isotype; B: Control; C: LPS+pIRES2-EGFP-3Flag; D: LPS+pIRES2-EGFP-HSPA12B-3Flag. LPS: Lipopolysaccharide; HUVEC: Human umbilical vein endothelial cell |
重症感染、烧伤、创伤等导致的脓毒症,仍然是ICU患者的主要死亡原因[7]。尽管目前现代医学已取得长足的进步,但脓毒症发病率仍不断攀升,其死亡率居高不下。急性肺损伤是脓毒症最常见的并发症之一,迄今为止还没有一种基于其病理生理机制的治疗能够降低肺损伤程度或者改善患者的临床症状。其主要病理特征为肺微血管通透性增高,肺泡渗出富含蛋白质的液体,进而导致肺水肿及透明膜形成,可伴有肺间质纤维化[8]。血管内皮细胞屏障功能的完整性在脓毒症急性肺损伤的发生、发展中起着重要作用,因此寻找在脓毒症时能保护内皮细胞的屏障功能的分子显得至关重要。
近年来,在脓毒症内皮细胞损伤研究中,热休克蛋白HSPA12B逐渐受到关注[9]。HSPA12B主要表达在内皮细胞中,与血管的生成和稳定有关,帮助血管内皮细胞抵御多种有害因素的侵犯[4]。因此,HSPA12B可能参与了内皮细胞屏障功能的维持。本研究结果显示,LPS处理HUVEC后HSPA12B的表达在12 h时达到高峰,提示HSPA12B可能与脓毒症内皮细胞功能的改变相关。
TEER值的检测目前被广泛应用于内皮细胞通透性的评价当中[10]。TEER值升高说明内皮细胞跨膜电阻增加,通透性降低;反之,则说明内皮细胞跨膜电阻降低,通透性升高。本研究结果显示,HSPA12B过表达质粒转染入HUVEC后,能明显升高LPS处理后HUVEC的TEER值,降低其通透性,提示HSPA12B在脓毒症时起到了保护内皮细胞屏障功能的作用。
内皮细胞间的连接主要包括黏附连接和紧密连接,其中VE-cadherin是细胞间黏附连接的最主要成分,在维持血管内皮完整性方面起着关键作用[11]。在胚胎期,VE-cadherin参与了血管系统的生成与稳定;成年期,则调控着血管的通透性[12]。研究表明,如果黏附连接蛋白VE-cadherin表达水平降低或发生降解,抑或调控其黏附连接结构形成及稳定性的因素减弱或消失,都将导致内皮屏障功能障碍[13]。因此,VE-cadherin被认为在血管内皮细胞的通透性中起着决定性的作用[11]。本研究结果显示,HSPA12B能使LPS处理的HUVEC细胞表面的VE-cadherin明显升高,提示HSPA12B可能通过上调VE-cadherin的表达,从而起到保护内皮细胞屏障功能的作用。
血管内皮通透性屏障功能障碍是脓毒症发病机制的关键环节,尤其是脓毒症急性肺损伤发生发展的中心环节。而目前对于脓毒症及其并发症急性肺损伤的治疗仍局限于抗感染、液体保守治疗及保护性肺通气等措施,还没有针对内皮屏障功能障碍这一病理生理机制以便有效减轻患者的肺损伤程度、改善其病情的治疗措施[8, 14]。因此,保护肺内皮屏障的完整性可能成为治疗急性肺损伤新的研究方向。结合我们的实验,HSAP12B可能从病理生理机制方面为临床治疗脓毒症及急性肺损伤提供新的潜在靶点。
| [1] | Sadowitz B, Roy S, Gatto L A, Habashi N, Nieman G. Lung injury induced by sepsis: lessons learned from large animal models and future directions for treatment [J]. Expert Rev Anti Infect Ther, 2011, 9: 1169-1178. |
| [2] | Matthay M A, Zemans R L.The acute respiratory distress syndrome: pathogenesis and treatment [J]. Annu Rev Pathol, 2011, 6: 147-163. |
| [3] | Ait-Oufella H, Maury E, Lehoux S, Guidet B, Offenstadt G.The endothelium: physiological functions and role in microcirculatory failure during severe sepsis [J]. Intensive Care Med,2010, 36: 1286-1298. |
| [4] | Steagall R J, Rusiñol A E, Truong Q A, Han Z. HSPA12B is predominantly expressed in endothelial cells and required for angiogenesis [J]. Arterioscler Thromb Vasc Biol, 2006, 26:2012-2018. |
| [5] | 余桂芳,张 旭,朱科明. 热休克蛋白A12B对脂多糖诱导肺微血管内皮细胞损伤的影响[J]. 上海交通大学学报:医学版,2014,34:1022-1026. |
| [6] | Wang L, Luo H, Chen X, Jiang Y, Huang Q. Functional characterization of S100A8 and S100A9 in altering monolayer permeability of human umbilical endothelial cells [J]. PLoS One, 2014, 9:e90472. |
| [7] | Stearns-Kurosawa D J, Osuchowski M F, Valentine C, Kurosawa S, Remick D G. The pathogenesis of sepsis [J]. Annu Rev Pathol, 2011, 6:19-48. |
| [8] | Herold S, Gabrielli N M, Vadász I. Novel concepts of acute lung injury and alveolar-capillary barrier dysfunction [J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305:L665-L681. |
| [9] | Zouein F A, Kurdi M, Booz G W. HSPA12B and repairing the heart: beauty in simplicity [J]. Cardiovasc Res, 2013, 99:587-589. |
| [10] | Miao Y S, Zhao Y Y, Zhao L N, Wang P, Liu Y H, Ma J, et al. MiR-18a increased the permeability of BTB via RUNX1 mediated down-regulation of ZO-1, occludin and claudin-5 [J]. Cell Signal, 2014, 27:156-167. |
| [11] | Gulino-Debrac D. Mechanotransduction at the basis of endothelial barrier function [J]. Tissue Barriers, 2013, 1:e24180. |
| [12] | Giannotta M, Trani M, Dejana E. VE-cadherin and endothelial adherens junctions: active guardians of vascular integrity [J]. Dev Cell, 2013, 26:441-454. |
| [13] | Bhattacharya J, Matthay M A. Regulation and repair of the alveolar-capillary barrier in acute lung injury [J]. Annu Rev Physiol, 2013, 75:593-615. |
| [14] | Gill S E, Taneja R, Rohan M, Wang L, Mehta S. Pulmonary microvascular albumin leak is associated with endothelial cell death in murine sepsis-induced lung injury in vivo [J]. PLoS One, 2014, 9: e88501. |
 2015, Vol. 36
2015, Vol. 36


