2. 上海医药工业研究院分析测试中心, 上海 200437
2. Instrumental Analysis & Research Center, Shanghai Institute of Pharmaceutical Industry, Shanghai 200437, China
黄芩素(baicalein,Ba)又称黄芩苷元、黄芩黄素,是从黄芩中提取的一类黄酮类化合物,具有抗菌消炎、保肝利胆、抗病毒、抗肿瘤、抗过敏、抗氧化等多种药理作用[1, 2, 3, 4]。目前,市售黄芩片需要每次1~2片,每日3~4次,患者的顺应性较差。研究表明,Ba在胃和小肠中吸收良好,在结肠亦有吸收[5],提示Ba具有广泛的吸收窗,适合制备成缓控释制剂。渗透泵型控释制剂作为缓控释制剂的典型代表,以零级特征缓慢释放药物,而且药物释放几乎不受胃肠道内容物、pH值等可变因素的影响,是口服缓控释制剂中最为理想的一种。本研究以Ba为模型药,采用环糊精包合技术提高其溶解度,进而制备成单层渗透泵型控释片,简化难溶性药物渗透泵片的制备工艺,以期为难溶性药物单层渗透泵型控释制剂的研究提供有价值的参考。 1 仪器和试药 1.1 仪器
U3000型高效液相色谱仪(戴安中国有限公司);TDP型单冲压片机(上海第一制药机械厂);BY-300A型小型包衣锅(上海黄海药检仪器厂);ZRS-8型智能溶出试验仪(天津大学无线电厂);BDY-100B型恒温摇床(上海百典仪器有限公司);BP-210D型电子天平(赛多利斯科学仪器有限公司);RE-5298A型旋转蒸发仪(上海雅荣生化设备仪器有限公司);HWS-12型智能水浴锅(上海一恒科技有限公司);DZF型真空干燥箱(北京中科环试仪器有限公司)。 1.2 试剂
Ba(实验室自制,纯度为98.6%);聚乙二醇 400(polyethylene glycol 400,PEG 400,国药集团化学试剂有限公司);二甲基-β-环糊精(DM-β-CD,山东滨州智源生物科技有限公司);氯化钠(河北华晨药业有限公司);聚氧乙烯(polyethylene oxide,PEO,WSR N-750,美国Dow公司);醋酸纤维素(CA,结合酸:54.5%~56.0%,国药集团化学试剂有限公司);硬脂酸镁(辽宁奥达制药有限公司);乙腈、甲醇为色谱纯;其余试剂均为分析纯。 2 方法和结果 2.1 Ba包合物的制备[6]
称取Ba 1g,用乙醇溶解;另称取5 g DM-β-CD,用水溶解。将Ba的乙醇溶液缓慢加入到DM-β-CD水溶液中,在45℃条件下超声6 h。旋转蒸发除去乙醇。然后加入蒸馏水,溶解后冰浴降温,过滤除去未被包合的Ba。冷冻、干燥得到Ba包合物。 2.2 包合物溶出曲线和溶解度的测定 2.2.1 含量测定方法
色谱条件:色谱柱为Waters C18 (250 mm×4.6 mm,5 μm);流动相为甲醇∶0.05%磷酸=65∶35;检测波长为274 nm;柱温为25℃;流速为1 mL/min,进样量为10 μL。
制备标准曲线:精密称取Ba 10 mg,加入到100 mL容量瓶中,溶解后用流动相定容。取适量分别配制浓度为0.1、0.5、1、2、10、20 μg/mL的溶液。以浓度(C,μg/mL)对峰面积(A)进行线性回归,得回归方程C=10.238 1 A+0.190 3 (r=0.999 9)。分别取0.1、1和20 μg/mL的高、中、低浓度对照品溶液,加入到空白辅料中,进行回收率实验。高、中、低浓度的平均方法回收率分别为99.17%、101.79%和98.38%,RSD分别为0.93%、1.64%和3.02%;日内精密度RSD为1.07%、0.61%、0.83%;日间精密度RSD为1.64%、1.72%、1.88%。符合含量测定要求。 2.2.2 溶出曲线的测定
分别称取10 mg Ba、含等量Ba的物理混合物和Ba包合物,分别置于透析袋中。以含1% SDS 的900 mL水为溶出介质进行溶解,转速100 r/min,温度为(37±1)℃,分别于0、5、10、20、30、60 min各取5 mL,同时补加同温度、同体积的溶出介质。样品液经0.45 μm微孔滤膜过滤,取续滤液适当稀释后,测定峰面积并绘制溶出曲线。结果(图 1)表明Ba包合物在10 min时几乎全部溶出,而Ba的累积溶出度在60 min时仅为21.22%。
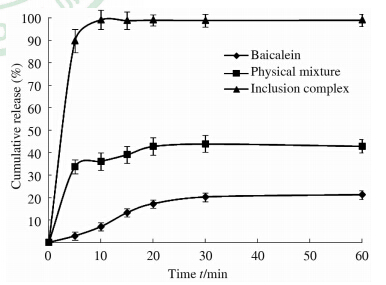 | 图 1 黄芩素、物理混合物及包合物的溶出曲线 Fig 1 Dissolution curves of baicalein and its physical mixture and inclusion complex 37℃. n=3,x±s |
取过80目筛的Ba包合物180 mg,加入PEO,渗透活性物质及其他辅料并混合均匀。以95%乙醇溶液为粘合剂,制软材,过20目筛制粒,室温干燥,20目整粒,加入1%硬脂酸镁作为润滑剂,压制渗透泵片片芯(每片含Ba 30 mg),片芯硬度为45~70 N。
以醋酸纤维素、PEG 400、丙酮-无水乙醇(95∶5) 配制成包衣液,包衣温度为40~50℃,转速为30 r/min,室温固化,于40℃真空干燥箱中放置12 h以除去残留有机溶剂,两面打孔(直径为0.5 mm)。 2.4 体外释放曲线的测定
取渗透泵片,依照《中国药典》2010年版二部附录ⅩD第一法,以1%SDS水溶液900 mL为溶出介质,转速100 r/min,温度(37±0.5)℃,于0、1、2、4、6、8、10、12 h各取5 mL,并同时补同温度、同体积的溶出介质,样品经0.45 μm微孔滤膜过滤,取续滤液,进样10 μL,测定浓度并计算渗透泵片在不同时间的累积释放量,并绘制释放曲线。 2.5 各因素对释药行为的影响
通过预实验发现,Ba包合物单层渗透泵片的释药过程主要受NaCl用量、PEO用量、包衣增重和增塑剂用量等因素的影响。本研究在单因素考察的基础上,采用正交试验设计优化出最佳处方。 2.5.1 氯化钠用量对释药行为的影响
保持其他辅料用量不变,分别考察氯化钠用量为80、100和120 mg时对释药行为的影响,结果见图 2A。由结果可知,氯化钠用量对释药行为有较大影响,用量为80 mg时,释药速率及累计释放度均较低。用量为120 mg时,前期释药速率较快,但累计释放度并不高。当氯化钠用量为100 mg时,释药速率适中,且累积释放度较高。
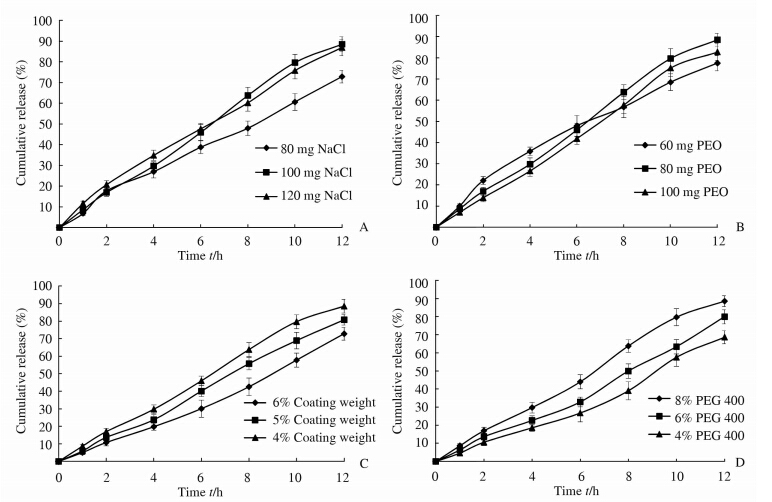 | 图 2 NaCl用量(A)、PEO用量(B)、包衣增重(C)和增塑剂用量(D)对黄芩素单层渗透泵片释药的影响 Fig 2 Effects of NaCl (A) and PEO (B) contents,coating weight (C) and plasticizer content (D) on drug release from monolithic osmotic tablet containing inclusion complex of baicalein PEO: Polyethylene oxide; PEG: Polyethylene glycol. n=3,x±s |
保持其他辅料用量不变,分别考察PEO用量为60 mg、80 mg和100 mg时对释药行为的影响。结果见图 2B。由结果可知,PEO用量为60 mg时,由于片芯环境黏度较低,前期释药较快,但同时由于助悬能力不够,累积释放度较低。PEO用量为100 mg时,片芯环境的黏度也较高,导致药物释放速率下降。当用量为80 mg时,释药较为平稳,累积释放度较为理想。 2.5.3 包衣增重对释药行为的影响
保持其他辅料用量不变,分别考察包衣增重为4%、5%和6%时对释药行为的影响。结果见图 2C。不同包衣增重对累积释放度有较大影响。随着包衣增重增加,Ba的释药速率及累积释放度逐渐下降。由结果可知,当包衣增重为4%时累积释放度较为理想。 2.5.4 增塑剂用量对释药行为的影响
以PEG 400作为包衣膜的增塑剂,在保持其他辅料不变的情况下,考察不同增塑剂用量(4%、6%、8%)对释药行为的影响,结果见图 2D。结果表明,随着包衣膜中PEG 400用量的增加释药速率明显加快。这与包衣膜亲水性能增加和PEG 的致孔作用有关。 2.6 正交试验优化处方 由单因素考察的结果可知,渗透泵控释片中NaCl用量、PEO用量、包衣增重和增塑剂用量为其主要影响因素。根据以上4个因素,选择3水平进行试验,按L9(34)正交表进行处方优化。以0、1、2、4、6、8、10、12 h的释放度和时间-释放度线性回归所得直线的相关系数r为评价指标,采用加权评分法将上述4个评价指标转化为单一指标进行考察。考察渗透泵控释片在2 h的释放度(L1)有无时滞现象、6 h的累积释放度(L2)、12 h(L3)是否释放完全(以上3个指标权重系数均为1),r(L4)考察药物是否以零级释放(本指标权重系数为2)。按以下公式计算:
L=|L1-17%|×100×1+|L2-50%|×100× 1+|L3-95%|×100×1+|L4-1|×100×2,L越小表示释药效果越理想。
正交试验因素-水平设计、结果及方差分析分别见表 1~3。
|
|
表 1 因素-水平设计表 Tab 1 Factor-level design table |
|
|
表 2 正交试验结果 Tab 2 Results of orthogonal test |
|
|
表 3 方差分析结果 Tab 3 Results of variance analysis |
通过直观分析和方差分析可知,PEO用量和增塑剂PGE 400用量对释药行为有显著影响,但各因素对释药行为影响的主次关系为B>D>C>A。按K值最小项,得渗透泵片的最佳处方为A2B2C1D2。优化后的处方为Ba包合物180 mg,NaCl用量为100 mg,PEO用量为80 mg,加入1%的硬脂酸镁,包衣增重4%,增塑剂用量为9%。 2.7 Ba包合物渗透泵片工艺验证 按照优化后的处方制备Ba包合物渗透泵片3批,测定各批次体外释放曲线,考察批间工艺重现性,结果见图 3。结果表明,各批间重现性良好。经计算,3批渗透泵片的L值为20.12~22.82,表明优化后的渗透泵片释药行为较为理想。
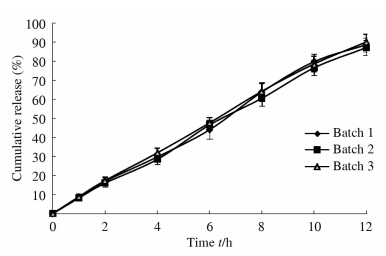 | 图 3 三批渗透泵片释药曲线 Fig 3 Drug release profiles of three lots of osmotic pump tablets n=6,x±s |
将优化后处方的释药曲线,以各取样时间点的实测数据,用常用的释药模型以累积释放度对时间进行拟合,求出符合该释药曲线的方程,并用r判断拟合程度,r越接近1则表示拟合程度愈高。结果显示,零级释放模型的拟合方程为:Y=7.573 7 t+0.692 7,r=0.997 8;一级释放模型 的拟合方程为:ln(100-Y)=-0.173 5 t+4.790 3,r=0.969 7; Higuchi释放模型的拟合方程为:Y=27.079 4 t1/2-13.835 6,r=0.954 3。结果表明,药物释放最接近零级释放,然后依次是一级释放模型和Higuchi释放模型。 3 讨 论
易溶性药物制备成单层渗透泵研究比较成熟。对难溶性药物来说,应从改善其溶解度和(或)提高片芯环境的渗透压着重研究。本研究以难溶性药物Ba为模型药,从改善其溶解度和提高渗透压方面对片芯进行了处方研究,同时考虑包衣膜控制释药速率的作用,最终成功制备了体外释药行为较为理想的Ba包合物单层渗透泵片。
环糊精及其衍生物对Ba的包合作用存在较大差别,可能是因为不同的环糊精及其衍生物空腔内径不同。据报道,采用DM-β-CD作为载体材料时,制备的Ba包合物具有较高的包封率及载药量[6],因此本研究采用DM-β-CD作为载体材料制备Ba包合物。包合物中Ba溶出速率和溶解度得到明显改善,为将Ba进一步制备成单层渗透泵片奠定了基础。
本研究的渗透泵控释片以NaCl为渗透活性物质,PEO作为助悬剂,但两者的比例关系对释药行为有重要影响[7, 8, 9, 10]。两者是协同关系,但也相互牵制:渗透活性剂可增加片芯的渗透压,提供释药动力,而助悬剂PEO除了提供一定的渗透压、溶胀压外还具有助悬作用,阻止药物沉降在片芯底部,两者共同促进了药物顺利释放,因而是协同关系。 在片芯质量一定的情况下,渗透活性剂比例过高则限制了助悬剂PEO的用量,因片芯混悬液黏度不够,药物容易沉积于片芯内,导致累积释放度达不到要求。而当助悬剂PEO比例较高时则限制了渗透活性剂的用量,由于形成的混悬液黏度较大,且释药动力不足,导致释药速率下降,达不到理想的释药效果,因而两者又是相互牵制关系。通过实验研究,最终确定渗透活性物质NaCl与助悬剂PEO的用量比例为5∶4。
优化后处方的体外释药曲线线性相关性较好,释药速率符合零级方程,达到了实验设计目的。尽管体外释药较为理想,该处方是否合理还需结合体内实验来进一步确定。
| [1] | 彭 蕾,顾振纶,薛仁宇,狄建彬,丁 爽,郭次仪.黄芩素对大鼠高脂血症性脂肪肝的防治作用研究[J].中成药,2011,33:414-418. |
| [2] | 毛 捷,徐善水,盛莉莉,王宣之.黄芩素的抗肿瘤作用及机制的研究进展[J].中国临床药理学与治疗学,2009,14:1178-1182. |
| [3] | 黄 杉,孙建英,曹颖瑛,姜远英.黄芩素对白念珠菌基因表达谱的影响[J].第二军医大学学报,2010,31:796-800. Huang S, Sun J Y, Cao Y Y, Jiang Y Y. Effects of baicalein on gene expression profile of Candida albicans[J].Acad J Sec Mil Med Univ,2010,31:796-800. |
| [4] | 辛文妤,宋俊科,何国荣,杜冠华.黄芩素和黄芩苷的药理作用及机制研究进展[J].中国新药杂志,2013,22:647-659. |
| [5] | 刘太明,蒋学华.黄芩苷和黄芩素大鼠在体胃、肠的吸收动力学研究[J].中国中药杂志,2006,31:999-1001. |
| [6] | Zhou Q, Wei X H, Dou W,Chou G X, Wang Z T. Preparation and characterization of inclusion complexes formed between baicalein and cyclodextrins[J]. Carbohydr Polym, 2013,95:733-739. |
| [7] | Liu X, Wang S, Chai L,Zhang D, Sun Y, Xu L, et al. A two-step strategy to design high bioavailable controlled-relese nimodipine tablets: the push-pull osmotic pump in combination with the micronization/solid dispersion techniques [J]. Int J Pharm, 2014, 461(1-2):529-539. |
| [8] | Chen H, Jiang G, Ding F. Monolithic osmotic tablet containing solid dispersion of 10-hydroxycamptothecin [J]. Drug Dev Ind Pharm, 2009, 35:131-137. |
| [9] | Abd-Elbary A, Tadros M I,Alaa-Eldin A A. Development and in vitro/in vivo evaluation of etodolac controlled porosity osmotic pump tablets [J]. AAPS PharmSciTech, 2011, 12:485-495. |
| [10] | Preethi N, Sujatha S. Development and evaluation of swellable elementary osmotic pump tablet of glipizide [J]. Int J Pharm Sci Drug Res, 2013, 5:146-151. |
 2015, Vol. 36
2015, Vol. 36


