2. 河北省保定市第一中心医院妇产科, 保定 071000
2. Department of Obstetrics and Gynecology, First Central Hospital of Baoding, Baoding 071000, Hebei, China
组织工程再生组织或器官是近年来的一个研究热点,而组织工程的一个核心问题是组织工程支架的模拟[1]。目前有很多技术可实现组织工程支架的制备,其中静电纺丝技术是简单、易于控制且经济的方法[2]。在组织工程支架制备的过程中要考虑到材料本身的降解及生物相容性问题,最为理想的材料应具备生物相容性好、降解速度与组织再生速度相吻合、降解产物对机体无不良影响等特点。近年来聚左旋乳酸(PLLA)、ε-聚己内酯(PCL)两种物质引人关注,两者都可降解,按适当比例组合可克服机械力学性能的不足,但PLLA的酸性降解产物可使周围pH值降低,导致局部炎症反应及潜在的组织恶化[3, 4]。由丝素蛋白(SF)制备的纳米纤维毡拥有较好的生物相容性[5],体外研究已证实可通过复合SF来提高周围环境的pH值[6]。本研究探讨SF对聚左旋乳酸-共-ε-己内酯P(LLA-CL)的降解及生物相容性的影响。 1 材料和方法 1.1 材料
家蚕蚕茧购于上海步克医药科技有限公司,P(LLA-CL) (50∶50)(Mw=34.5×104 g/mol)由日本奈良医科大学提供,六氟异丙醇(HFIP)购于日本大金工业公司。磷酸盐缓冲液(PBS)购于美国Sigma公司。 1.2 脱胶SF的制备 蚕茧在100℃ 0.5% (w/w) Na2CO3 溶液中脱胶30 min,共4次,然后用蒸馏水冲洗。脱胶的SF溶解于70℃ 的CaCl2/H2O/EtOH溶液 (摩尔比1∶8∶2)1 h。置于纤维素管膜(250-7 u,Sigma公司)室温下蒸馏水中渗析3 d,SF溶液过滤并冻干得到脱胶SF。 1.3 支架制备
SF/P(LLA-CL) (w∶w=25∶75) 及P(LLA-CL)(w∶w=50∶50)分别溶解在HFIP溶剂内,在室温下磁力棒持续搅拌8 h。10 mL带有钝性针头的注射器装入上述溶液并分别安装在注射器泵上(789100C,Cole-Pamer,美国)。用直径为6 cm的转筒作为接受器,针尖至转筒的距离为20 cm。针尖与转筒加一12 kV的直流电压(BGG6-358,BMEICO Ltd.,中国),溶液流速为1.2 mL/h,转筒转速为8.3 m/s(表面速度),纳米纤维被包裹在转筒的铝箔收集。整个过程保持相对湿度为30%。真空干燥炉烘干后纳米纤维支架从铝箔分离开来。为使SF的构象从无规则卷曲或α螺旋到β折叠转换,SF/P(LLA-CL)纳米纤维支架用乙醇熏蒸24 h,然后再次放入真空干燥炉24 h去除残留溶剂。 1.4 支架形貌观察
支架在真空中喷金后,用高分辨率电场发射扫描电子显微镜(FESEM,HITACHI S-4800,日本)观察其形貌特征,加速电压为10 kV。纤维直径用图像分析软件(ImageJ,National Institutes of Health,美国)分析,在FESEM纤维照片上随机选取100根纤维计算其平均值。 1.5 大鼠体内支架的植入
将支架用组织铳子切成直径为8 mm的圆形结构,通风柜干燥,60Co消毒包装备用。实验动物为6个月龄体质量在180 ~200 g的雄性SD大鼠[由第二军医大学实验动物中心提供,动物生产许可证号:SCXK(沪)2012-0003],共45只,随机分为5组(n=9)。所有操作经第二军医大学伦理委员会同意,遵照《实验动物关照与利用指导》。将SD大鼠用3%戊巴比妥钠(1 mL/100 g)注射麻醉,背部剃毛,无菌操作,椎旁1 cm对称切开一长为1 cm的纵行切口,钝性分离皮下组织形成“皮袋”,每只大鼠制作4个“皮袋”。4个支架包括2个SF/P(LLA-CL)和2个P(LLA-CL)随机植入每只大鼠不同部位,然后将皮肤用1-0无创缝线闭合,术后7 d拆除缝合线。45只大鼠共植入180个支架。 1.6 标本回收与处理
分别在支架植入1周、4周、2个月、3个月和6个月后,用戊巴比妥过量麻醉的方式处死大鼠。将植入支架连带周围部分组织取出,进行病理观察及免疫组化和PCR测试。观察支架横断面情况时,先将标本放入液氮15 min,然后用两把无齿镊“脆断”,再用FESEM观测。 1.7 病理和免疫组化染色
将不同时间点收集的标本用4%甲醛固定,不同梯度乙醇逐级脱水,石蜡包埋,切成厚度为4 μm的切片,H-E染色后进行病理评估。石蜡切片中巨噬细胞用CD68染色鉴定,异物巨细胞用抗酒石酸磷酸酶(TRAP)染色鉴定。CD68染色时,切片脱蜡后放入柠檬酸缓冲液(pH 6.0),于微波炉中进行抗原修复。 首先,切片加热从低火到中火再到沸点维持10 min,然后自然冷却并用PBS溶液 (0.1 mol/L,pH 7.4) 冲洗3次,每次5 min。切片用3% H2O2使内源性过氧化物酶失活,室温避光下孵育25 min,PBS(pH 7.4)冲洗3次。再放入5%牛血清白蛋白(1∶500,Sigma)预孵育过夜,PBS (0.1 mol/L)冲洗;加入大鼠抗小鼠CD68(1∶200,AbDSerotec公司)孵育,4℃过夜,PBS冲洗;室温下用二抗山羊-抗鼠IgG (1∶1 DAKO,Denmark)孵育50 min,PBS冲洗,用二氨基联苯胺(DAKO)染色。染色后切片复染3 min,蒸馏水冲洗,脱水并用中性树胶盖片。TRAP染色时,切片用2.5%戊二醛4℃固定7 min,蒸馏水冲洗。配制含 0.1 mol/L醋酸盐缓冲液18 mL、六偶氮副品红1 mL、 萘酚AS-BI磷酸酯20 mg、N-二甲基甲酰胺1 mL、酒石酸钾钠0.282 g的混合溶液,调pH值为5.0。切片在上述溶液37℃孵育50 min。双蒸水清洗1次,用苏木精复染细胞核,甘油明胶封片,显微镜下观察。 1.8 炎症因子基因表达的检测
参照文献[7],利用TRIzol Reagent (Qiagen,Netherlands)RNA从含有支架的组织提取RNA。对照组取自植入部位较远的皮下组织,进行定量PCR测定。评估IL-1β、TGF-β、TNF-α及IL-10基因表达情况,并以看家基因β-actin作参照[8] ,RT-PCR引物由Primer Premier 5.5软件设计,各引物序列见表 1。每个标本的相对表达量用2-ΔΔCt计算。Ct值定义为每个反应管内的荧光信号达设定的阈值时所经历的循环数。每个标本重复测量3次进行分析。
|
|
表 1 不同基因PCR引物序列 Tab 1 PCR primer sequences of different genes |
采用SPSS 21.0(IBM Corp,USA)统计软件进行方差分析,数据采用x±s 形式表示。检验水准(α)为0.05。 2 结 果 2.1 支架特征及表面形貌变化
如图 1所示,两种支架降解前的形貌均显示为均匀一致的纤维(图 1A、1D),P(LLA-CL)支架直径为(443±32)nm,SF/P(LLA-CL)支架直径为(386±54)nm。植入皮下1个月及3个月后,两种支架轻微肿胀,并有大量纤维组织长入(图 1B、1C、1E、1F)。
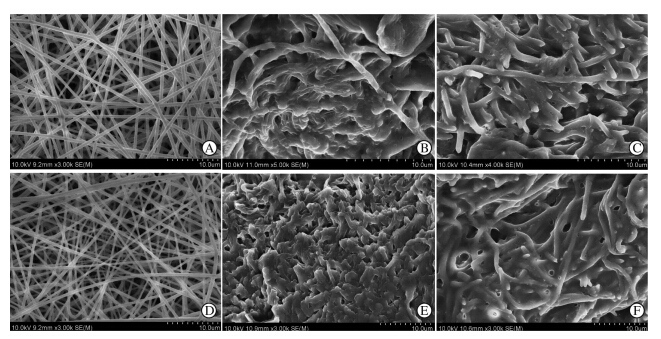 | 图 1 支架植入前后平面或断面扫描电镜图 Fig 1 Scanning electron microscopy (SEM) surface and cross-sectional images of scaffolds before and after implantation A-C: P(LLA-CL); D-F: SF/P(LLA-CL); A,D: Horizontal sections of scaffolds before implantation; B,E: Cross section of scaffolds 1 month after implantation; C,F: Cross section of scaffolds 3 months after implantation. P(LLA-CL): Poly(L-lactic-co-ε-caprolactone); SF/P(LLA-CL): Silk fibroin/poly(L-lactic-co-ε-caprolactone). Scale bars: 10.0 μm |
标本植入后隔天碘伏消毒,伤口表面无溃烂、红肿。分别于植入后1周、1个月、3个月及6个月时取出标本进行组织反应评估。由图 2可见,两种支架都能大体保持其结构,无明显感染迹象。
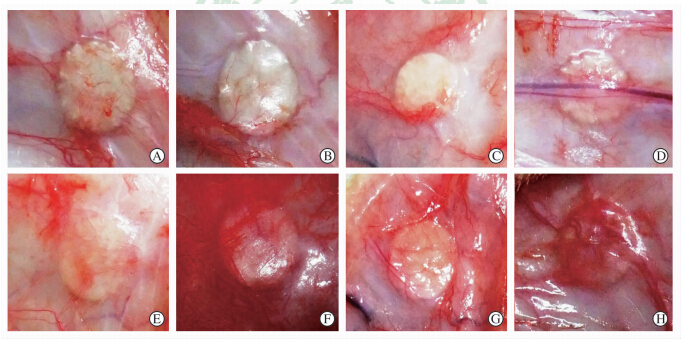 | 图 2 两种支架植入大鼠皮下各时间点标本大体观察 Fig 2 Scanning electron microscopy (SEM) surface and cross-sectional images of scaffolds before and after implantation A-D: P(LLA-CL); E-H: SF/P(LLA-CL); A,E:1-week after implantation;B,F:1 month after implantation;C,G:3 months after implantation;D,H:6 months after implantation. P(LLA-CL):Poly(L-lactic-co-ε-caprolactone);SF/P(LLA-CL):Silk fibroin/poly(L-lactic-co-ε-caprolactone) |
两种支架皮下植入1个月、3个月和6个月后的H-E染色结果显示,在支架界面可看到大量的多核细胞(图 3)。植入3个月后,P(LLA-CL)支架明显肿胀(图 3B),而SF/P(LLA-CL)只轻微肿胀(图 3E)。植入6个月后,P(LLA-CL)支架已支离破碎(图 3C),而SF/P(LLA-CL)支架大体保持其结构(图 3F)。
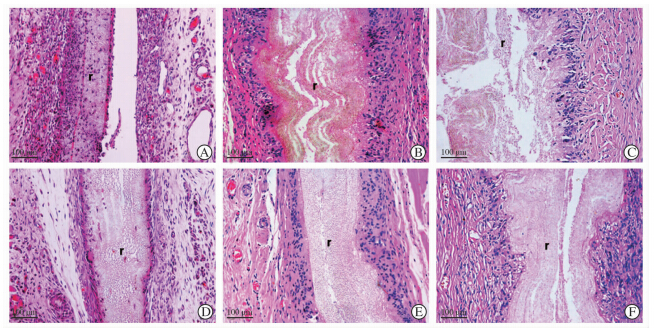 | 图 3 两种支架不同植入时间的降解观察(H-E染色) Fig 3 Degradation of two kinds of scaffolds after subcutaneous implantation at various time points(H-E staining) implantation A-C: P(LLA-CL); D-F: SF/P(LLA-CL); A,D: 1 month after implantation; B,E: 3 months after implantation; C,F: 6 months after implantation. P(LLA-CL):Poly (L-lactic-co-ε-caprolactone);SF/P(LLA-CL):Silk fibroin/poly (L-lactic-co-ε-caprolactone).The remnant scaffold is indicated as “r” |
两种支架在植入1个月(图 4A、4D)及3个月(图 4B、4E)后,在同一时间点P(LLA-CL)支架的CD68阳性表达多于SF/P(LLA-CL)支架。图 4C、4F显示TRAP阳性表达情况,可以看出在支架植入3个月后,P(LLA-CL)支架有较多的阳性表达。
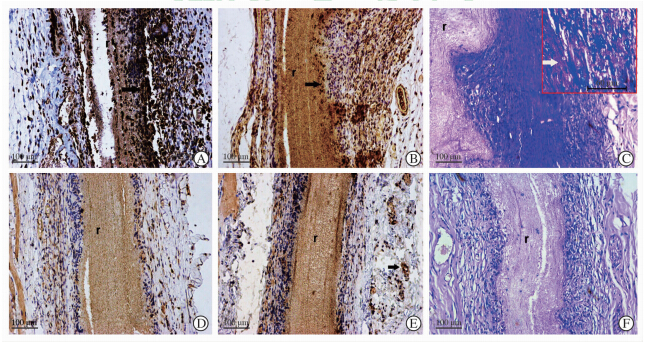 | 图 4 两种支架植入大鼠皮下后不同时间的免疫组化结果 Fig 4 Immunohistochemical findings of two kinds of scaffolds after subcutaneous implantation in rats at various time points A-C: P(LLA-CL); D-F: SF/P(LLA-CL); A,B,D and E were stained by CD68,and C and F were stained by TRAP. A and D were 1 month after implantation for both types of scaffolds,B,C,E and F are 3 months after implantation. Black arrows indicate CD68 positive cells and white arrow indicates TRAP positive cells. P(LLA-CL): Poly(L-lactic-co-ε-caprolactone); SF/P(LLA-CL): Silk fibroin/poly(L-lactic-co-ε-caprolactone). The remnant scaffold is indicated as “r” |
两种不同纳米纤维支架植入大鼠皮下,于植入后1周、1个月、2个月、3个月及6个月连带周围部分软组织取出,测定炎症基因IL-1β、IL-1β、TNF-α和IL-10的相对表达。由图 5可以看出,纳米纤维支架SF/P(LLA-CL)有较少的炎症基因表达。在两种支架植入1周时,SF/P(LLA-CL)支架组TNF-α 及 IL-10相对表达较少(P<0.05);在植入1个月时,SF/P(LLA-CL)支架组TNF-α、IL-1β及IL-10相对表达较少(P<0.05);在植入2个月时,SF/P(LLA-CL)支架组TNF-α、IL-10相对表达较少(P<0.05);在植入3个月时,SF/P(LLA-CL)支架组TGF-β相对表达较少(P<0.05);在植入6个月时,SF/P(LLA-CL)支架组IL-1β及TGF-β相对表达较少(P<0.05)。
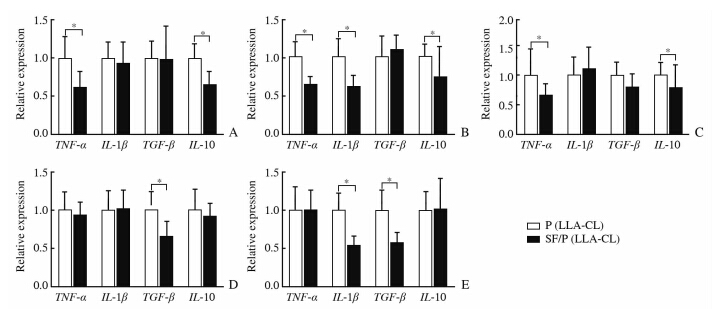 | 图 5 各时间点含有两种支架标本的炎症因子基因的相对表达 Fig 5 Inflammation factor gene expression in two kinds of scaffolds at various time points Inflammation gene expression of IL-1β,TGF-β,TNF-α,and IL-10 were measured 1 week after implantation (A),1 month after implantation(B),2 months after implantation (C),3 months after implantation (D),and 6 months after implantation (E). Data are expressed as 2-ΔΔCt. Values were normalized to β-actin. P<0.05. n=10,x±s |
理想的生物材料应具有生物相容性及可降解性,同时能为细胞或组织的生长提供一定的力学支持,利于组织修复[7]。目前可供选择的高分子材料可分为人工合成及天然材料,人工合成的高分子材料如聚乳酸等力学性能较好,但缺乏可供细胞识别的位点,且降解产物呈现酸性,不利于组织修复。而天然材料如SF一般具有较多的可供细胞识别的位点,但其力学性能较差,两种材料都不适合单独应用。为制备理想的组织工程支架,一般采用人工合成及天然材料组合制备组织工程支架。本研究结果显示,支架植入3个月时,P(LLA-CL)支架已分解,植入6个月时已支离破碎,而SF/P(LLA-CL)支架仍保持其大体结构。P(LLA-CL)为人工合成经典的组织工程支架材料来源,其降解产物呈酸性[6],这可能是P(LLA-CL)组织工程支架降解较快的原因。
组织工程支架的降解及生物相容性在支架对组织修复过程中起着至关重要的作用。一方面组织工程支架在完成其组织或器官修复功能后逐渐降解;另一方面组织工程支架应当具有生物相容性,即生物材料植入体内后行使预期的医学治疗作用,而不诱发局部或全身毒副作用,只在特定的情况下产生适当有益的细胞或组织反应[9]。当组织工程支架植入体内后,首先巨噬细胞识别支架表面蛋白并特异性地黏附其上,协调细胞与生物材料支架的相互作用形成无菌炎症反应。若这种反应持续存在,巨噬细胞与生物材料会融合在一起形成异物巨细胞[10],也就是说巨噬细胞及异物巨细胞对生物材料组织工程支架生物相容性起着决定作用。巨噬细胞在分子水平通过一些细胞因子协调与植入组织工程支架的相互作用。TNF-α为促炎/抗伤口愈合的细胞因子,TGF-β则是抗炎/促伤口愈合的细胞因子,IL-1β能激活炎症细胞(淋巴细胞和单核细胞)并促进伤口愈合,IL-10通过下调炎症细胞的活力并抑制细胞因子产生从而起到抗炎/抗伤口愈合的作用,这些蛋白分子都与伤口愈合及炎症反应有关[11]。
本研究结果显示,在支架植入1个月及3个月时,P(LLA-CL)支架相比 SF/P(LLA-CL)支架有较多的CD68阳性表达,证明有较多的巨噬细胞。在巨噬细胞黏附于支架材料及相互作用中,炎症因子起重要作用,可以看到SF/P(LLA-CL)支架在各时间仅有较少的炎症基因表达,也就是说 SF/P(LLA-CL)有较好的生物相容性。我们认为这可能与SF及其降解产物有关:一方面SF本身具有较好的生物相容性;另一方面随着SF/P(LLA-CL)支架的降解,SF的降解产物多肽及氨基酸分布于支架的表面及内部,与P(LLA-CL)的降解产物相遇,对pH值下降起中和作用[6],从而减缓支架的降解。
SF由家蚕蚕蛹取得,为高分子聚合物,由重复的亲水及疏水肽段组成。疏水域重复的Gly-Ala-Gly-Ala-Gly-Ser组成[12]有利于分子间及分子内部形成β折叠结构[13]。β折叠结构影响着SF的溶解性、机械强度和热稳定性。在本研究中,SF/P(LLA-CL)纳米纤维支架用乙醇蒸汽处理24 h以形成β折叠结构,这种结构的转换可能是SF/P(LLA-CL)降解缓慢的原因之一。另外,由于SF具有出色的机械力学、较高的氧气及水蒸汽通透性、生物相容性及生物可降解性,其已成为引起人们注意的生物材料[14, 15, 16]。目前,基于SF的支架材料作为成纤维细胞、软骨细胞以及间充质干细胞等的细胞基质材料已被证实具有优越的性能[17, 18] 。
综上所述,本研究结果证实,将SF加入P(LLA-CL)支架中,植入皮下后可延缓支架降解并改善支架的生物相容性。该结果可为组织工程支架材料设计提供参考。
| [1] | Madurantakam P A, Cost C P, Simpson D G, Bowlin G L.Science of nanofibrous scaffold fabrication: strategies for next generation tissue-engineering scaffolds[J].Nanomedicine (Lond),2009,4:193-206. |
| [2] | Jayaraman K, Kotaki M, Zhang Y, Mo X, Ramakrishna S.Recent advances in polymer nanofibers[J].J Nanosci Nanotechnol,2004,4(1-2):52-65. |
| [3] | Taylor M S, Daniels A U, Andriano K P, Heller J.Six bioabsorbable polymers: in vitro acute toxicity of accumulated degradation products[J].J Appl Biomater, 1994,5:151-157. |
| [4] | Klompmaker J, Jansen H W, Veth R P, de Groot J H, Nijenhuis A J, Pennings A J.Porous polymer implant for repair of meniscal lesions: a preliminary study in dogs[J].Biomaterials,1991,12:810-816. |
| [5] | Kim J H, Park C H, Lee O J, Lee J M, Kim J W, Park Y H, et al.Preparation and in vivo degradation of controlled biodegradability of electrospun silk fibroin nanofiber mats[J].J Biomed Mater Res A,2012,100:3287-3295. |
| [6] | Zhang K, Yin A, Huang C, Wang C, Mo X, Al-Deyab S S, et al. Degradation of electrospun SF/P(LLA-CL) blended nanofibrous scaffolds in vitro[J].Polym Degrad Stabil,2011,96:2266-2275. |
| [7] | Lamers E, Walboomers X F, Domanski M, te Riet J, van Delft F C, Luttge R, et al.The influence of nanoscale grooved substrates on osteoblast behavior and extracellular matrix deposition[J].Biomaterials,2010,31:3307-3316. |
| [8] | Ji W, Yang F, Seyednejad H, Chen Z, Hennink W E, Anderson J M, et al. Biocompatibility and degradation characteristics of PLGA-based electrospun nanofibrous scaffolds with nanoapatite incorporation[J]. Biomaterials, 2012, 33:6604-6614. |
| [9] | Williams D F.On the mechanisms of biocompatibility[J].Biomaterials,2008,29:2941-2953. |
| [10] | Prodanov L, te Riet J, Lamers E, Domanski M, Luttge R, van Loon J J,et al.The interaction between nanoscale surface features and mechanical loading and its effect on osteoblast-like cells behavior[J].Biomaterials,2010,31:7758-7765. |
| [11] | Yoon S J, Kim S H, Ha H J, Ko Y K, So J W, Kim M S, et al.Reduction of inflammatory reaction of poly(d,l-lactic-co-glycolic acid) using demineralized bone particles[J].Tissue Eng Part A,2008,14:539-547. |
| [12] | Ha S W, Gracz H S, Tonelli A E, Hudson S M.Structural study of irregular amino acid sequences in the heavy chain of Bombyx mori silk fibroin[J].Biomacromolecules,2005,6:2563-2569. |
| [13] | Heslot H.Artificial fibrous proteins: a review[J].Biochimie,1998,80:19-31. |
| [14] | Rockwood D N, Preda R C, Yücel T, Wang X, Lovett M L, Kaplan D L.Materials fabrication from Bombyx mori silk fibroin[J].Nat Protoc,2011,6:1612-1631. |
| [15] | Canabady-Rochelle L L, Belton D J, Deschaume O, Currie H A, Kaplan D L, Perry C C.Bioinspired silicification of silica-binding peptide-silk protein chimeras: comparison of chemically and genetically produced proteins[J].Biomacromolecules, 2012,13:683-690. |
| [16] | Numata K, Yamazaki S, Naga N.Biocompatible and biodegradable dual-drug release system based on silk hydrogel containing silk nanoparticles[J].Biomacromolecules,2012,13:1383-1389. |
| [17] | Acharya C, Ghosh S K, Kundu S C.Silk fibroin protein from mulberry and non-mulberry silkworms: cytotoxicity, biocompatibility and kinetics of L929 murine fibroblast adhesion[J].J Mater Sci Mater Med,2008,19:2827-2836. |
| [18] | Mandal B B, Kundu S C.Cell proliferation and migration in silk fibroin 3D scaffolds [J]. Biomaterials, 2009, 30:2956-2965. |
 2015, Vol. 36
2015, Vol. 36


