2. 广州中医药大学脾胃研究所, 广州 510405;
3. 广州市海珠区妇幼保健院中医科, 广州 510240
2. Pi-Wei Institute, Guangzhou University of Chinese Medicine, Guangzhou 510405, Guangdong, China;
3. Department of Traditional Chinese Medicine, Maternal and Child Health Hospital of Haizhu District, Guangzhou 510240, Guangdong, China
由于遗传基因的差异,不同个体对一些疾病具有不同的敏感性,对同一药物的药效和不良反应也存在差异,然而这些都与DNA的多态性密不可分。 通过DNA水平的遗传多态性分析,我们不仅能够发现某些疾病的易感基因,建立遗传病的基因诊断方法,而且还能从基因组水平深入认识疾病及药物作用个体差异的机制,指导和优化临床用药。因此,DNA多态性在生物医学、药物开发、法医鉴定甚至人类进化起源等领域都有非常重要的价值。提取高质量的基因组DNA是这些研究的基础。传统用于DNA提取的样本主要来源于血液,但是这一来源将面临着大样本采集的经费和实用性的问题,尤其不适合于儿童和健康志愿者的标本采集。唾液作为一个潜在的诊断标本,具有采集方便、无创伤等优点。多个研究显示唾液来源的基因组DNA完全适用于大样本DNA多态性分析的流行病学研究[1, 2, 3, 4]。
本研究从获得口腔黏膜细胞的途径、储存条件、DNA提取方法等方面探索从唾液中提取人类基因组DNA的方法,测定基因组DNA的含量和质量,并用TP53和PRB-3基因的PCR反应验证其扩增效果。同时采集大量健康儿童和成人唾液标本评估该方法DNA提取的稳定性,以期获得一种快速、有效且对人体无伤害、无痛苦的基因组DNA提取方法。 1 材料和方法 1.1 标本采集与处理
从广东药学院征集6名健康志愿者,按照课题组前期唾液定时采集的方式[5]采集基础状态下3 min的唾液,简单操作如下:受试者除喝水外禁食1 h以上,采样前静坐10 min,并通过吞咽排空口腔唾液,然后通过自然流出的方法收集3 min口腔分泌的唾液。取2个1.5 mL的EP管,各加入0.1 mL唾液,其中一管室温(25℃)放置1周备用,另一管直接用于DNA提取。20 min后,按照口腔拭子基因组DNA提取试剂盒(天根生化科技有限公司)说明书的要求,取一支口腔拭子在面颊内壁两侧各反复刮拭6次,室温(25℃)放置1周备用。取另一支口腔拭子重复操作1次,直接用于DNA提取。
按照上述唾液自然流出的采集方式[5],分别从广州市海珠区妇幼保健院和广东药学院采集47名健康儿童(23名男孩,24名女孩)和52名健康成人(26名男性,26名女性)的唾液标本,-80℃保存并在1周内进行DNA提取实验。采集3 min的平均唾液量为(0.46±0.29)mL(范围0.2~1.2 mL)。该研究的所有参与者和儿童参与者的监护人都签署了《知情同意书》。 1.2 唾液基因组DNA提取和鉴定
对采集的6名健康志愿者新鲜和室温放置1周的唾液标本,分别利用碘化钾法和试剂盒法进行DNA提取。(1)碘化钾法:参考Loparev等[6]的方法并做部分修改。取0.1 mL唾液置于1.5 mL离心管中,加0.01 mol/L PBS溶液500 μL,反复吹打几下,11 000×g离心5 min;沉淀加50 μL 5 mol/L的碘化钾溶液,漩涡30 s,再加100 μL 0.9% NaCl和150 μL酚∶氯 仿(25∶24)溶液,震荡30 s,11 000×g离心5 min;取上清,加入等体积的异丙醇,混匀,11 000×g离 心5 min;沉淀加入500 μL无水乙醇洗涤,11 000×g离 心5 min。沉淀室温晾干,用TE缓冲液溶解。(2)口腔拭子基因组DNA提取试剂盒法:试剂盒购自天根生化科技有限公司,DNA提取按照试剂盒的操作说明进行。99名健康儿童和成人的唾液标本,解冻后直接用碘化钾法进行DNA提取。提取的DNA用1%琼脂糖凝胶电泳检测,电泳结果用Bio-Rad GelDoc XR凝胶成像系统进行观察拍照。DNA含量和纯度用NanoDrop 2000分光光度计(Thermo Scientific)测定。 1.3 基因组DNA体外PCR扩增
以提取的唾液基因组DNA样品作为模板,在ABI 2720型PCR仪上扩增肿瘤蛋白TP53基因和唾液特异蛋白PRB-3基因。PCR反应体系按照东盛生物PCR Mix试剂盒的说明书进行配制,20 μL的反应体系含DNA模板50 ng(室温放置1周的唾液标本提取的DNA使用的PCR模板量为100 ng),上、下游引物各1 μL(引物浓度为1 μmol/L)。TP53引物序列:P1为5′-CCCTTCCCAGAAAACCTACC-3′,P2为5′-CAGGCATTGAAGTCTCATGG-3′,扩增片段大小为192 bp; PCR循环参数: 95℃ 3 min,然后95℃ 15 s、60℃ 30 s循环30次。PRB-3引物序列:P1为5′-ACAGCCTCCCCAGTAATCA-3′,P2为5′-TTAAAGGTAGAGCTATGAC-3′,扩增片段大小为1 261 bp;反应条件:95℃ 5 min,然后95℃ 1 min、55℃ 1 min、72℃ 1.5 min循环30次,72℃ 7 min。PCR产物用1%琼脂糖凝胶电泳检测。另外,为了探讨唾液中微生物和食物残渣是否会干扰PCR扩增,课题组对碘化钾法提取的基因组DNA进行TP53基因荧光实时定量PCR扩增。定量PCR反应按照iTaq Universal SYBR Green Supermix (Bio-Rad)说明书配制反应液,在Bio-Rad CFX96 Touch Real-Time PCR仪上进行扩增。20 μL反应体系含样本DNA模板10 ng,TP53引物序列和用量同前。定量PCR循环温度为95℃预温3 min,95℃ 15 s、60℃ 30 s循环35次。 1.4 统计学处理
利用SPSS 19.0 软件对DNA提取的得率和D260/D280、D260/D230值数据进行t检验,检验水准(α)为0.05。 2 结 果 2.1 唾液基因组DNA的得率和纯度比较
表 1显示了不同保存条件和提取方法提取的唾液基因组DNA的DNA提取效率(得率),以及D260与D280、D230之间的比值。从DNA提取的得率来看,以使用试剂盒法提取新鲜唾液标本获得的DNA含量最高,以试剂盒法提取室温保存7 d的唾液标本获得的DNA含量最低。碘化钾法对两种不同保存方法获得的DNA含量居中,且两者差异不大。从提取质量来看,碘化钾法对新鲜唾液标本提取的DNA的D260/D280值为2.0左右,而且对室温保存样本获得DNA的D260/D280值更高;试剂盒法对两种保存方法获得的DNA的D260/D280值都在1.8左右。 并且碘化钾法提取的DNA的D260/D230值都明显低于试剂盒法,这些结果提示碘化钾法提取的DNA可能存在少量RNA和盐离子、糖类物质的残留。此外,碘化钾法对99名健康儿童和成人-80℃冻存唾液标本提取的基因组DNA的得率和D260/D280、D260/D230都与碘化钾法提取新鲜唾液标本的结果一致。
|
|
表 1 不同保存条件和提取方法提取的基因组DNA得率和纯度 Tab 1 Genomic DNA yield and purity from different conservation conditions and extraction methods |
碘化钾法和试剂盒法对新鲜唾液样本提取的DNA用40 μL的TE缓冲液溶解,对室温放置1周的唾液标本提取的DNA用15 μL的TE缓冲液溶解。随机选择2个健康志愿者的8个DNA样品,各取5 μL点样在同一块凝胶上进行电泳,电泳结果如图 1。由图 1A可知,碘化钾法和试剂盒法对新鲜唾液样本提取的DNA在23 kb附近都有一条明显的主带,但是试剂盒法获得的DNA拖尾现象明显,提示DNA存在降解。两种DNA提取方法对于室温放置1周的唾液标本提取的DNA都存在一定程度的降解,尤其是试剂盒法获得的DNA样品降解严重,其中一个标本几乎没有明显的主带,提示碘化钾法对于室温放置7 d的唾液样本也能获得较好的提取效果,而试剂盒法则效果较差。此外,对碘化钾法提取的99份健康儿童和成人-80℃冻存唾液标本的基因组DNA,随机选择5个DNA样品进行电泳,其电泳图谱与碘化钾法对新鲜唾液标本的提取结果类似(图 1B),提示碘化钾法对新鲜或-80℃冻存唾液标本提取的基因组DNA质量比较稳定。
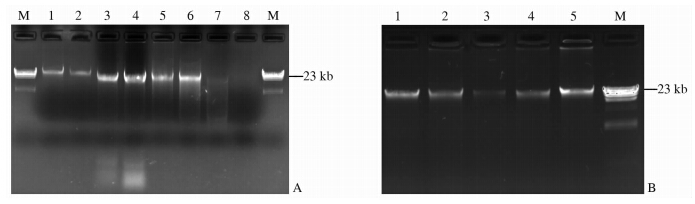 | 图 1 唾液基因组DNA电泳结果 Fig 1 Electrophoresis results of salivary genomic DNA 9A: Genomic DNAs from different conservation conditions and extraction methods. M indicated λDNA/Hind Ⅲ molecular weight marker; 1-4 indicated DNAs extracted by the method of KI (1,2 indicated fresh saliva and 3,4 indicated saliva placed for a week at room temperature); 5-8 indicated DNA extracted by the method of Kit (5,6 indicated fresh saliva and 7,8 indicated saliva placed a week at room temperature). B: Genomic DNA was extracted by the method of KI from saliva of 5 healthy volunteers |
以提取的基因组DNA作为模板,对TP53和PRB-3基因进行PCR扩增,各取5 μL扩增产物电泳检测。为了便于结果的比较,图 2A~2D仅展示了图 1A和1B中样本基因组DNA的PCR扩增结果。由图可以看出,不同来源的DNA样品对TP53和PRB-3基因都有非常好的PCR扩增效果,PCR产物大小与预期一致。其中不同来源的基因组DNA对TP53基因(短片段DNA)的PCR扩增效果没有差异,然而对PRB-3基因(长片段DNA)的PCR扩增效果则有明显差异,表现为新鲜样本的扩增效果较好,室温放置1周的唾液样本扩增效果较差。提示虽然两种提取方法之间没有明显的差异,但是不同的唾液保存方法却存在明显不同。此外,定量PCR结果(图 2E和2F)显示,图 1B中随机选择的5个唾液基因组DNA对TP53基因都有很好的荧光扩增曲线,并且它们的荧光熔解曲线只有一个特征峰,提示唾液中微生物和食物残渣不会干扰人源PCR扩增。
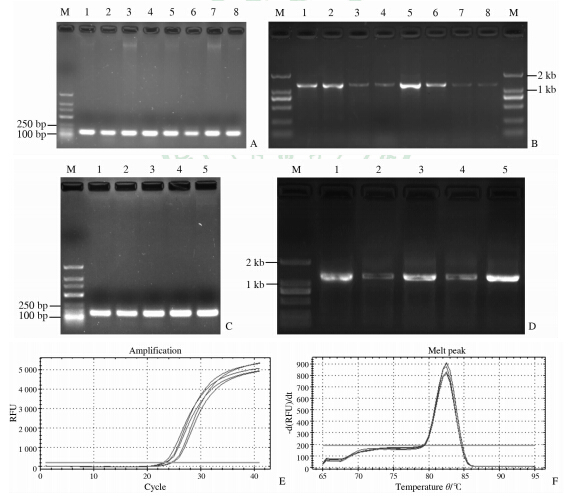 | 图 2 唾液基因组DNA的TP53和PRB-3基因PCR扩增 Fig 2 PCR amplification of TP53 and PRB-3 based on salivary genomic DNA A,B: PCR amplifications of TP53 (192 bp) and PRB-3 (1 261 bp) genes based on eight genomic DNA samples from different conservation conditions and extraction methods,respectively. M indicated DS-2000 molecular weight marker,1-8 were described in Fig 1A; C,D: PCR amplifications of TP53 and PRB-3 genes based on five genomic DNA samples from Fig 1B; E,F: Fluorescence amplification and melt peak curves of TP53 gene by quantity PCR based on five genomic DNA of Fig 1B. RFU:Relative fluorescence units |
基因多态性研究已经广泛应用到临床检验、医药研究、法医鉴定和分子流行病的调查中,其样本来源大部分还是以血液为主。然而当血液标本的采集存在困难时,如健康人群,尤其是儿童和老年人,由于身体状况或其他原因不愿提供血液样品,则需要通过其他方式来获得DNA标本。理论上DNA可以从身体的任何细胞中获取。人类口腔黏膜为复层鳞状上皮,由多层细胞组成,其中基底层具有旺盛分裂能力,最表层的角化层已衰老退化,可以自然脱落到唾液中,也可在外力作用下剥落到载体上。这些脱落口腔细胞虽然细胞核固缩,但同样具有完整人类的基因组DNA序列,从而成为法医学和遗传学DNA多态性检测分型的生物性检验材料[7]。目前,从唾液采集的方式到基因组DNA提取方法已有大量文献报道,并且一致显示从唾液标本中能够提取高质量的基因组DNA,满足各种DNA多态性的分析[1, 2, 3, 4, 6],但是这些研究方法主要以商业试剂盒为主,价格较贵,操作烦琐。
本研究比较了碘化钾法和口腔拭子基因组DNA提取试剂盒法对唾液基因组DNA的提取,从结果来看,两种方法对新鲜唾液样本都能获得高质量的DNA,并且对TP53和PRB-3基因都能获得很好的PCR扩增效果。其中试剂盒法获得的DNA含量更高,但其DNA降解也更高。究其原因可能与试剂盒法的采样方式和DNA提取过程有关。口腔上皮细胞具有代谢旺盛、更新快、易脱落的特点。商业试剂盒采用灭菌棉签在口腔面颊内壁两侧各擦拭6次,而碘化钾法则采用直接吐唾液的方式收集唾液标本,因此前者收集到的口腔上皮细胞较多,其获得的DNA含量相应也较多。另外,收集到的口腔上皮细胞为衰老退化的细胞,并且细胞核已固缩,其DNA存在氧化、断裂、缺失和交联等现象,核苷酸长链的脆性增加,变得比较容易断裂。此时除了采样方式的物理剪切会增加DNA的断裂外,DNA提取过程如果过于烦琐,移液和离心过程的物理剪切必然会增加DNA的断裂降解。试剂盒法需要经过细胞裂解、过柱前处理、过柱、去杂质和溶解DNA等10个步骤,包括8次离心、6次漩涡、2次裂解液的移液操作,共计80 min。然而,碘化钾法只需要经过细胞裂解、去蛋白、沉淀、洗涤和溶解DNA 等5个常规的步骤,涉及4次离心、3次漩涡、2次裂解液的移液操作,共计25 min。因此,试剂盒棉签拭子的采样方式和烦琐的DNA提取过程是导致DNA降解的重要原因。陈嘉昌等[8]也发现利用棉签拭子采集的标本提取的DNA会出现严重的降解,而且还呈现出明显的DNA ladder凋亡条带。他们认为口腔上皮细胞离开水相环境后,会加速其凋亡速度。同时,由于采样方式的物理剪切,核膜和质膜发生破裂,致使基因组DNA暴露在极易受降解的环境中。相对于试剂盒法,碘化钾法提取的唾液基因组DNA的D260/D280值偏高(2.0左右)、D260/D230值偏低(0.7左右),该结果揭示碘化钾法获得的基因组DNA存在一定量的RNA和盐离子、糖类物质的残留。由于细胞裂解释放的RNA在高盐或有机溶剂中短期内很难彻底降解,再加上唾液中本身含有较多的糖类物质,因此去除RNA、增加DNA的洗涤次数对获得高纯度的基因组DNA非常必要。碘化钾法在DNA提取过程中未做RNA去除处理,并且只用无水乙醇洗涤DNA一次,因此其获得的DNA纯度偏低,建议在使用碘化钾法的时候可以适当增加一次DNA的洗涤。试剂盒法采用的硅基质材料能高效、专一地吸附DNA,并且对提取的DNA进行了2次以上的洗涤,因此其基因组DNA纯度较高。但是从PCR的结果来看,碘化钾法残留的RNA和盐离子杂质并不会影响PCR扩增。为了验证碘化钾法提取唾液基因组DNA的稳定性,本研究对99名健康儿童和成人-80℃冻存唾液标本进行了DNA提取,结果显示DNA含量虽然存在个体差异,但是DNA的质量较好且稳定可靠,对TP53和PRB-3基因都能获得很好的PCR扩增效果。对于个体差异的原因,可能与唾液量、口腔发育和口腔卫生的差异等有关。可见碘化钾法提取唾液基因组DNA简便快速、稳定可靠,适用于分子流行病大样本DNA的提取和多态性分析。
此外,为了考虑唾液样本运输的问题,本研究还做了唾液标本室温放置1周的DNA提取实验。研究结果显示,两种提取方法获得的基因组DNA都明显降解,但是碘化钾法提取的基因组DNA主带清晰,而试剂盒法的主带较弱甚至没有。另外,两种方法获得的DNA对TP53和PRB-3基因都能获得很好的PCR扩增效果,但是对于PRB-3基因长片段PCR扩增效果,室温放置1周的唾液样本明显差于新鲜标本。该结果说明室温放置1周的唾液标本虽然降解明显,但是获得的DNA足够用于1 kb左右DNA片段的PCR扩增。推测两种DNA提取方法的PCR结果没有差异而基因组DNA却存在差异的原因,可能与它们的唾液采集方式有关。棉签拭子采样时的物理剪切和干燥环境,会促进唾液标本DNA的降解(如前所述)。吐唾液的采样方式可以避免棉签拭子采样时的问题,而且其采集的唾液标本室温下会滋生大量口腔微生物的生长,从而增加其提取基因组DNA的含量。因此,碘化钾法提取的基因组DNA可能含有大量的微生物DNA。然而这些杂质DNA是否会影响唾液基因组DNA的多态性分析呢?本研究利用碘化钾法提取的唾液基因组DNA进行TP53基因的荧光定量PCR实验,结果发现它们都有很好的荧光扩增曲线,并且熔解曲线也没有双峰或多峰出现,该结果证实唾液中的微生物和食物残渣不会给基因多态性分析带来干扰。对于这一点,程家蓉等[9]也获得类似的结果。
综上所述,碘化钾法和试剂盒法对于新鲜和室温放置1周的唾液标本都能获得足量的DNA用于PCR扩增,并且两种方法之间没有差异。直接吐唾液的采样方式虽然提取的DNA量略少些,但是其DNA降解程度较低,应作为唾液标本采集的首选。相对于商业试剂盒法,碘化钾法经过大量唾液标本的验证,不仅廉价、简便,而且能快速从唾液中提取足量和高质量的基因组DNA,为分子流行病学的研究提供了简易、方便、对人体无损伤的有效方法。
| [1] | Koni A C, Scott R A, Wang G, Bailey M E, Peplies J, Bammann K, et al. DNA yield and quality of saliva samples and suitability for large-scale epidemiological studies in children [J]. Int J Obes (Lond), 2011, 35(Suppl 1):S113-S118. |
| [2] | Rogers N L, Cole S A, Lan H C, Crossa A, Demerath E W. New saliva DNA collection method compared to buccal cell collection techniques for epidemiological studies [J]. Am J Hum Biol, 2007, 19:319-326. |
| [3] | Nemoda Z, Horvat-Gordon M, Fortunato C K, Beltzer E K, Scholl J L, Granger D A. Assessing genetic polymorphisms using DNA extracted from cells present in saliva samples [J]. BMC Med Res Methodol, 2011, 11:170. |
| [4] | 朱伟锋,罗达亚,涂 硕,张霞丽,揭克敏,万福生. 盐析法快速提取口腔拭子DNA[J]. 第二军医大学学报,2011,32:1370-1374. Zhu W F, Luo D Y, Tu S, Zhang X L, Jie K M, Wan F S, et al. A rapid salting out method for DNA extraction from buccal swabs[J]. Acad J Sec Mil Med Univ, 2011, 32: 1370-1374. |
| [5] | 陈龙辉,杨泽民,李茹柳,林传权,张 杰,陈蔚文. 柠檬酸滤纸面积及浓度对刺激健康人唾液分泌和唾液淀粉酶活性改变的影响[J]. 广州中医药大学学报,2013,30:186-190. |
| [6] | Loparev V N, Cartas M A, Monken C E, Velpandi A, Srinivasan A. An efficient and simple method of DNA extraction from whole blood and cell lines to identify infectious agents [J]. J Virol Methods, 1991, 34:105-112. |
| [7] | 张 越,梅善宗. 微量口腔粘膜脱落细胞检材STR位点的法医学检测分型[J]. 皖南医学院学报,2005,24:74-76. |
| [8] | 陈嘉昌,张红宇,彭瑾瑜,付艳艳,叶伟超,常 弘. 从唾液获取人体DNA的简易方法与应用[J]. 中山大学学报:医学科学版,2006,27(S2):171-173. |
| [9] | 程家蓉,关赛芳,王学励,韩丽华,高玉堂. 从人口腔细胞获取基因组DNA作基因多态性分析的可行性[J]. 癌症,2005,24:893-897. |
 2015, Vol. 36
2015, Vol. 36


