肾细胞癌(renal cell carcinoma,RCC)发病率居泌尿系恶性肿瘤的第3位,约占成人实体恶性肿瘤的2%~3%。不同国家或地区肾癌发病率不同,发达国家肾癌发病率高于发展中国家,我国近年来肾癌的发病率和死亡率均有上升趋势[1]。提高肾癌的诊治水平,探讨肾癌的多种治疗手段,延长肾癌患者的生存期及生活水平,成为泌尿外科医生面对的重要课题之一。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是目前研究最为广泛的成体干细胞之一,具有自我更新和多向分化潜能。大量研究表明,BM-MSCs与肿瘤的发生和发展具有密切关系[2, 3, 4],不仅表现为对肿瘤有明显的募集作用,还表现在干预肿瘤细胞的生物学行为。本研究将BM-MSCs 与A498细胞共培养,观察BM-MSCs对A498增殖和侵袭能力的影响,并对其机制进行初步探讨。 1 材料和方法 1.1 主要材料及试剂
A498细胞及人成纤维细胞HDF-a(ATCC公司); RPMI 1640培养液、DMEM培养液、胎牛血清、胰蛋白酶为Gibco公司产品;RNA提取试剂 TRIzol为 Invitrogen公司产品。Transwell为Millicell公司产品。流式细胞术相关抗体:CD29抗体(BD PharMingen),CD73、CD105抗体(Santa Cruz Biotechnology),CD14、CD34、CD45、CD90抗体(NeoMarker公司);FITC和Cy3荧光素二抗(Sigma公司)。 1.2 BM-MSCs采集、分离、培养及鉴定
BM-MSCs采集、分离、培养、鉴定参照本实验室以往流程[5],简述如下:无菌抽取健康供者10 mL骨髓液,肝素抗凝,Ficoll梯度密度离心法分离,获取单个核细胞层,用PBS洗涤2次后计数细胞,按1×105/cm2 的密度接种于培养瓶,用含10%(体积分数)胎牛血清的低糖DMEM培养液培养。3 d后去除非贴壁细胞,每3 d更换培养液,当贴壁细胞达80%融合时,用0.25%胰蛋白酶消化,细胞按5×103/cm2的密度接种传代。取生长状态良好的第5代细胞,用1 mL PBS洗涤后,与一抗孵育液(一抗按1∶50稀释)室温下孵育1 h;PBS洗涤2次后,分别与FITC或Cy3二抗(稀释倍数分别为1∶32和1∶50)室温下避光孵育30 min;PBS洗涤2次后,弃去PBS,再加入500 μL PBS重悬细胞。利用流式细胞技术鉴定表面分子标记物(CD73、CD90、CD105、CD34、CD45、CD29和CD14)。 1.3 BM-MSCs与A498细胞共培养
将BM-MSCs或HDF-a细胞置于Transwell上室,A498细胞置于下室,共培养48 h后,常规胰酶消化置于下室的A498细胞,PBS冲洗3次后,进行后续实验。 1.4 流式细胞仪检测细胞周期
分为实验组、阴性对照组和阳性对照组,实验组为BM-MSCs与A498细胞共培养,阴性对照组为野生型A498细胞,阳性对照组为HDF-a与A498细胞共培养。取对数生长期的细胞1×106/mL,胰酶消化,离心收集细胞,弃上清,用预冷PBS洗涤细胞2次,加入预冷75%乙醇,4℃固定过夜。离心收集细胞,以1 mL PBS洗细胞2次,加入500 μL PBS[含50 μg/mL溴化乙啶(PI),100 μg/mL RNase A,0.2% Triton X-100],4℃避光孵育30 min。用流式细胞仪以标准程序检测,一般计数2万~3万个细胞,结果用细胞周期拟合软件Mod-Fit分析。 1.5 细胞侵袭实验
实验分为实验组、阴性对照组和阳性对照组,实验组为BM-MSCs与A498细胞共培养,阴性对照组为野生型A498细胞,阳性对照组为HDF-a与A498细胞共培养。用 50 mg/L Matrigel 1∶8稀释液包被 Transwell小室底部膜的上室面,4℃风干。消化共培养后的细胞,用含BSA的无血清培养基重悬。调整细胞密度至1×105/mL。取细胞悬液200 μL加入24孔板Transwell小室。培养32 h后用棉签擦去基质胶和上室内细胞,加入4%多聚甲醛固定30 min,0.5%结晶紫染色10 min。使用正置显微镜进行观察和拍照,采用3~5个视野进行细胞计数,并求平均值。 1.6 qRT-PCR测定目的基因表达
用TRIzol试剂提取各组A498细胞的总RNA,反转录为cDNA,进行扩增。引物由Invitrogen生物技术有限公司合成。Snail引物序列:上游5′-CAT TCA GGC CAC CTT CTT TC-3′,下游5′-TCC AGT AAC CAC CCT GCT GA-3′;E-cadherin引物序列:上游5′-GGA GGC AGA GGC AGT CAG AT-3′,下游5′-GGT TTG CAG AGA CAG GGT TTC-3′;β-actin作为内参照,其引物序列:上游5′-AGA AAA TCT GGCACC ACA CC-3′,下游5′-AGA GGC GTA CAGGGA TAG CA-3′。PCR反应条件为:94℃ 5 min;94℃ 30 s,51℃30 s,72℃ 45 s,共35个循环;72℃延伸 10 min后结束反应。定量分析采用ABI 7500软件,各组重复3次,取其平均值。 1.7 统计学处理
采用SPSS 10.0统计软件分析数据,计量资料以x±s表示,多样本均数进行单因素方差分析,组间比较采用q检验,检验水准(α)为0.05。
2 结 果
2.1 BM-MSCs的鉴定 将体外分离纯化并扩增后的BM-MSCs利用流式细胞仪进行表面分子鉴定。其中,CD73、CD90、CD105、CD29呈阳性反应,表达细胞比例分别为(96.9±0.3)%、(96.7±0.3)%、(94.0±0.4)%、(97.4±0.4)%;CD34、CD45、CD14呈阴性反应,表达细胞比例分别为(0.7±0.2)%、(1.3±0.2)%、(0.2±0.1)%。
2.2 BM-MSCs对A498细胞周期的影响 流式细胞术检测结果表明:与BM-MSCs共培养的A498细胞中,处于G0/G1期细胞的比例高于野生型A498细胞[(70.57±5.63)% vs (63.23±4.71)%,P<0.05],且上述两者均高于与HDF-a共培养的A498细胞[(54.23±3.17)%,P<0.05]。结果提示与BM-MSCs共培养明显抑制了A498细胞的生长。
2.3 BM-MSCs对A498细胞体外侵袭能力的影响 Transwell 实验结果(图 1)表明:与BM-MSCs共培养的A498细胞穿过滤膜的数量少于野生型A498细胞(72.00±17.78 vs 116.67±11.37,P<0.05),且上述两者均少于与HDF-a共培养的A498细胞(156.67±26.76,P<0.05)。结果提示BM-MSCs可使A498细胞侵袭能力降低。
qRT-PCR检测结果表明:与BM-MSCs共培养的A498细胞Snail mRNA表达水平低于单纯A498细胞和与HDF-a共培养的A498细胞(0.240±0.137 vs 1.000±0.169、1.990±0.408,P<0.05);而E-cadherin mRNA在与BM-MSCs共培养的A498细胞表达水平高于单纯A498细胞、与HDF-a共培养的A498细胞(2.690±0.248 vs 1.000±0.137、0.680±0.266,P<0.05)。结果提示BM-MSCs可抑制肾癌A498细胞上皮间充质转化能力。
3 讨 论
近年来大量研究报道了间充质干细胞(MSCs)能特异地向肿瘤及肿瘤转移部位迁移,这一向肿瘤募集的现象已经得到共识[2, 3, 4],但MSCs对肿瘤细胞的作用存在较多争议,主要表现在MSCs是促进肿瘤细胞生长[6, 7, 8, 9],还是抑制肿瘤细胞生长[10, 11, 12, 13, 14]。Yu等[9]将脂肪组织中提取的MSCs与肺癌H460细胞或神经胶质瘤U87MG细胞一同注入裸鼠体内,发现MSCs可促进肿瘤细胞生长。Sun等[6]报道MSCs可通过促进肿瘤血管生成而促进黑素瘤的生长。同时也有较多文献报道了MSCs对肿瘤细胞的抑制作用。Cousin等[13]通过体外实验发现,脂肪组织来源的MSCs可以促进胰腺癌细胞坏死,在体内实验中证实脂肪组织来源的MSCs可以表现出持久的抑瘤作用。Qiao 等[11]证实,MSCs可通过Wnt信号通路抑制肝癌细胞的生长及促进肝癌细胞凋亡。
目前尚缺乏MSCs对肾癌细胞作用的相关研究。本实验通过将BM-MSCs与肾癌A498细胞共培养,发现BM-MSCs可以将A498细胞阻滞于 G0/G1期,从而抑制A498细胞的生长。共培养32 h 后,即在不影响细胞活性的时间点进行Transwell侵袭实验检测细胞侵袭能力,结果发现与BM-MSCs共培养的A498细胞穿过滤膜的细胞数约为对照组的50%,提示BM-MSCs可以抑制A498细胞的侵袭能力。同时,以人成纤维细胞HDF-a作为阳性对照,实验结果表明同为间充质来源的成纤维细胞可促进肾癌细胞的增殖与侵袭,与BM-MSCs对肾癌A498细胞的抑制作用正好相反,起到了很好的佐证作用。
研究表明,锌指转录因子Snail蛋白可通过转录抑制E-cadherin蛋白的表达诱导上皮间充质转化的发生,从而增强肿瘤细胞的侵袭性[15]。王晓彬等[16]通过免疫组化的方法发现,肾透明细胞癌组织Snail阳性率高于癌旁组织,而E-cadherin阳性率低于癌旁组织,两者的表达均与肾透明细胞癌不同分化程度、分期、浸润和转移有关。本实验通过qRT-PCR发现,BM-MSCs可以抑制A498细胞Snail基因的表达,增强E-cadherin基因的表达,从而在机制上初步阐明了BM-MSCs抑制A498细胞生物学行为的原因。但是,MSCs如何调控Snail和E-cadherin基因的表达,以及MSCs在体内如何调控肾癌细胞生长尚不清楚,将在今后实验中进一步探索。
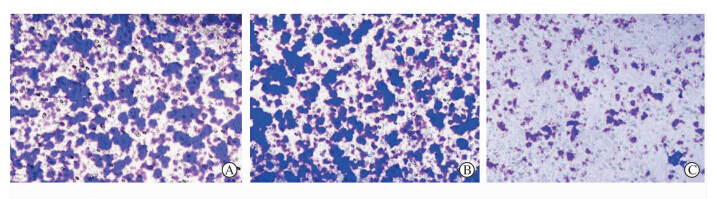
图 1 BM-MSCs 抑制A498细胞的侵袭能力
Fig 1 BM-MSCs suppressed the invasion ability of A498 cells
A: A498 cells; B: A498 cells co-cultured with HDF-a cells; C: A498 cells co-cultured with BM-MSCs. BM-MSCs: Bone marrow mesenchymal stem cells. Original magnification:×400
| [1] | 那彦群,叶章群,孙 光.中国泌尿外科疾病诊断治疗指南[M]. 北京:人民卫生出版社,2011:54. |
| [2] | Karnoub A E,Dash A B,Vo A P,Sullivan A,Brooks M W,Bell G W,et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis[J]. Nature,2007,449:557-563. |
| [3] | Goldstein R H, Reagan M R, Anderson K, Kaplan D L, Rosenblatt M. Human bone marrow-derived MSCs can home to orthotopic breast cancer tumors and promote bone metastasis[J]. Cancer Res,2010,70:10044-10050. |
| [4] | Liu S,Ginestier C,Ou S J,Clouthier S G,Patel S H,Monville F,et al. Breast cancer stem cells are regulated by mesenchymal stem cells through cytokine networks[J]. Cancer Res,2011,71:614-624. |
| [5] | Tan J,Wu W,Xu X,Liao L,Zheng F,Messinger S,et al. Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants: a randomized controlled trial[J]. JAMA,2012,307:1169-1177. |
| [6] | Sun B,Zhang S,Ni C,Zhang D,Liu Y,Zhang W,et al. Correlation between melanoma angiogenesis and the mesenchymal stem cells and endothelial progenitor cells derived from bone marrow[J]. Stem Cells Dev,2005,14:292-298. |
| [7] | Zhu W,Xu W,Jiang R,Qian H,Chen M,Hu J, et al. Mesenchymal stem cells derived from bone marrow favor tumor cell growth in vivo[J]. Exp Mol Pathol,2006,80:267-274. |
| [8] | Amé-Thomas P,Maby-El Hajjami H,Monvoisin C,Jean R,Monnier D,Caulet-Maugendre S, et al. Human mesenchymal stem cells isolated from bone marrow and lymphoid organs support tumor B-cell growth: role of stromal cells in follicular lymphoma pathogenesis[J]. Blood,2007,109:693-702. |
| [9] | Yu J M,Jun E S,Bae Y C,Jung J S. Mesenchymal stem cells derived from human adipose tissues favor tumor cell growth in vivo[J]. Stem Cells Dev, 2008,17:463-473. |
| [10] | Khakoo A Y, Pati S, Anderson S A, Reid W, Elshal M F, Rovira I I, et al. Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi's sarcoma[J]. J Exp Med,2006,203:1235-1247. |
| [11] | Qiao L, Xu Z, Zhao T, Zhao Z, Shi M, Zhao R C, et al. Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma model[J]. Cell Res,2008,18:500-507. |
| [12] | Cho J A,Park H,Kim H K,Lim E H,Seo S W,Choi J S,et al. Hyperthermia-treated mesenchymal stem cells exert antitumor effects on human carcinoma cell line[J]. Cancer,2009,115:311-323. |
| [13] | Cousin B,Ravet E,Poglio S,De Toni F,Bertuzzi M,Lulka H,et al. Adult stromal cells derived from human adipose tissue provoke pancreatic cancer cell death both in vitro and in vivo[J]. PLoS One,2009,4:e6278. |
| [14] | Zhu Y,Sun Z,Han Q,Liao L,Wang J,Bian C,et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1[J]. Leukemia,2009,23:925-933. |
| [15] | Bruyere F,Namdarian B,Corcoran N M,Pedersen J,Ockrim J,Voelzke B B,et al. Snail expression is an independent predictor of tumor recurrence in superficial bladder cancers[J]. Urol Oncol,2010,28:591-596. |
| [16] | 王晓彬, 窦中岭, 史海军, 刘 辉, 李世朋. 转录因子Snail及上皮钙黏素在肾透明细胞癌中的表达及其意义[J].中华实验外科杂志,2012,29:1031-1033. |
 2015, Vol. 36
2015, Vol. 36


