2. 第二军医大学东方肝胆外科医院胆道Ⅰ科, 上海 200438
2. Department of Biliary Tract Surgery Ⅰ, Eastern Hepatobliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
肝外胆管癌是一种常见的恶性肿瘤,诊断困难,死亡率高[1, 2]。即使进行根治性切除手术,预后仍然难以令人满意[3],因此,探索该病术后早期复发的相关因素非常重要。以往研究表明,术前血清CA19-9显著升高、术后病理报告区域淋巴结转移是术后早期复发以及预后不良的高危因素[4]。但是,术前血清CA19-9为阴性以及未发现淋巴结转移的患者尚缺乏有效的预测标志物。近年来,代谢组学迅速发展并在多个领域得到应用。代谢组学能够对患者的血液、 胆汁、尿液等体液中的小分子代谢物进行定性定量分析,进而为判断预后提供帮助。因此,笔者拟对比分析围手术期胆汁代谢差异,筛选与肝外胆管癌根治性切除预后相关的胆汁分子标志物。
1 资料和方法 1.1 一般资料自2013年2月22日至8月26日在第二军医大学东方肝胆外科医院诊断为肝外胆管癌的患者共27例,男18例,女9例。其中肝门部胆管癌患者19例 (根据术后TNM分期Ⅰ期1例,Ⅱ期7例,Ⅲb期4例,Ⅳa期7例), 远端胆管癌患者8例(根据术后TNM病理分期(Ⅰa期2例,Ⅱa期5例,Ⅲb期1例)。患者术前无合并性肝炎、原发性肝癌、痛风、甲状腺功能减低等疾病,排除妊娠或哺乳期女性、血液病、近期使用过激素、近期有过大面积烧伤等急性应激反应。治疗方法: 肝门部胆管癌采用根治术,远端胆管癌采用胰十二指肠切除术。对以上所有患者进行术后1年随访,记录患者术后有无肿瘤复发、转移,复发、转移的部位,以及是否死亡等情况。本研究获第二军医大学东方肝胆外科医院医学伦理委员会批准,患者(或家属)均签署知情同意书。纳入患者的人口学特征及相关检验结果见表 1。
|
|
表 1 研究人群的人口学特征、相关检验结果和术后TNM病理分期 Tab 1 Demographic information,laboratory report and TNM stage of patients |
(1)胆汁的采集:分别收集27例肝外胆管癌患者手术前、手术后第1天、手术后第7天的胆汁(术前胆汁通过经皮肝穿刺胆道引流后取得,术后第1天及第7天通过T型引流管取得),振荡混合均匀,于4℃冰箱中保存40 min,3 000 r/min(离心半径8.6 cm)离心15 min后取上清液500 μL于-80℃冰箱中保存待用。(2)血清的采集:清晨抽取空腹待抽检患者的肘静脉血大约3 mL,3 000 r/min(离心半径8.6 cm)离心5 min分离血清,分离的血清于-20℃冰箱中保存。
1.3 检测方法(1)血清CA19-9测定:使用CA19-9试剂盒(美国雅培公司)、免疫发光分析仪(美国雅培公司),采用微粒子酶免疫分析法(MEIA)对血清CA19-9进行测定。 (2) 差异代谢物筛选:取 100 μL胆汁上清液,加入甲醇400 μL和0.1 mg/mL的 L-2-氯苯丙氨酸50 μL,混匀,4℃下13 000 r/min (离心半径8.6 cm)离心15 min,取400 μL上清液真空干燥后,加入20 mg/mL甲氧胺吡啶溶液80 μL,震荡30 s,37℃下反应90 min,迅速加入含有1% (体积分数)三甲基氯硅烷(trimethylchlorosilane,TMCS)的双(三甲基硅烷基)三氟乙酰胺[bis(trimethylsily)trifluoroacetamide,BSTFA]衍生剂,70℃下反应1 h后,使用LECO Pegasus HT气相色谱质谱联用仪进行GC-MS分析。GC-MS分析条件:Agilent DN-5MS毛细管柱(30 m×250 μm×0.25 μm,J&W Scientific,Folsom,CA,USA);进样量1 μL;载气:氦气;前进样口吹扫流速:3 mL/min;流速:1 mL/min; 柱温:初始温度50℃保持1 min,以10℃/min升至330℃保持5 min,前进样口温度260℃,传输线温度280℃;离子源温度220℃;电离电压:-70 eV;扫描方式(全扫描):85~600 m/z;扫描速率:20 spectra/s;溶剂延迟:366 s。
将所得的GC-MS原始数据采用LECO公司的Chroma TOF4.3X 软件和LECO-Fiehn Rtx5数据库,进行峰定性和定量,使用内标标准化法处理导出的数据。将所得峰面积导入SIMCA13.0软件进行分析。首先采用主成分分析(principal components analysis,PCA)对数据进行总览,观察样本分布及异常值。为了判别组间差异,采用偏最小二乘法判别分析(partial least squares discriminate analysis,PLS-DA)对数据进行判别分析。为了对组间进行专属判别,进一步使用正交信号矫正技术(orthogonal signal correction,OSC),建立正交偏最小二乘法判 别分析(orthogonal partial least squares discriminate analysis,OPLS-DA)模型。最后根据相似度>700、VIP(variable importance in the projection)值>1、P值<0.05对代谢差异物进行鉴定。
1.4 纳入分析因素以下纳入危险因素分析:(1)术前因素:性别、年龄、血清总胆红素、血清白蛋白、血清丙氨酸氨基转移酶、血清碱性磷酸酶、血清γ-谷氨酰转移酶、血清总胆汁酸、血清CA19-9分级;(2)术中测量肿瘤大小;(3)术后TNM病理分期,围手术期胆汁代谢组学差异物质。应用SPSS19.0软件进行统计分析。计量资料以x±s 以及中位数表示。采用χ2检验或Fisher概率精确检验对危险因素进行分析,并采用双变量相关性分析确定各危险因素之间的相关性。检验水准(α)为0.05。
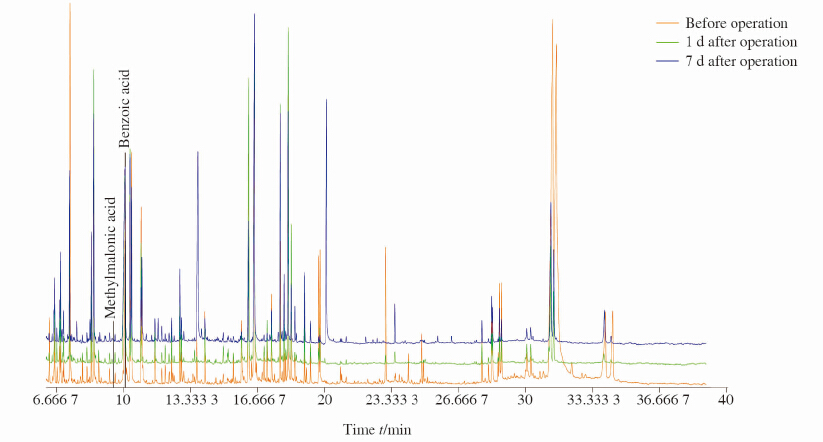
2 结 果 2.1 代谢组学谱图 对27例实验组肝外胆管癌患者手术前、手术后第1天、手术后第7天的胆汁样本进行GC-MS检测后,获得所有样本的总离子流色谱图(total ions chromatogram,TIC),其中各组1个代表性样本的TIC如图 1所示。
|
图 1 胆汁各组一个样本的总离子流色谱图 Fig 1 Bile total ion current profiles of one sample in each group using GC/MS |
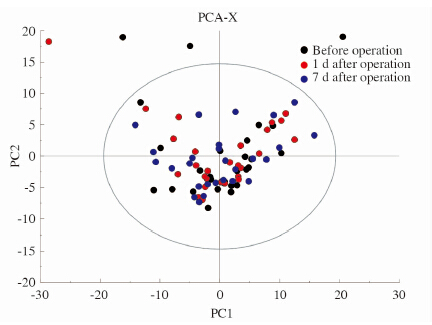
使用SIMCA13.0软件(Umetrics AB,Umea,Sweden)对归一化后的数据进行模式识别多变量分析,PCA反映组间离散程度的2D得分图如图 2所示。 大部分样本分布在95%置信区间的Hotelling T2 ellipse的椭圆形内,说明这3种样本的稳定性和可重复性较好。从得分图中可以看出,手术后第1天样本和手术后第7天样本有向左上角分离的趋势,手术前样本有向右下角分离的趋势,有些不明显的区分需要进行后续判别分析,这些结果可以说明手术前样本和手术后样本代谢模式存在差异。
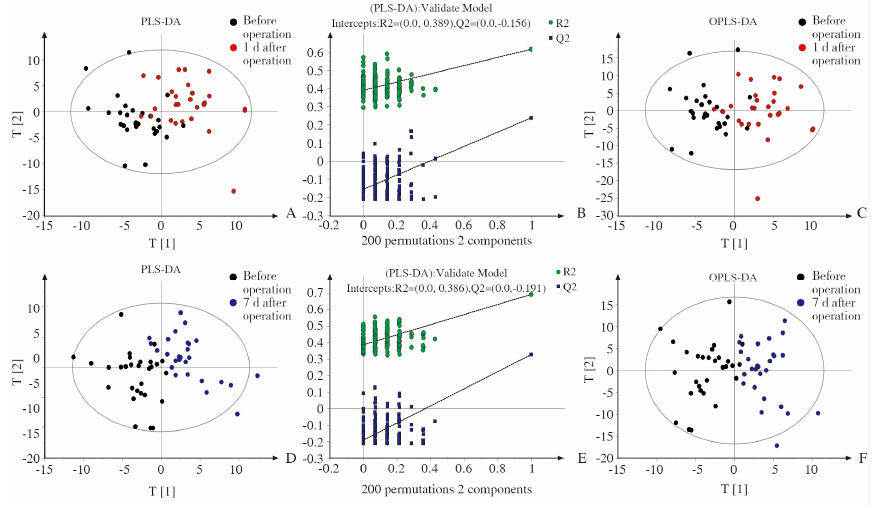
手术前样本和手术后第1天样本的PLS-DA 2D得分图如图 3A所示,置换检验结果如图 3B所示。从图中可以看出,手术前的27个样本点和手术后第1天的27个样本点几乎完全分离,手术前的样本点分散在左侧,手术后第1天的样本点分散在右侧,表明手术前和手术后第1天患者的对照谱有区别(置换检验截距R2=0.389,Q2=-0.156)。手术前组和手术后第7天组的PLS-DA 2D得分图如图 3D所示,可以看出,两个组的样本点在第一主成分t1和第二主成分t2构成的空间内能够很好地分离,表明两组的代谢模式存在差异(置换检验截距R2=0.386,Q2=-0.191)。
|
图 2 所有样品的PCA 2D得分图 Fig 2 PCA 2D score plot of the total samples |
手术前样本和手术后第1天样本、手术前样本和手术后7 d样本的OPLS-DA得分图分别如图 3C和图 3F所示。可以看出,手术前的样本点分散在左侧,手术后第1天和第7天的样本点分散在右侧,说明手术前样本和手术后样本的代谢模式存在明显差异,结果与PLS-DA判别分析结果一致。
|
图 3 模式识别分析 Fig 3 Pattern recognition analysis A,D:PLS-DA scores plot of samples 1 d and 7 d post-operation vs pre-operation,respectively; B,E:200 times permutation test of A and D,respectively; C,F:OPLS-DA scores plot of samples 1 d and 7 d post-operation vs pre-operation,respectively |
采用LECO公司的Chroma TOF4.3X 软件和LECO-Fiehn Rtx5数据库进行峰定性和定量,系统给出相似度来说明定性的精确度,当相似度> 700时,认为定性比较准确。多元变量统计模式识别后,利用OPLS-DA 模型第一主成分的VIP值(VIP>1),并结合student t 检验的P值(P<0.05)来确定差异性表达代谢物,结果见表 2、3。表中Peak为定性出的各物质名称,RT为保留时间,m/z值为物质特征离子的质核比,Mean peak area为各组归一化后峰面积的平均值,VIP值为差异物引起两组之间差异所占的权重[5],P值为student t检验的结果[6],差异倍数为两组之间的倍数关系[7]。对于检测物质出现同物质名称带有1,2,3…的情况,是因为对不同的衍生物命名时,根据保留指数来增加数字,如丝氨酸1、丝氨酸2、丝氨酸3[8]。通过以上方法对代谢物进行筛选,术后第1天与术前相比,胆汁内有5种代谢物显著升高,无代谢物显著降低;术后第7天与术前相比,胆汁内有3种代谢物显著升高,3种代谢物显著降低。以上两组差异代谢物中,有2种相同物质:苯甲酸(benzoic acid)和甲基丙二酸(methylmalonic acid)。苯甲酸术后第1天约是术前的1.87倍,术后第7天约是术前的2.00倍;甲基丙二酸术后第1天约是术前的1.46倍,术后第7天约是术前的2.31倍。
|
|
表 2 手术后第1天胆汁对比手术前胆汁的差异代谢物 Tab 2 Difference of the bile metabolite before operation and 1 d after operation |
|
|
表 3 手术后第7天胆汁对比手术前胆汁的差异代谢物 Tab 3 Difference of the bile metabolite before operation and 7 d after operation |
对27例接受外科根治性切除的肝外胆管癌患者出院后1年的情况进行随访,其中5例患者失访;获得随访的22例患者中,16例患者无肿瘤复发并健在;6例患者1年内出现复发,其中5例复发部位为肝内多发,1例肝脏内复发伴淋巴结转移。1年内死亡患者3例,因死亡病例数较少,没有进行术后1年内死亡相关因素分析。通过对术后1年内早期复发相关因素分析发现,苯甲酸在术后第7天较术前升高<2倍与术后1年内早期复发显著相关(P=0.04),术前年 龄≤60岁(P=0.006)、术前血清CA19-9≥200 U/mL (P=0.032)与术后1年内早期复发显著相关,性别、术前血清总胆红素、血清白蛋白等因素与术后1年内复发无显著相关(表 4)。采用双变量相关性分析提示,通过对苯甲酸在术后第7天较术前变化倍数与CA19-9分级(P=0.105)、术前年龄分级 (P=0.598)、术后TNM病理分期(P=0.472)进行双变量相关性分析,提示相关性均无统计学意义。
|
|
表 4 肝外胆管癌患者术后1年内复发相关因素分析 Tab 4 Recurrence factors analysis one year after cholangiocarcinoma surgery |
肝外胆管癌是一种常见的恶性肿瘤,早期诊断困难,主要的治疗方法是肝门部胆管癌根治术及胰十二指肠切除等大型肝胆外科专科手术,手术风险高,医疗资源消耗巨大,但整体预后差,肿瘤复发是影响预后的主要因素之一。现有的判断预后的血清学指标主要是血清CA19-9[9],但对于术前及术后血清CA19-9均为阴性的患者无有效的判断手段。如果能够早期明确术后早期复发的高危人群并进行干预治疗,将有助于改善患者的预后。
本研究利用代谢组学技术,筛选出胆汁中2种可能与肝外胆管癌行根治性切除预后相关的分子:苯甲酸和甲基丙二酸。通过肝外胆管癌患者术后1年内复发相关因素分析发现,手术后第7天苯甲酸升高≥2倍的患者1年内复发率明显低于升高<2倍的患者(P=0.04),而甲基丙二酸的术后变化水平与术后早期复发无显著相关。苯甲酸是一种弱酸,不仅能抑制糖异生及脂肪的合成,其结构在抑制多种酶活性方面也具有重要的作用[10]。研究表明,蜂胶乙醇提取物对金属蛋白酶活性具有较强的抑制作用,其主要含有肉桂酸、苯甲酸,因此,推测苯甲酸能够抑制金属蛋白酶的活性[11]。金属蛋白酶在胆管癌、食管癌等肿瘤的转移或侵袭中起着非常重要的作用[12, 13, 14]。基质金属蛋白酶9(matrix metalloprotein,MMP-9)是金属蛋白酶中的一种,主要来自于肿瘤间质间的成纤维细胞以及浸润的炎症细胞,在肝外胆管癌组织中的表达与活性明显高于非肿瘤胆管黏膜组织[14, 15]。另外,苯甲酸衍生物也具有抗癌作用,不仅能够促进结肠癌中细胞的凋亡,而且能够抑制肝细胞癌中癌细胞在肝内的扩散[16, 17]。因此,我们可以推测,手术后苯甲酸的含量升高,不仅抑制金属蛋白酶的活性,降低肿瘤的转移和浸润,而且苯甲酸形成的衍生物能够促进细胞的凋亡以及抑制癌细胞的扩散。由于苯甲酸属于胆汁代谢物,不受血液中其他因素的影响,在对疾病进行预后判断时可能更直接,尤其在血清CA19-9呈现阴性的情况下,可能起到一个很好的补充作用,提高判断预后的能力。
通过对肝外胆管癌患者术后1年内复发相关因素分析发现,术前年龄≤60岁、术前血清CA19-9≥200 U/mL也是术后1年内复发的高危因素。在本研究中,老年患者(术前年龄>60岁者)无一例复发,这可能与老年患者血管形成能力较差、肿瘤生长缓慢有关[18]。CA19-9是一种非特异性肿瘤抗原,血清CA19-9显著升高可见于胰腺癌、胆管癌、胃癌、肠癌患者[19, 20]。以往的研究资料显示,血清CA19-9显著升高与肝外胆管癌的复发相关[21]。本研究中术前CA19-9≥200 U/mL者(复发率为57.1%)高于CA19-9<200 U/mL者(复发率为13.3%),与以往研究相似。因此,术前血清CA19-9显著升高仍然是重要的参考标志物。
众多研究表明,TNM病理分期在癌症预后中具有重要作用。朱宏毅等[22]发现TNM病理分期为Ⅲ、Ⅳ期的患者术后生存时间均明显小于分期为Ⅰ、Ⅱ期的患者,表明分期较早的患者疾病预后较好。Guglielmi 等[23]指出TNM病理分期与肝内胆管癌切除术预后密切相关,TNM病理分期与死亡率呈正相关,分期越大,死亡率越高。在本研究中术后TNM病理分期与预后虽无统计学差异,但仔细分析数据,可以发现术后TNM病理Ⅰ、Ⅱ期共14例患者中有3例复发,复发率为21.4%。而术后TNM病理Ⅲ、Ⅳ期共8例患者中3例复发,复发率为37.5%。仍表现出术后TNM病理Ⅲ、Ⅳ期复发率较高的趋势。考虑到本研究纳入病例数较少,有待以后扩大样本量进一步探讨。
通过对苯甲酸在术后第7天较术前变化倍数与CA19-9分级、术前年龄分级、术后TNM病理分期进行双变量相关性分析,提示均无显著相关性(P>0.05),因此,笔者认为苯甲酸在术后第7天较术前升高<2倍可能是术后早期复发的一个独立危险因素。因本研究随访时间较短,目前仅为术后1年,可待术后3年、术后5年随访结果,再进一步明确苯甲酸手术前后变化与预后的相关性。
| [1] | Khan S A, Thomas H C, Davidson B R, Taylor-Robinson S D. Cholangiocarcinoma[J]. Lancet,2005,366:1303-1314. |
| [2] | Welzel T M, Graubard B I, El-Serag H B, Shaib Y H, Hsing A W, Davila J A, et al. Risk factors for intrahepatic and extrahepatic cholangiocarcinoma in the United States: a population-based case-control study[J]. Clin Gastroenterol Hepatol,2007,5:1221-1228. |
| [3] | Krokidis M, Fanelli F, Orgera G, Bezzi M, Passariello R, Hatzidakis A. Percutaneous treatment of malignant jaundice due to extrahepatic cholangiocarcinoma: covered Viabil stent versus uncovered Wallstents[J]. Cardiovasc Intervent Radiol,2010,33:97-106. |
| [4] | Smith R A, Bosonnet L, Ghaneh P, Raraty M, Sutton R, Campbell F, et al. Preoperative CA19-9 levels and lymph node ratio are independent predictors of survival in patients with resected pancreatic ductal adenocarcinoma[J]. Dig Surg,2008,25:226-232. |
| [5] | Li X, Xu Z, Lu X, Yang X, Yin P, Kong H, et al. Comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry for metabonomics: Biomarker discovery for diabetes mellitus[J]. Anal Chim Acta,2009, 633:257-262. |
| [6] | Benjamini Y, Hochberg Y. Controlling the false discovery rate:a practical and powerful approach to multiple testing[J]. J Roy Statist Soc Ser B,1995,57:289-300. |
| [7] | Nieman D C, Gillitt N, Jin F, Henson D A, Kennerly K, Shanely R A, et al. Chia seed supplementation and disease risk factors in overweight women:a metabolomics investigation[J]. J Altern Complement Med,2012,18:700-708. |
| [8] | Kind T, Wohlgemuth G, Lee do Y, Lu Y, Palazoglu M, Shahbaz S, et al. FiehnLib:mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry[J]. Anal Chem,2009,81:10038-10048. |
| [9] | Levy C, Lymp J, Angulo P, Gores G J, Larusso N, Lindor K D. The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis[J]. Dig Dis Sci,2005,50:1734-1740. |
| [10] | McCune S A, Durant P J, Flanders L E, Harris R A. Inhibition of hepatic gluconeogenesis and lipogenesis by benzoic acid, p-tert.-butylbenzoic acid, and a structurally related hypolipidemic agent SC-33459[J]. Arch Biochem Biophys,1982,214:124-133. |
| [11] | Jin U H, Chung T W, Kang S K, Suh S J, Kim J K, Chung K H, et al. Caffeic acid phenyl ester in propolis is a strong inhibitor of matrix metalloproteinase-9 and invasion inhibitor:isolation and identification[J]. Clin Chim Acta,2005,362(1-2):57-64. |
| [12] | Takahashi Y, Kitadai Y, Bucana C D, Cleary K R, Ellis L M. Expression of vascular endothelial growth factor and its receptor, KDR, correlates with vascularity, metastasis, and proliferation of human colon cancer[J]. Cancer Res,1995,55:3964-3968. |
| [13] | 朱争艳, 杜 智, 王毅军, 张 文, 孙保存. 原发性肝癌钙粘素 E 和基质金属蛋白酶检测及临床意义[J]. 世界华人消化杂志,2001,9:839-840. |
| [14] | 崔爱荣, 张建生, 刘围娜, 王俊灵, 张玉敏, 王恒树. COX-2 与 MMP-9 肝外胆管癌中的表达及其对预后的影响[J]. 河北医科大学学报,2008,29:547-549. |
| [15] | Tocchi A, Mazzoni G, Liotta G, Lepre L, Cassini D, Miccini M. Late development of bile duct cancer in patients who had biliary-enteric drainage for benign disease:a follow-up study of more than 1,000 patients[J]. Ann Surg,2001,234:210-214. |
| [16] | Sako T, Nakayama Y, Minagawa N, Inoue Y, Onitsuka K, Katsuki T, et al. 4-[3, 5-Bis (trimethylsilyl) benzamido] benzoic acid (TAC-101) induces apoptosis in colon cancer partially through the induction of Fas expression[J]. In Vivo,2005,19:125-132. |
| [17] | Murakami K, Sakukawa R, Ikeda T, Matsuura T, Hasumura S, Nagamori S, et al. Invasiveness of hepatocellular carcinoma cell lines:contribution of membrane-type 1 matrix metalloproteinase[J]. Neoplasia,1999,1:424-430. |
| [18] | Bliss J M, Ford D, Swerdlow A J, Armstrong B K, Cristofolini M, Elwood J M, et al. Risk of cutaneous melanoma associated with pigmentation characteristics and freckling:systematic overview of 10 case-control studies. The International Melanoma Analysis Group (IMAGE)[J]. Int J Cancer,1995,62:367-376. |
| [19] | Singh S, Tang S J, Sreenarasimhaiah J, Lara L F, Siddiqui A. The clinical utility and limitations of serum carbohydrate antigen (CA19-9) as a diagnostic tool for pancreatic cancer and cholangiocarcinoma[J]. Dig Dis Sci,2011,56:2491-2496. |
| [20] | Kodera Y, Yamamura Y, Torii A, Uesaka K, Hirai T, Yasui K, et al. The prognostic value of preoperative serum levels of CEA and CA19-9 in patients with gastric cancer[J]. Am J Gastroenterol,1996,91:49-53. |
| [21] | Singal A G, Rakoski M D, Salgia R, Pelletier S, Welling T, Fontana R, et al. The clinical presentation and prognostic factors for intrahepatic and extrahepatic cholangiocarcinoma in a tertiary care centre[J]. Aliment Pharmacol Ther,2010, 31:625-633. |
| [22] | 朱宏毅, 季 福, 李可为, 沈火剑. 肝门胆管癌预后的影响因素分析[J]. 肝胆胰外科杂志,2012,24:92-95. |
| [23] | Guglielmi A, Ruzzenente A, Campagnaro T, Pachera S, Valdegamberi A, Nicoli P, et al. Intrahepatic cholangiocarcinoma:prognostic factors after surgical resection[J]. World J Surg,2009,33:1247-1254. |
 2015, Vol. 36
2015, Vol. 36


