2. 第二军医大学药学院有机化学教研室, 上海 200433
2. Department of Organic Chemistry, College of Pharmacy, Second Military Medical University, Shanghai 200433, China
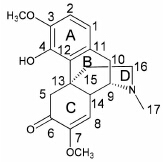
青藤碱 (sinomenine) 是从防己科植物青风藤及毛青藤的干燥藤茎中提取的异喹啉类生物碱,它由氢菲核及乙胺桥组成,结构与吗啡类似(图 1)。现代药理学研究表明,青藤碱具有抗炎、免疫抑制、镇痛、降压、抗心律失常等多种生物活性[1]。但是,青藤碱的生物半衰期较短,生物利用度低,临床治疗剂量偏大,通过促进组胺释放而致皮疹、胃肠道不适等不良反应[2],还有对酸碱和光热不稳定、易分解等缺点[3]。因此,探讨青藤碱修饰和构效关系对抗炎抗风湿药物研究有重要意义。
|
图 1 青藤碱的结构 Fig 1 Structure of sinomenine |
前期文献调研发现,对青藤碱的结构修饰主要集中在A环的1位、4位,C环的6位、7位[4, 5, 6]。D环为N杂环,结构较不稳定,潘毅等[7, 8]通过苄基保护C-4,在N位分别合成了一类N-烃基和N-磺酰基青藤碱衍生物,但未见其活性报道。
1,2,3-三氮唑作为潜在的药效团,具有抗菌[9]、抗真菌[10]和抗HIV[11]等活性。尽管1,2,3-三氮唑不存在于天然产物中,但该结构在人体代谢过程中极其稳定。文献报道1,4位取代的三氮唑的强偶极矩可使其作为弱氢键供体,N-2、N-3又可作为氢键受体[12]。研究结果表明,三氮唑结构的偶极矩及氢键效应可增强与生物分子靶点的亲和力并改善溶解度[13]。由于青藤碱有生物半衰期短、生物利用度低等缺点,为增强其体内稳定性,提高生物利用度,本课题组选择对青藤碱N位进行结构优化。 1,2,3-三唑环是酰胺键的电子等排体,在代谢转化、氧化还原及酸碱条件下都具有相当强的稳定性,设想三唑环的引入能延长其体内代谢过程,并能增强化合物与靶酶的相互作用。本课题组通过溴化氰脱除N位上的17-甲基,然后在氮原子上引入各种苄基取代的1,2,3-三唑环,以期能增强活性,延长其体内代谢过程。 1 试剂、菌株和仪器
本实验合成所用试剂均为国药集团化学试剂有限公司或上海泰坦科技股份有限公司化学纯或分析纯试剂,柱层析硅胶为青岛海洋化工有限公司生产。核磁共振氢谱用Bruker AC-300P核磁共振仪测定,CDCl3为溶剂,TMS为内标;LC-MS采用安捷伦1100系列。活性测试所用RPMI 1640培养基和脂多糖均为Sigma产品;所用细胞株RAW264.7购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。 2 方法和结果
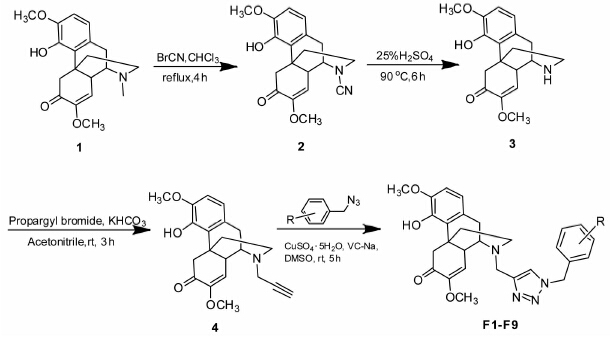
在设计路线时,我们的第一步是脱除甲基的反应。文献[14, 15]报道,氮甲基的脱除所用试剂为氯甲酸-1-氯乙酯。按照文献,我们以青藤碱为原料,以氯仿为反应溶剂,加热回流6 h,将产物在甲醇中再加热回流4 h,但该方法产率只有13%。后来通过检索文献[16, 17],我们选用溴化氰来脱甲基,其产率可达40%左右。脱甲基中间体进行亲核取代反应,再通过Click Reaction在青藤碱中间体上引入取代三氮唑结构[18],具体的合成路线见图 2,目标化合物的理化数据见表 1。
|
图 2 目标化合物的合成路线 Fig 2 Synthesis route of the target compounds rt: Room temprature; DMSO: Dimethyl sulfoxide |
|
|
表 1 目标化合物的物理数据 Tab 1 Physical characteristics of title compounds |
将上述未经纯化的17-脱甲基-17-氰基青藤碱 (2) 在25%硫酸溶液70 mL中加热回流6 h,反应完毕,饱和碳酸钠水溶液中和并调节pH为9,氯仿300 mL×3萃取,合并氯仿层,无水硫酸钠干燥,过滤,蒸除溶剂,硅胶柱层析得棕色粉末17-脱甲基青藤碱(3) 2.6 g,产率43%。 m.p. 163.2~164.8℃; 1HNMR (CDCl3): 6.51~6.64 (2H,d,J=8.4 Hz,H-1,H-2),5.46 (1H,s,H-8),2.45~4.41 (2H,dd,J=15.6 Hz,H-5),3.83 (3H,s,3-OCH3),3.53 (3H,s,7-OCH3),2.95~3.02 (2H,m,H-10),2.74-2.87 (2H,m,H-16),2.36~2.46 (1H,m,H-9),2.15 (1H,m,H-14),1.91~1.94 (2H,m,H-15)。 2.3 17-脱甲基-17-炔丙基青藤碱(4)的制备
将17-脱甲基青藤碱 (3) 2.6 g (0.008 mol)、碳酸氢钾0.8 g (0.008 mol) 加入三颈瓶,量取200 mL乙腈加入,加热至回流。将溴丙炔2.8 g (0.024 mol) 溶于100 mL乙腈并滴入上述反应液,1 h内滴加完毕,反应3 h。反应完毕,过滤,蒸除溶剂,硅胶柱层析得棕黄色粉末17-脱甲基-17-炔丙基青藤碱 (4) 1.8 g,产率65%。 m.p. 165.4~167.2℃; 1HNMR (CDCl3): 6.51~6.65 (2H,d,J=8.4 Hz,H-1,H-2),5.48 (1H,s,H-8),2.43~4.38 (2H,dd,J=15.6 Hz,H-5),3.81 (3H,s,3-OCH3),3.51 (3H,s,7-OCH3),3.41~3.43 (2H,m,H-17),2.98~3.05 (2H,m,H-10),2.75~2.87 (2H,m,H-16),2.37~2.48 (1H,m,H-9),2.31 (1H,s,H-19),2.17 (1H,m,H-14),1.92~1.96 (2H,m,H-15)。 2.4 17-脱甲基-17-(1-间氯苄基-1,2,3-三唑-4-甲基)青藤碱(F3)的制备
称取间氯溴苄73 mg (0.35 mmol)、叠氮钠24 mg (0.36 mmol) 加入茄形瓶中,量取10 mL 二甲基亚砜,室温磁力搅拌反应过夜。次日,称取17-脱甲基-17-丙炔基青藤碱 (4) 100 mg (0.27 mmol)、抗坏血酸钠14 mg,五水硫酸铜20 mg ,用1 mL水溶解,并迅速加入到反应茄形瓶中,继续反应5 h。反应完毕,用100 mL 氯仿将反应液转入至分液漏斗中,然后分别用氨水和水洗60 mL×3,无水硫酸钠干燥氯仿层,过滤,蒸除溶剂,硅胶柱层析得棕黄色粉末17-脱甲基-17-(1-间氯苄基-1,2,3-三唑-4-甲基)青藤碱 (F3) 107 mg,产率76%。化合物 F1、F2、F4~F9 均以不同的取代溴苄为原料按此法合成,产物均为棕黄色粉末。 2.5 体外抑制核因子(NF)-κB转录活性实验[19]
采用报告基因法来测定目标化合物对LPS诱导RAW264.7细胞NF-κB转录活性的影响,最后获得的细胞裂解液按promea 双报告基因检测试剂盒说明书,用GloMax TM 20/20n Luminometry System 荧光检测仪测定萤火虫荧光素酶以及内参海参荧光素酶含量,计算两者比值作为判断终点,测试结果见表 2。所合成的目标化合物体外对NF-κB转染均具有一定的抑制作用,但活性较青藤碱有所下降。
|
|
表 2 标化合物对脂多糖诱导小鼠巨噬细胞核因子NF-κB转录活性的影响 Tab 2 Effects of target compounds on NF-κB transcriptional activity in LPS-stimulated RAW264.7 cells |
虽然青藤碱衍生物的合成研究较多,但其构效关系研究并不系统。我们对青藤碱N原子进行修饰,以期获得活性较好的衍生物,并丰富其构效关系研究。
本课题以一种高效的方法设计合成了一类青藤碱衍生物。我们选用溴化氰脱除N上的甲基,收率较使用传统的氯甲酸-1-氯乙酯有所提高。由于青藤碱结构中含有酚羟基,酚羟基也可以与溴化氰发生亲核取代反应生成副产物青藤碱-4-氰酸酯;因此在设计时我们选用了两种方法,一种将酚羟基进行苄基保护,一种是未保护直接进行反应,实验结果显示两种方法的产率相当,因此为了避免保护、脱保护以及后处理的烦琐步骤,我们未对青藤碱4-酚羟基进行保护。本实验通过Click Reaction 将取代苄基引入目标化合物,该反应收率高,且环保,易于处理,活性测试结果表明所合成的目标化合物活性较青藤碱差,这可能是由于N原子处在靶分子活性腔的狭窄位置,大基团或者长链的引入阻碍了目标化合物与靶点的有效结合和作用,最终导致青藤碱衍生物抗炎活性下降。由于化合物数量有限,该类化合物抗炎活性与侧链取代基的构效关系有待进一步研究。
| [1] | Liu L, Buchner E, Beitze D, Schmidt-Weber C B, Kaever V, Emmrich F, et al. Amelioration of rat experimental arthritides by treatment with the alkaloid sinomenine[J]. Int J Immunopharmacol, 1996, 18:529-543. |
| [2] | 李 乐, 张彩玲, 宋必卫. 青藤碱的药理研究与临床应用[J]. 中药新药与临床药理, 2006, 17: 310-313. |
| [3] | 傅绍萱, 张士善, 李蕴山, 王耐勤. 青藤碱的药理作用Ⅱ.毒性及一般药理[J]. 药学学报, 1963, 10: 673-675. |
| [4] | 林红卫, 李 勇, 朱士龙, 陈迪钊, 欧阳玉祝. 4-乙酰氧基-5-乙酰基-青藤碱的合成与表征[J]. 怀化学院学报, 2013, 32: 31-33. |
| [5] | 林红卫, 李 勇, 朱士龙, 陈迪钊, 欧阳玉祝. 取代苯偶氮基-青藤碱衍生物的合成与表征[J]. 化学研究与应用, 2013, 25: 1575-1579. |
| [6] | 叶仙蓉, 颜克序, 吴克美, 冯孝章, 黄宇明, 仇 萍. 青藤碱衍生物的合成及其抗炎镇痛活性[J]. 药学学报, 2004, 39:180-183. |
| [7] | 潘 毅, 李玉峰, 卜清明, 黄乐群, 王 捷, 李建新. 一类N-烃基青藤碱及其制备方法:中国,1785976A[P]. 2006-06-14. |
| [8] | 潘 毅, 李玉峰, 卜清明, 黄乐群, 王 捷, 李建新. 一类17-磺酰基青藤碱及其制备方法:中国,1785977A[P]. 2006-06-14. |
| [9] | Phillips O A, Udo E E, Abdel-Hamid M E, Varghese R. Synthesis and antibacterial activity of novel 5-(4-methyl-1H-1,2,3-triazole) methyl oxazolidinones[J]. Eur J Med Chem, 2009, 44: 3217-3227. |
| [10] | Aher N G, Pore V S, Mishra N N, Kumar A, Shukla P K, Sharma A, et al. Synthesis and antifungal activity of 1,2,3-triazole containing fluconazole analogues[J]. Bioorg Med Chem Lett, 2009, 19: 759-763. |
| [11] | Giffin M J, Heaslet H, Brik A, Lin Y C, Cauvi G, Wong C H, et al. A copper(Ⅰ)-catalyzed 1,2,3-triazole azide-alkyne click compound is a potent inhibitor of a multidrug-resistant HIV-1 protease variant[J]. J Med Chem, 2008,51:6263-6270. |
| [12] | Wei J J, Jin L, Wan K, Zhou C H. Synthesis of novel d-glucose-derived benzyl and alkyl 1,2,3-triazoles as potential antifungal and antibacterial agents[J].Bull Korean Chem Soc,2011,32:229-238. |
| [13] | Collin M P, Hobbie S N, Böttger E C, Andrea Vasella A. Synthesis and evaluation of S- and C(1)-substituted analogues of lincomycin[J]. Helv Chim Acta, 2009, 92: 230-266. |
| [14] | Schmidhammer H, Smith C F, Erlach D, Koch M, Krassnig R, Schwetz W, et al. Synthesis and biological evaluation of 14-alkoxymorphinans. 3. Extensive study on cyprodime-related compounds[J]. J Med Chem, 1990, 33: 1200-1206. |
| [15] | Fujii H, Imaide S, Watanabe A, Yoza K, Nakajima M, Nakao K, et al. A double decarboxylation reaction of an oxazolidinone and carboxylic acid: its application to the synthesis of a new opioid lead compound[J]. J Org Chem, 2010, 75: 995-998. |
| [16] | Kaiser C, Dandridge P A, Garvey E, Hahn R A, Sarau H M, Setler P E, et al. Absolute stereochemistry and dopaminergic activity of enantiomers of 2,3,4,5-tetrahydro-7,8-dihydroxy-1-phenyl-1H-3-benzazepine[J]. J Med Chem, 1982, 25: 697-703. |
| [17] | Manton J, Mikklos S, Hasztafi S, Makleitit S. Synthesis of N-substituted 7β-diprenorphine derivatives[J]. Synthetic Communications, 1995, 25: 829-848. |
| [18] | Zhang X, Hsung R P, Li H. A triazole-templated ring-closing metathesis for constructing novel fused and bridged triazoles[J]. Chem Commun(Camb),2007(23): 2420-2422. |
| [19] | Zhao Y, Li J, Yu K, Liu Y, Chen X. Sinomenine inhibits maturation of monocyte-derived dendritic cells through blocking activation of NF-kappa B[J]. Int Immunopharmacol, 2007, 7: 637-645. |
 2015, Vol. 36
2015, Vol. 36


