2. 解放军411医院全军口腔疾病诊治中心, 上海 200081;
3. 解放军411医院检验科, 上海 200081
2. PLA Diagnosis & Treatment Center of Oral Diseases, No.411 Hospital of PLA, Shanghai 200081, China;
3. Department of Clinical Laboratory, No.411 Hospital of PLA, Shanghai 200081, China
自20世纪90年代Marx等[1]发现富血小板血浆(platelet-rich plasma,PRP)中含有多种生长因子,并将PRP复合自体骨移植应用于下颌骨缺损修复以来,PRP在骨缺损修复中的效果已经被国内外大部分学者所认可。但对于PRP的应用研究还局限于自体血液的新鲜采制和即刻应用,保存时间和空间上的限制。本研究通过对比低温冷冻PRP和新鲜PRP在兔颅骨缺损修复中的效果,探讨低温冷冻保存PRP的可行性。
1 材料和方法 1.1 实验动物及试剂体质量为2.5kg健康新西兰雄性大白兔由海军医学研究所动物中心提供,动物许可证号:SCXK(沪)2010-0029。大容量低温离心机(KH120,湖南湘仪实验室仪器有限公司),-80℃低温冰箱(DW-80W255,中国海尔公司),全自动血细胞计数仪(XT-1800I,日本SYSMEX公司),7 mm环形取骨钻(瑞士STRAUMANN公司),羟基磷灰石/磷酸三钙复合体(HAP/TCP)为法国VAULXENVELIN公司产品,牛凝血酶(美国Sigma公司),二甲亚砜(dimethyl sulfoxide,DMSO)及无水氯化钙为国药集团上海医疗器械有限公司产品,胶原膜(Bio-Gide,美国欧司海斯公司)。
1.2 PRP凝胶制备每只兔子抽取10 mL静脉血,用0.5%枸橼酸钠抗凝后进行血小板计数;采用两次法离心,第1次200×g离心10 min后吸取全部上清液至交界面下3 mm再进行第2次离心(1 200×g离心10 min),吸取上3/4上清液丢弃,余下液体混匀,即为PRP(约1 mL,再次进行血小板计数,浓缩倍数均达到4倍以上,符合PRP要求[2]);每份PRP加入终浓度为5%的DMSO 0.05 mL后,放入-80℃的冰箱保存。30 d后,在制备动物颅骨缺损模型前,由同一人在同一时间再次用同样的方法采血制备新鲜PRP,并将低温冷冻PRP取出后水浴复温至37℃待用。使用前,每份自体PRP分别按照10∶1的比例加入牛凝血酶和钙剂的混合液(1 000 U牛凝血酶加人1 mL10%氯化钙制备)0.1 mL激活,获得PRP凝胶。
1.3 实验设计将15大白兔的颅顶沿中线自上而下制备3个颅骨缺损处,并分别填入低温冷冻自体PRP凝胶+ HAP/TCP(实验孔),生理盐水+ HAP/TCP(空白孔)和新鲜自体PRP凝胶+ HAP/TCP复合体(对照孔)。于术后4周、8周、12周时各处死5只,取材后先用肉眼观察成骨情况,再进行X线检查,最后采用CT扫描测定成骨区域的CT值,并进行统计学分析;最后将甲醛固定后的样本置于10%乙二胺四乙酸(EDTA)溶液中脱钙,石蜡包埋、制备5 μm厚的切片,常规H-E染色后光镜下观察成骨情况。
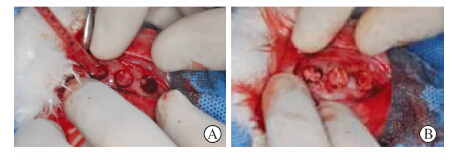
1.4 兔颅骨缺损制备及修复戊巴比妥钠(30 mg/kg) 经耳缘静脉注射全身麻醉后,自头顶两眼内眦连线中点前后各3 cm范围备皮,常规消毒铺巾,做垂直于两眼内眦连线中点约5 cm的纵行切口,暴露皮下组织和肌层直达骨膜,分离骨膜,暴露颅顶,沿颅顶中线用取骨钻制备3个直径7 mm、间距3 mm的圆形全层骨缺损,同时确保硬脑膜完整;按照实验设计,3个缺损孔内分别填入低温冷冻自体PRP凝胶+HAP/TCP、生理盐水+ HAP/TCP和新鲜自体PRP凝胶+ HAP/TCP,充填物与骨面齐平,表面覆盖胶原膜(图 1),关闭切口,术后肌注青霉素80万U,1次/d,共3 d。
|
图 1 兔颅骨缺损制备与修复 Fig 1 Design and repair of calvarial bone defects in rabbits A: Three defect holes were designed on calvarial bone;B:Fillings flushed bone surface from left to right: the experimental hole,the blank hole,and the control hole |
采用SPSS 10.0统计软件进行统计分析,各时间点及各孔间比较采用配对t检验,检验水准(α)为0.05。
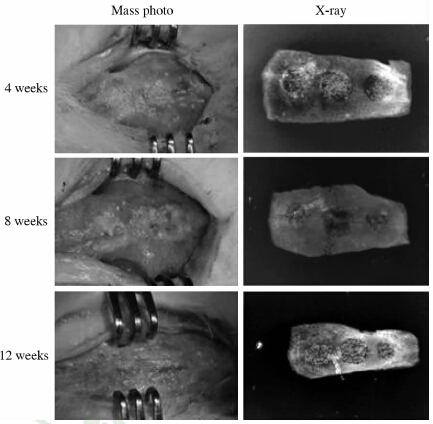
2 结 果 2.1 肉眼观察及X线检查术后7 d拆线,所有动物软组织愈合良好,未见明显炎症反应。 术后4周:3个缺损孔内均未见明显的新鲜骨质生成,缺损边界清晰未见明显缩小;X线见所有缺损边界清晰锐利,HAP/TCP复合体颗粒清晰,颗粒间未见高密度影像。术后8周:所有缺损区均见有新鲜骨质生成,实验孔和对照孔均边界不清,空白孔缺损边界仍清晰可见;X线见缺损的范围有所缩小,特别是实验孔和对照孔的缺损范围缩小明显,且边界不清,实验孔和对照孔的缺损区密度均高于空白孔。术后12周:各孔的缺损区域基本修复,颜色、外观与周围正常骨组织的区别不大;X线:无明显的骨缺损边界影像,实验孔和对照孔密度均匀,与周围正常骨组织区别不大,空白孔中央密度相对较低(图 2)。
|
图 2 不同时间点三孔的肉眼观察及X线检查结果 Fig 2 Mass photos and X-ray images of the repaired holes at different time points From left to right: the experimental hole,the blank hole,the control hole in each piceure |
从表 1所列数据可以看出,随着修复时间的延长,3个骨缺损孔内新生骨CT值有不断增加的趋势,各时间组的组间差异均有统计学意义(P<0.05或P<0.01);同一时间点,3个缺损孔的成骨情况也有不同程度的差异,术后4周及8周时,实验孔与对照孔比较,CT值差异均无统计学意义;但实验孔、对照孔CT值均明显高于空白孔,差异有统计学意义(P<0.01);术后12周,实验孔、空白孔、对照孔的骨密度均接近周围正常骨组织,3孔间的CT值差异无统计学意义。
|
|
表 1 各组、各孔骨缺损修复后CT值比较 Tab 1 CT values of holes of repaired calvarial bone defects |
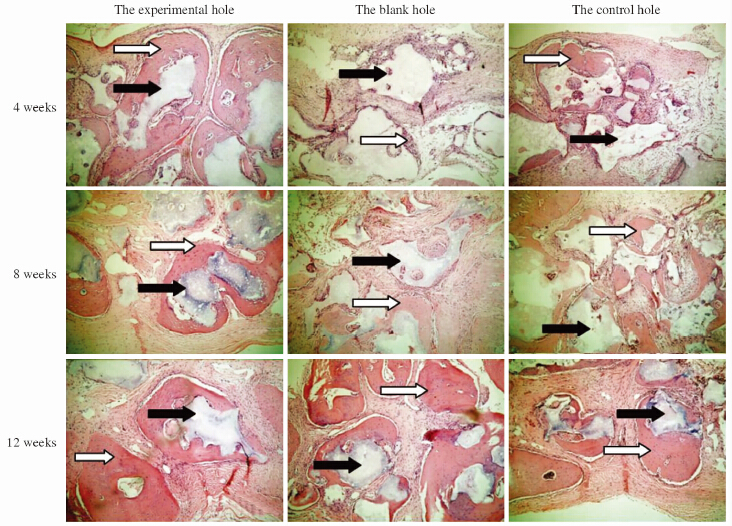
术后4周:各孔均可见有类骨组织及骨小梁形成,实验孔和对照孔明显比空白孔多;术后8周:各孔形成的骨组织明显增多,HAP/TCP复合物开始降解吸收,实验孔和对照孔新生骨小粱粗大、致密,且数量比空白孔多;术后12周:各组新生骨均趋于成熟,HAP/TCP复合物降解明显,但仍可见残余颗粒,新生骨结构与周围颅骨相仿,骨小梁粗大,并可见层板状骨(图 3)。
|
图 3 3个时间点各孔的组织学观察(H-E染色) Fig 3 Histological observation of holes at 3 different time points(H-E staining) The black arrows indicated HAP/TCP; the white arrows indicated regenerated bone. Original magnification: ×200 |
PRP是通过血液分离技术而得到的血小板浓集物,血小板浓度约为体内血小板浓度的2.05~11倍[3],激活后能释放高浓度的生长因子,主要包括血小板源性生长因子(platelet-derived growth factor,PDGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、类胰岛素样生长因子(insulin-like growth factor,IGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等[4],这些生长因子在细胞增殖、血管和组织再生中发挥重要作用,具有促进骨组织和软组织生长的作用[1, 5, 6, 7]。随着人们对PRP在软组织和骨组织愈合过程中作用认识的深入,相关PRP的临床应用研究也越来越多,尤其是在口腔临床医学方面[8],几乎涉及了包括口腔种植、齿槽外科、颌面外科、牙周手术、牙髓保存[9]等各个领域。目前PRP的使用仍然局限于自体血采集制备和即刻应用,患者在采血后,PRP必须立刻制备和用于术区,这样就有了空间和时间的限制,并且有些患者需要制备的PRP的量比较大,需要采血量多,不适合大量采血后立刻手术,因此需要有长期有效保存PRP的方法。有研究发现,血小板在低于20℃时会发生显著的改变[10],例如血小板在4℃环境中储存时,活性很快下降,6 h后还有约40%的活性,12 h后活性仅剩20%[11]。在血小板保存研究方面,有两种保存方法得到了公认,即22℃室温保存和深低温保存。美国食品与药品监督管理局规定,22℃室温条件下,血小板的储存时间为3~5 d,过期应予以废弃。而深低温条件下保存的血小板有效期可以长达1~3年,且仍具有良好的临床灌输止血效果[12]。
兔是骨缺损修复研究的常用动物,并且颅骨的成骨方式和结构与颌骨相似,可以作为检测颌骨缺损修复效果的替代部位[13, 14],因此,本研究采用兔颅骨缺损为动物模型。在PRP制备过程中,因为血小板的数量每天都会有6%~10%的波动[15],为了减少误差,本研究中每个动物的两次采血和血小板计数均在1 d中同一个时间点由同一人操作完成。在低温冷冻保存PRP时,为避免由于血小板在低温保存过程中因血小板膜的损伤而影响其复温后的活性,我们加入了终浓度为5%的血小板低温保护剂DMSO[16]。DMSO除了对血小板有保护作用外,低浓度的DMSO对人体不仅没有不良作用,并且有一定的抑菌效果[17]。
本研究结果表明,低温冷冻保存的PRP在复温后的活性与新鲜PRP活性相同,激活后同样可以具有促进骨组织生长的作用。本实验中采用的植入物HAP/TCP是目前常用的无机骨组织替代材料,具有骨传导性、无抗原性、无毒性,植入后作为支架和桥梁,可起引导和支撑作用,供周围有活性的血管肉芽组织长入及新骨组织的沉积。骨缺损的自我修复是一个连续的复杂过程 ,PRP促进骨缺损修复的机制还不明确,但大部分学者认为是PRP中血小板激活后释放的多种生长因子共同作用的结果,特别是PDGF和TGF-β[18]。PDGF可以促进骨髓基质干细胞和内皮细胞的有丝分裂,增加成骨细胞数量,促进移植区的毛细血管生长。TGF-β可促进成纤维细胞和成骨前体细胞的有丝分裂,促进成骨细胞内骨基质和成纤维细胞内胶原基质的沉积,有利于毛细血管的生成[19]。PDGF还能趋化、募集、激活巨噬细胞,在血小板释放的生长因子作用消失以后,由募集来的巨噬细胞继续分泌巨噬细胞源性生长因子和血管生长因子参与骨修复的过程。本研究结果表明,PRP促进骨缺损修复的作用在术后4周时已经开始显现,术后8周时更加明显,并且低温冷冻保存的PRP和新鲜PRP表现为具有相同的早期促进骨修复的作用,为今后建立PRP储存库提供了理论依据。本研究还发现,术后12周时,实验孔、空白孔、对照孔的新骨CT值之间的差异无统计学意义,证实了一些学者认为的PRP在骨修复早期起到促进作用,而在后期并无明显优势的观点[20]。我国每年有500万左右无偿献血者捐献的血小板没有被分离保存而被白白浪费[21],如果能在采血的同时,制备PRP,建立低温个人PRP储存库,将有利于骨缺损患者尽早恢复形态和功能的需求,并且有可能在战创伤救治、重大灾难救援过程中发挥作用。另外,随着国家战略血库建设的完善,免疫学的发展,以及同种异体PRP应用研究的深入[22],建立低温PRP储存库将具有重要的意义。
| [1] | Marx R E, Carlson E R, Eichstaedt R M, Schimmele S R, Strauss J E, Georgeff K R.Platelet-rich plasma: Growth factor enhancement for bone grafts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85:638-646. |
| [2] | Dugrillon A, Eichler H, Kern S, Klüter H.Autologous concentrated platelet-rich plasma (cPRP) for local application in bone regeneration[J].Int J Oral Maxillofac Surg,2002,31:615-619. |
| [3] | Okuda K, Kawase T, Momose M, Murata M, Saito Y, Suzuki H, et al.Platelet-rich plasma contains high levels of platelet-derived growth factor and transforming growth factor-beta and modulates the proliferation of periodontally related cells in vitro[J].J Periodontol,2003,74:849-857. |
| [4] | Schmitz J P, Hollinger J O.The biology of platelet-rich plasma[J].J Oral Maxillofac Surg,2001,59:1119-1121. |
| [5] | Anitua E.Plasma rich in growth factors: preliminary results of use in the preparation of future sites for implants[J].Int J Oral Maxillofac Implants,1999,14:529-535. |
| [6] | Kim S G, Chung C H, Kim Y K, Park J C, Lim S C.Use of particulate dentin-plaster of Paris combination with/without platelet-rich plasma in the treatment of bone defects around implants[J].Int J Oral Maxillofac Implants,2002,17:86-94. |
| [7] | Robiony M, Polini F, Costa F, Politi M.Osteogenesis distraction and platelet-rich plasma for bone restoration of the severely atrophic mandible: preliminary results[J].J Oral Maxillofac Surg,2002,60:630-635. |
| [8] | 吕汝举,刘美静. 富血小板血浆(PRP)治疗技术及应用[J]. 中国医疗器械信息,2013,10:50-55. |
| [9] | Gerard D, Carlson E R, Gotcher J E, Jacobs M.Effects of platelet-rich plasma on the healing of autologous bone grafted mandibular defects in dogs[J].J Oral Maxillofac Surg,2006,64:443-451. |
| [10] | Holstein J H, Becker S C, Fiedler M, Garcia P, Histing T, Klein M, et al.Intravital microscopic studies of angiogenesis during bone defect healing in mice calvaria[J].Injury,2011,42:765-771. |
| [11] | 刘景汉, 车 辑. 血小板保存[J]. 中国输血杂志, 2008, 21: 241-242. |
| [12] | 刘景汉, 欧阳锡林, 庄 远, 李 卉, 孙桂香, 陈麟凤,等.-80℃ 长期保存血小板的可行性研究[J]. 中国输血杂志, 2008,21: 243-245. |
| [13] | 周 芳,李 静,余 磊,廖 华,欧阳钧. 兔桡骨临界骨缺损模型的制备[J]. 中国组织工程研究与临床康复,2011, 15:9385-9388. |
| [14] | 李 丹. 速即纱(Surgicel)修复兔颅骨缺损的实验研究[D]. 沈阳:中国医科大学,2012. |
| [15] | 刘静静,刘巧玲. 血小板计数参考值调查及生理性波动的观察[J]. 中原医刊,2002,29:59-60. |
| [16] | 龚正明, 王跃华. 血细胞冰冻保护剂二甲基亚砜除热原方法考察[J]. 中国输血杂志,2000,13: 98-99. |
| [17] | Camargo P M, Lekovic V, Weinlaender M, Divnic-Resnik T, Pavlovic M, Kenney E B. A surgical reentry study on the influence of platelet-rich plasma in enhancing the regenerative effects of bovine porous bone mineral and guided tissue regeneration in the treatment of intrabony defects in humans[J].J Periodontol,2009,80:915-923. |
| [18] | 罗 涛,李 放,张 宁. 不同抗凝剂和激活剂联合应用对富血小板血浆凝胶释放生长因子影响的比较[J]. 中国组织工程研究,2012, 16:2893-2897. |
| [19] | 耿秋华,郑健生. 富血小板血浆所含相关因子促血管生成作用的研究进展[J]. 中华医学美学美容杂志,2013,19:394-396. |
| [20] | Pradeep A R, Shetty S K, Garg G, Pai S.Clinical effectiveness of autologous platelet-rich plasma and Peptide-enhanced bone graft in the treatment of intrabony defects[J].J Periodontol,2009,80:62-71. |
| [21] | 刘玉英,欧阳锡林,刘景汉. 富含血小板血浆冰冻保存及保存效果的研究[J]. 第三军医大学学报,2001,23:1455-1456. |
| [22] | Zhang Z Y, Huang A W, Fan J J, Wei K, Jin D, Chen B,et al.The potential use of allogeneic platelet-rich plasma for large bone defect treatment: immunogenicity and defect healing efficacy[J].Cell Transplant,2013,22:175-187. |
 2015, Vol. 36
2015, Vol. 36


