2. 上海市黄浦区中心医院病理科, 上海 200002
2. Department of Pathology, Central Hospital of Huangpu District, Shanghai 20002, China
乳腺癌是女性最常见的恶性肿瘤之一[1],化疗是乳腺癌重要的治疗手段,然而化疗过程乳腺癌容易对药物产生耐受,严重影响了乳腺癌化疗的效果。随着近年来对肿瘤分子生物学和基因功能学研究的深入,人们逐渐认识到某些肿瘤产生耐药的内在原因。因此,寻找调控乳腺癌耐药的关键基因,明确其在乳腺癌耐药机制产生过程中的病理机制,是乳腺癌治疗领域重要的研究方向。
近期有关UbcH10的研究表明,UbcH10与多种恶性肿瘤的发生、发展有着明显的相关性[2, 3, 4]。 Perrotta等[5]通过免疫检测发现,UbcH10在肺癌中高表达,其可以作为肿瘤恶性分级的标志物,UbcH10还可以作为膀胱癌手术治疗的预后观测指标[6],通过RNAi靶向沉默UbcH10,在体内体外研究中都取得了良好的肠癌抑制效果[7]。然而UbcH10与肿瘤耐药的相关研究报道较少,Zhao等[8]在肺癌相关研究中发现,UbcH10在肺癌中表达异常,可以作为肺癌分级的标志基因,通过抑制UbcH10基因的表达可以增强肺癌细胞对化疗的敏感性,而在乳腺癌的耐药相关基因研究中,目前未见与UbcH10相关的报道。
本研究拟将UbcH10基因沉默后的乳腺癌耐药细胞株MCF-7/ADR接种裸于鼠皮下,制作体内肿瘤模型,同时,通过尾静脉注射给予多柔比星处理,最终通过肿瘤体积变化观察UbcH10基因干预对多柔比星抑制耐药乳腺癌细胞株成瘤作用的影响;同时,检测瘤体中耐药相关蛋白BCL-2的表达情况,寻找UbcH10与乳腺癌耐药之间可能存在的调控关系。 1 材料和方法 1.1 材 料
MCF-7细胞购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,MCF-7/ADR为第二军医大学长征医院中心实验室诱导建立;0.25%胰蛋白酶、胎牛血清、DMEM培养基和TRIzol均购于Invitrogen公司。慢病毒实验系统为Systermbio公司产品;反转录试剂盒及荧光定量试剂盒等购于大连宝生物工程有限公司。细胞培养箱为日本三洋公司产品,定量PCR仪均为TaKaRa公司产品;多柔比星购于Sigma公司。蛋白一抗及二抗购于Santa Cruz公司。蛋白提取、定量试剂盒及ECL发光试剂盒均为Pierce公司产品,垂直电泳及转膜设备购于Bio-Rad公司,实验动物购于上海斯莱克动物实验有限公司。 1.2 MCF-7/ADR-UbcH10-RNAi稳定表达细胞株的建立
针对UbcH10的siRNA序列(5′-GACCTG AGG TAT AAG CTC T-3′)为课题组前期筛选的有效序列,NC序列(5′-GAA GCC AGA TCC AGC TTC C-3′)也经过前期实验证实其对UbcH10基因表达不产生影响。根据siRNA序列,设计并合成互补的shRNA序列,shRNA双链经退火后克隆至pshRNA表达载体,重组克隆经序列分析后,扩增转化细菌并使用无内毒素质粒抽提试剂盒进行不含内毒素质粒的提取。使用Lipofectmaine 2000转染试剂共转染病毒包装质粒混合物和表达载体至病毒包装细胞系293T,进行慢病毒的包装和生产,收集病毒液并且使用梯度稀释法测定重组病毒滴度。使用重组病毒感染MCF-7/ADR细胞,单细胞悬液法筛选稳定表达细胞株,分别提取细胞总RNA和总蛋白,进行UbcH10 mRNA及蛋白含量检测。 1.3 UbcH10 mRNA及蛋白含量检测
取对数生长期的每组细胞约5×106个,用4℃预冷的dPBS洗细胞2次,每孔加入0.5 mL TRIzol,使用1 mL移液器反复吹打细胞,直至液体变得黏稠而透明,酚氯仿法提取细胞总RNA。使用oligo dT18作为反转录引物,取1 μg RNA反转录制备cDNA,然后取1 μL反转录产物作为PCR检测模板,使用荧光染料法进行PCR检测,操作步骤严格按照试剂盒说明书进行。基因相对含量分析使用2-ΔΔCt法进行分析,以β-actin(NM_001101.3)作为基因参照。PCR扩增引物如下:β-actin正向引物序列为5′-CCT GTA CGC CAA CAC AGT GC-3′,反向引物序列为5′-ATA CTC CTG CTT GCT GAT CC -3′,PCR产物长度为211 bp; UbcH10正向引物序列为5′- ACC CTC ATG ATG TCT GGC GAT AAA-3′,反向引物序列为5′-GTG ATA GCA GGG CGT GAG GAA CTT -3′,PCR产物长度为192 bp。 PCR的反应总体系为20 μL:TaKaRa SYBR Premix Ex Tag 10 μL,正、反向引物(20 μmol/L)各0.2 μL,cDNA 2 μL,dH2O补足反应体系至20 μL。反应条件:95℃ 5 min,60℃ 20 min,72℃ 20 min,共40个循环。
分别收集各组稳定表达细胞株1×107个,加入细胞裂解液(50 mmol/L pH 8.0 Tris,1 mg/mL 亮抑肽酶,150 mmol/L NaCl,0.5% Nonidet P-40,5 mmol/L EDTA,100 mmol/L苯甲基磺酰氟,1 mol/L二硫苏糖醇,1 mg/mL抑肽酶)提取细胞总蛋白,BCA法检测总蛋白浓度。每组样本取10 μL进行10% SDS-PAGE垂直电泳,湿法转膜,转膜条件为400 mA横流90 min,转膜完成后丽春红染色观察转膜效果。将膜用5%脱脂牛奶常温封闭2 h,加入TBST稀释后的一抗(UbcH10,1∶300;β-actin,1∶500),4℃过夜;取出后TBST洗膜3次再加入二抗(羊抗鼠,1∶3 000),37℃孵育2 h,再洗膜3次,添加ECL发光液反应底物,进行X线曝片,采用相关图像分析软件进行条带光密度扫描分析。UbcH10蛋白相对含量=目的条带光密度值/β-actin条带光密度值。 1.4 裸鼠皮下肿瘤模型制作及多柔比星干预
取对数生长期MCF-7/ADR及其稳定表达细胞株MCF-7/ADR-UbcH10-RNAi和MCF-7/ADR-NC,胰酶消化法制备细胞悬液,1 000×g离心2 min收集沉淀,使用dPBS重悬细胞两次,锥虫蓝染色后使用血小球计数板进行活细胞计数,并使用dPBS调整细胞密度至1×108个/mL。使用1 mL注射器吸 取0.1 mL细胞悬液,接种细胞到5周龄裸鼠腋下。接种后第14天,皮下可见有瘤体形成,大小约3 mm× 3 mm。实验组通过尾静脉注射多柔比星,注射前使用生理盐水配制2 mg/mL溶液,每次注射量为5 mg/kg体质量,每2 d注射1次,连续注射2周,共7次;对照组用等体积生理盐水同法给药。每组动物数量为10只。停药后1周处死小鼠,剥离肿瘤,去掉瘤体上的脂肪、血管及淋巴管组织,测量肿瘤长径和短径,计算肿瘤体积V=1/2×d1×d22,其中d1、d2分别为瘤体长径和短径。每组肿瘤测量3次,计算体积并求平均值。 1.5 瘤体中UbcH10和BCL-2蛋白含量检测
取出-80℃保存的瘤体组织,切取100 mg大小转移到1.5 mL无菌离心管,用4℃预冷的dPBS 1 mL洗1次,去掉dPBS;用组织蛋白提取试剂盒进行蛋白提取和定量,提取过程按照试剂盒说明书进行。采用蛋白质印迹法蛋白含量,检测和数据分析方法同前。UbcH10、BCL-2和β-actin一抗稀释比分别为1∶200、1∶300和1∶500。 1.6 统计学处理
采用SPSS 13.0 统计软件分析数据,定量数据采用x±s表示,采用析因分析进行组间差异及组内差异的比较。检验水准(α)为0.05。 2 结 果 2.1 MCF-7/ADR-UbcH10-RNAi细胞株构建成功
通过慢病毒实验系统成功构建MCF-7/ADR UbcH10-RNAi及其对照细胞株,实时定量 PCR检测结果表明,MCF-7/ADR、MCF-7/ADR-UbcH10-RNAi和MCF-7/ADR-NC中UbcH10基因含量分别为1.00±0.12、0.21±0.03和1.02±0.17,基因沉默组与对照组比较差异有统计学意义(P<0.05);蛋白检测结果与之一致(图 1)。
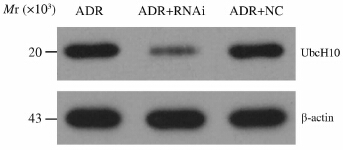
|
图 1 UbcH10蛋白在三组MCF-7细胞中的表达 Fig 1 Detection of UbcH10 protein levels MCF-7 cells in 3 groups |
动物经过2周给药并停药1周后,生理盐水对照组、多柔比星组、多柔比星+ADR-NC对照组、多柔比星+基因沉默组肿瘤体积分别为(322.1±45.2)、(308.7±41.6)、(315.7±45.62)、(187.6±25.2) mm3,多柔比星+基因沉默组肿瘤体积小于生理盐水对照组(P<0.01),生理盐水对照组、多柔比星组、多柔比星+ADR-NC对照组间差异无统计学意义。与生理盐水对照组相比,多柔比星组、多柔比星+ADR-NC对照组、多柔比星+基因沉默组的肿瘤抑制率分别为4.16%、1.99%、41.8%。说明多柔比星处理对于耐药肿瘤无抑制效果,UbcH10基因沉默可以明显增强耐药肿瘤对于化疗药物的敏感性。 2.3 瘤体内UbcH10和BCL-2蛋白含量检测
瘤体内蛋白含量检测结果显示,生理盐水对照组、多柔比星组、多柔比星+ADR-NC对照组、多柔比星+基因沉默组UbcH10蛋白表达量分别为0.81±0.16、 0.78±0.12、0.74±0.14、0.18±0.04,BCL-2蛋白表达量分别为0.62±0.09、0.70±0.12、0.67± 0.13、0.21±0.02,多柔比星+基因沉默组与其他组比较差异有统计学意义(P<0.05),蛋白分子量见图 2。提示UbcH10蛋白低表达可以增强MCF-7/ADR对于多柔比星治疗的敏感性,其作用与UbcH10基因沉默引起BCL-2基因的表达降低有关。

|
图 2 肿瘤组织中UbcH10和BCL-2蛋白含量检测 Fig 2 UbcH10 and BCL-2 protein level in subcutaneous tumors |
泛素调节的蛋白降解是体内一种重要的蛋白修饰和降解途径,是泛素活化酶、泛素结合酶、泛素连接酶和蛋白酶体等共同参与的生物学进程,与细胞生命过程密切相关,对靶蛋白的特异性降解主要与泛素结合酶、泛素连接酶有关,UbcH10即是一种泛素结合酶。泛素/蛋白酶体介导的蛋白质降解途径(ubiquitin-proteasome proteolytic pathway,UPP途径)是真核细胞内蛋白质转录后降解的重要方式之一,与细胞增殖、凋亡等生命现象密切相关。E2蛋白酶家族成员之一的泛素结合酶UbcH10(UBE2C)在泛素化途径中具有重要作用,研究发现,其与肿瘤的形成和发展具有密切的关系,在多种组织来源的肿瘤组织出现过表达[9]。本课题组在前期研究中发现,UbcH10在乳腺癌组织与癌旁组织及乳腺良性肿瘤中的表达存在显著差异;通过对肿瘤组织的免疫组化检测发现,UbcH10的表达与Ki-67和HER-2蛋白表达有相关性;而对手术切除后辅助化疗的乳腺癌患者的跟踪调查中发现,UbcH10高表达患者具有预后差且生存期短的特点[10]。
对耐药基因进行干预,可增强耐药肿瘤细胞对化疗药物的治疗敏感性。Aomatsu等[11]研究发现,碳酸酐酶9(carbonic anhydrase 9,CA9)与乳腺癌化疗敏感性具有密切关系,CA9可以作为预测临床乳腺癌化疗的敏感性的标志物,CA9基因的表达可以用来判断乳腺癌患者手术切除肿瘤之前是否适合紫杉醇处理。Xing等[12]对于肠癌中FTY720基因研究则表明,FTY720基因可以抑制肠癌细胞HCT-8及其耐药细胞株HCT-8/5-FU对于化疗药物的敏感性,这种影响可能是通过抑制P-gp和MRP1的表达来实现的,认为FTY720可以作为一个潜在的协同辅助治疗方式。miR124被证实与神经胶质瘤耐药有关,可以通过其靶基因R-Ras和N-Ras来影响肿瘤的化疗敏感性[13]。Shoji等[14]通过实验证实,成纤维细胞生长因子受体2(FGFR2)可以抑制前列腺癌细胞的化疗敏感性。RLIP76是已知的与细胞生长有关的基因,与多种恶性肿瘤细胞的化疗敏感性相关。Yao 等[15]发现敲除白血病细胞中的RLIP76,可以增强BAX蛋白表达,降低cyclin D1和cyclin E的表达,并最终增强细胞对于柔红霉素的治疗敏感性。以上研究均说明,基因干预联合化疗药物处理,是增强肿瘤细胞对于化疗药物敏感性的一个有效手段。在乳腺癌耐药的相关研究中,也有类似的发现和研究,如RABEX-5与人乳腺癌细胞MCF-7对表柔比星产生耐药的过程密切相关[16]。miR-181可以通过抑制靶基因BCL-2的表达来增强乳腺癌细胞对多柔比星的药物敏感性[17]。PDCD5蛋白在MDA-MB-231的紫杉醇治疗过程中明显上调,PDCD5虽然不直接对肿瘤细胞增殖产生作用,却可以大大提高紫杉醇对乳腺癌的抗肿瘤作用,这说明重组人PDCD5是一个提高乳腺癌细胞紫杉醇敏感性的潜在治疗剂[18]。UbcH10作为一种在多种来源肿瘤中异常表达的“枢纽基因(hub gene)”,可能与乳腺癌的发生发展过程密切相关。因此,探讨UbcH10参与乳腺上皮细胞癌变的分子病理生理机制,有助于更好地理解乳腺癌的恶性生物学行为及机制,有可能为乳腺癌临床治疗提供新的分子靶标[14]。
本研究通过慢病毒实验系统,在耐药乳腺癌细胞MCF-7/ADR中高效沉默UbcH10基因并且建立基因稳定长期沉默的细胞株,经体内成瘤实验证实UbcH10基因沉默可明显增强耐药肿瘤对化疗药物的敏感性。鉴于BCL-2与肿瘤耐药之间的密切关系[20, 21],我们对各组瘤体中的BCL-2进行了检测,结果发现BCL-2的变化与UbcH10一致,这说明UbcH10基因沉默引起耐药细胞中BCL-2基因会表达降低,这可能是耐药乳腺癌细胞对化疗变得敏感的分子调控途径之一。本研究为乳腺癌临床治疗中解决耐药问题和提高化疗的敏感性提供了新的理论依据。
| [1] | 邵志敏,沈镇宙,徐兵河.乳腺肿瘤学[M].上海:复旦大学出版社,2013:1. |
| [2] | Li S Z, Song Y, Zhang H H, Jin B X, Liu Y, Liu W B, et al. UbcH10 overexpression increases carcinogenesis and blocks ALLN susceptibility in colorectal cancer[J]. Sci Rep,2014,4:6910. |
| [3] | Xie C, Powell C, Yao M, Wu J, Dong Q. Ubiquitin-conjugating enzyme E2C: a potential cancer biomarker[J]. Int J Biochem Cell Biol,2014,47:113-117. |
| [4] | van Ree J H, Jeganathan K B, Malureanu L, van Deursen J M. Overexpression of the E2 ubiquitin-conjugating enzyme UbcH10 causes chromosome missegregation and tumor formation[J].J Cell Biol,2010,188:83-100. |
| [5] | Perrotta I, Bruno L, Maltese L, Russo E, Donato A, Donato G. Immunohistochemical analysis of the ubiquitin-conjugating enzyme UbcH10 in lung cancer: a useful tool for diagnosis and therapy[J]. J Histochem Cytochem,2012,60:359-365. |
| [6] | Morikawa T, Kawai T, Abe H, Kume H, Homma Y, Fukayama M. UBE2C is a marker of unfavorable prognosis in bladder cancer after radical cystectomy[J]. Int J Clin Exp Pathol,2013,6:1367-1374. |
| [7] | Chen S M, Jiang C Y, Wu J Y, Liu B, Chen Y J, Hu C J, et al. RNA interference-mediated silencing of UBCH10 gene inhibits colorectal cancer cell growth in vitro and in vivo[J]. Clin Exp Pharmacol Physiol,2010,37(5-6):525-529. |
| [8] | Zhao L, Jiang L, Wang L, He J, Yu H, Sun G, et al. UbcH10 expression provides a useful tool for the prognosis and treatment of non-small cell lung cancer[J]. J Cancer Res Clin Oncol,2012,138:1951-1961. |
| [9] | Okamoto Y, Ozaki T, Miyazaki K, Aoyama M, Miyazaki M, Nakagawara A. Ubch10 is the cancer-related E2 ubiqutin-conjugating enzyme [J]. Cancer Res,2003,63:4167-4173. |
| [10] | 潘赟昊,郭善禹,汪 成,顾 岩,包家林.UbcH10在乳腺浸润性导管癌中的表达及预后分析[J].外科理论与实践,2014,19:47-52. |
| [11] | Aomatsu N, Yashiro M, Kashiwagi S, Kawajiri H, Takashima T, Ohsawa M, et al.Carbonic anhydrase 9 is associated with chemosensitivity and prognosis in breast cancer patients treated with taxane and anthracycline[J]. BMC Cancer,2014,14:400. |
| [12] | Xing Y, Wang Z H, Ma D H, Han Y. FTY720 enhances chemosensitivity of colon cancer cells to doxorubicin and etoposide via the modulation of P-glycoprotein and multidrug resistance protein 1[J]. J Dig Dis,2014,15:246-259. |
| [13] | Shi Z, Chen Q, Li C, Wang L, Qian X, Jiang C, et al.MiR-124 governs glioma growth and angiogenesis and enhances chemosensitivity by targeting R-Ras and N-Ras[J]. Neuro Oncol,2014,16:1341-1353. |
| [14] | Shoji K, Teishima J, Hayashi T, Ohara S, Mckeehan W L, Matsubara A. Restoration of fibroblast growth factor receptor 2Ⅲb enhances the chemosensitivity of human prostate cancer cells[J]. Oncol Rep,2014,32:65-70. |
| [15] | Yao K, Xing H, Yang W, Liao A, Wu B, Li Y, et al. Knockdown of RLIP76 expression by RNA interference inhibits proliferation, enhances apoptosis, and increases chemosensitivity to daunorubicin in U937 leukemia cells[J].Tumour Biol,2014,35:8023-8031. |
| [16] | 张 翔,厉红元,闵 捷,李 焰,刘 强,梁欣洁.乳腺癌细胞中下调RABEX-5对其化疗敏感性的影响[J].四川大学学报:医学版,2013,44:882-885. |
| [17] | Zhu Y, Wu J, Li S, Ma R, Cao H, Ji M, et al.The function role of miR-181a in chemosensitivity to adriamycin by targeting Bcl-2 in low-invasive breast cancer cells[J]. Cell Physiol Biochem,2013,32:1225-1237. |
| [18] | Wang L, Wang C, Su B, Song Q, Zhang Y, Luo Y, et al.Recombinant human PDCD5 protein enhances chemosensitivity of breast cancer in vitro and in vivo[J].Biochem Cell Biol,2013,91:526-531. |
| [19] | Berlingieri M T, Pallante P, Sboner A, Barbareschi M, Bianco M, Ferraro A, et al. UbcH10 is overexpressed in malignat breast carcinomas[J]. Eur J Cancer,2007,43:2729-2735. |
| [20] | Chen L, Bourguignon L Y. Hyaluronan-CD44 interaction promotes c-Jun signaling and miRNA21 expression leading to Bcl-2 expression and chemoresistance in breast cancer cells[J].Mol Cancer,2014,13:52. |
| [21] | Hu J, Fang Y, Cao Y, Qin R, Chen Q.miR-449a Regulates proliferation and chemosensitivity to cisplatin by targeting cyclin D1 and BCL2 in SGC7901 cells[J]. Dig Dis Sci,2014,59:336-345. |
 2015, Vol. 36
2015, Vol. 36


