原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种受多因素影响、多基因调控的复杂疾病,病死率居恶性肿瘤第二位[1, 2]。探讨HCC发生发展相关的因素及分子机制,有助于寻找肝癌早期诊断、转移和复发预测的生物学标记和治疗靶标,对于疾病的诊疗及预测预后具有重要的临床意义。
膜联蛋白(Annexins,ANX)是一类Ca2+依赖的磷脂结合蛋白,研究发现该基因家族中多个分子与包括肝癌在内的多种肿瘤的发生、发展密切相关[3]。其中膜联蛋白 A7(ANXA7)在一些组织中表现出肿瘤抑制基因的活性[4, 5, 6, 7],但是其是否与肝癌的发生存在潜在的关联尚不清楚。本研究分析了ANXA7表达与肿瘤的相关性。通过筛选与ANXA7抗肿瘤相关的信号分子,进一步探讨了其调节机制,为进一步阐述HCC发生、发展机制及寻求HCC防治新方法提供新线索。
1 材料和方法 1.1 组织与细胞收集48对肝癌组织及其癌旁组织,新鲜冰冻,存放于液氮中。组织标本均来自第二军医大学东方肝胆外科医院,并获得患者的知情同意;人正常肝细胞L02与人肝癌细胞LM3、SMMC7721、Huh7、HepG2、MHCC97H均购自中国科学院细胞库。以上细胞用DMEM培养基(含10%胎牛血清,Gibco公司),培养条件为5% CO2、37℃,细胞培养至对数生长期备用。
1.2 荧光实时定量PCR检测ANXA7 mRNA的表达 应用Qiagen公司的RNeasy Mini kit 提取组织或细胞总RNA;以Invitrogen公司的M-MLV反转录酶进行RT-PCR获得cDNA,按试剂盒说明进行操作。采用ABI 7300实时荧光定量PCR仪进行定量PCR分析,β-actin为内参,每个样本重复3次。采用相对定量的方法(2-ΔΔCT法)检测目的基因mRNA水平。所有实验都完全独立的重复3次,取平均值作为最后数据。 1.3 表达载体的构建以人正常肝细胞L02的cDNA为模板,经PCR法扩增获得胰岛素样生长因子结合蛋白2(IGFBP2)和含融合蛋白HA标签的人ANXA7的DNA片段,分别插入真核表达载体pcDNA3.0的多克隆位点BamH Ⅰ和XbaⅠ,构建重组载体pcDNA3-HA-ANXA7和pcDNA3-IGFBP2。测序法筛选鉴定阳性克隆。
1.4 siANXA7重组体的构建 ANXA7特异性小干扰RNA,即siANXA7,由上海吉玛制药技术有限公司设计合成。阳性对照采用已经确认有效的靶向管家基因之一GAPDH的siRNA;阴性对照是选择与目的基因的序列和哺乳动物基因无同源性的siRNA。 1.5 细胞转染采用Invitrogen公司LipofectamineTM 2 000试剂进行细胞瞬时转染,按试剂盒标准流程操作。脂质体-核酸复合物加入培养细胞5 h后更换含血清培养基,在37℃、5% CO2条件下继续培养。
1.6 细胞增殖活性检测将pcDNA3-HA-ANXA7过表达质粒以及对照质粒pcDNA3.0分别瞬时转染人肝癌细胞系SMMC7721,分析ANXA7过表达对细胞增殖的影响。此外,也以siANXA7以及各自的阴性对照转染SMMC7721,分析ANXA7表达抑制对细胞增殖的影响。 细胞铺于96孔板,分别在转染后0、12、24、36和48 h,按每孔10 μL加入CCK-8试剂,继续培养2 h后,使用酶标仪测定450 nm光密度D450,来分析细胞的增殖。
1.7 免疫共沉淀采用Thermo Scientific公司的ProFoundTM HA Tag IP/Co-IP Kit。将SMMC7721细胞铺于6孔板中,24 h后待细胞融合度达到90%左右时将质粒(pcDNA3-HA-ANXA7和pcDNA3-HA)按4 μg/孔的量转染细胞。转染后48 h加入细胞裂解液裂解细胞。细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,采用非离子变性剂Triton X-100,细胞裂解液中加入酶抑制剂混合物。将离心柱装入离心管中,并在离心柱中加入适量的细胞裂解液。 反复颠倒使含有抗HA标签的琼脂糖匀浆充分混匀。按照每离心管10 μL的量(含有5 μg anti-HA抗体)将琼脂糖匀浆加入离心管中,盖紧离心管盖,4℃孵育过夜。将收集管接于离心柱之下,短暂离心,弃滤液。按照每管0.5 mL的量将Tris生理盐水-吐温缓冲液 (TBST,10 mmol/L Tris-HCl,pH 7.5,150 mmol/LNaCl,0.05%Tween-20)溶液加入离心柱中。盖上盖子,轻柔颠倒混匀2~3次,短暂离心,弃去滤液。重复步骤两次。将离心柱装入一新的收集管中。加入25 μL2×非还原样品缓冲液,轻柔混匀。将离心柱置于95× 100℃热激5 min,13 500×g离心1 min。在收集的样品中加入2~3 μL 1 mol/L的二硫苏糖醇(dithiothreitol,DTT),样品立即进行SDS-PAGE。考马斯亮蓝染色、观察、切胶、质谱分析。
1.8 蛋白免疫印迹(Western blotting)检测目的蛋白表达水平SDS-PAGE进行后凝胶用电泳法转至PVDF膜,室温下使用封闭液封闭2 h,TBST缓冲液洗涤10 min×3次,根据说明书所示的稀释比,使用抗体稀释液稀释一抗,一抗工作液在4℃条件下孵育过夜。免疫共沉淀结合蛋白免疫印迹的检测中,采用一抗为兔抗-IGFBP2 抗体(Santa Cruz公司)。在ERK1/2磷酸化水平的蛋白免疫印迹检测中,采用一抗为小鼠抗-β-actin 单抗,小鼠抗p-ERK1/2单抗和小鼠抗ERK1/2单抗(均购自Cell Signaling)。TBST洗涤10 min×3次,室温下使用封闭液进行二次封闭2 h,TBST洗涤10 min×1次,使用抗体稀释液稀释标记二抗,二抗工作液在37℃条件下孵育2 h,TBST洗10 min×3次。加入显色底物DAB暗处作用1 min,双蒸水终止显色。其中,β-actin作为蛋白定量的内参照。
1.9 定点突变采用QuikChange site-directed mutagenesis kit (Stratagene,Agilent Technologies,Palo Alto,CA)试剂盒,对已构建的包含人IGFBP2序列的pcDNA3-IGFBP2质粒中的RGD序列进行点突变。以pcDNA3-IGFBP2质粒为模板,进行突变链合成反应,反应体系如下:10×反应缓冲液 5 μL,dNTP mix ( 2.5 mmol/L each dNTP) 5 μL,质粒模板 (总量约5~50 ng) 0.5 μL,上下游引物各1.25 μL (10 μmol/L),PfuTurbo DNA 聚合酶1 μL,双蒸水(ddH2O) 补齐50 μL,混合物加入平头薄壁PCR管中,充分振荡混匀后,稍离心,然后按下列条件进行反应:95℃预变性30 s;循环条件为95℃变性30 s,55℃退火1 min,68℃延伸6 min,共18个循环。所得PCR产物取5 μL进行琼脂糖凝胶电泳,观察产物条带。剩余反应产物进行Dpn Ⅰ限制性酶切消化。感受态细胞转化、挑克隆、测序鉴定阳性突变质粒及突变位点。
1.10 统计学处理所有数据均使用 x±s形式表示。数据采用SPSS 10.0 统计软件包进行统计分析,组间比较采用方差分析。 检验水准(α)为0.05。 2 结 果 2.1 ANXA7在肝癌组织及多种肝癌细胞系中表达通过荧光实时定量PCR检测48例肝癌患者的癌与癌旁组织中ANXA7 mRNA的变化,结果显示相较癌旁组织,ANXA7在癌组织中表达下调(0.87±0.56 vs 4.26±2.14,P<0.01); ANXA7在5种肝癌细胞系LM3、SMMC7721、Huh7、HepG2、MHCC97H中mRNA水平均低于正常肝细胞L02(P<0.01,图 1)。

|
图 1 ANXA7 mRNA在不同肝细胞系中表达分析 Fig 1 ANXA7 mRNA expression analysis in different hepatoma cell lines **P<0.01 vs L02 liver cell line. n=3,x±s |
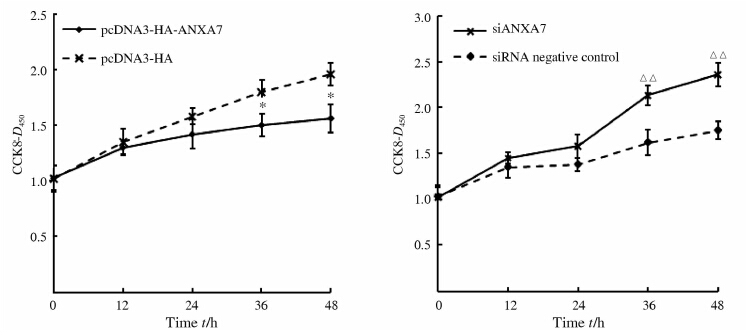
结 果显示,转染36 h和48 h时pcDNA3-HA-ANXA7转染组较pcDNA3.0空载体转染组的CCK8检测值降低(P<0.05,图 2),提示上调ANXA7表达能够抑制肿瘤生长,而下调ANXA7的表达促进肿瘤细胞增殖(P<0.01,图 2)。
|
图 2 ANXA7表达对人肝癌细胞SMMC7721增殖的影响 Fig 2 ANXA7 increased proliferative activity of hepatic cancer SMMC7721 cells *P<0.05 vs pcDNA3-HA;△△P<0.01 vs siRNA negative control. n=6,x±s |
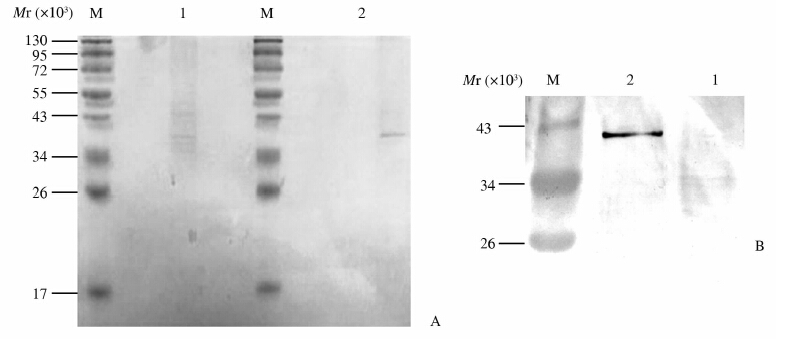
差异电泳条带分离后的结果显示,ANXA7能与IGFBP2结合。经重复实验,该蛋白特异性存在免疫共沉淀的结合蛋白组分中。通过蛋白免疫印迹法反向验证,结果进一步提示两者在肝癌细胞系SMMC7721中存在结合作用(图 3)。
|
图 3 免疫共沉淀法筛选及验证ANXA7相互作用蛋白 Fig 3 Identification and validation of binding protein with ANXA7 by co-immunopricipitation A: SDS-PAGE analysis of the ANXA7 binding protein with ANXA7 after co-immunopricipitation; B: Western blotting analysis of insulin-like growth factors binding protein 2 in co-immunopricipitation samples with ANXA7. Protein marker: Page Ruler Prestained Protein Ladder (Fermentas). M:Marker; 1: pcDNA3-HA; 2:pcDNA3-HA-ANXA7 |
结果突变组未能检测到IGFBP2的存在。结果提示,ANXA7可通过IGFBP2上RGD序列介导与IGFBP2结合(图 4)。

|
图 4 IGFBP2的RGD序列突变分析 Fig 4 Mutation analysis of RGD sequence in IGFBP2 IGFBP2: Insulin-like growth factors binding protein 2. A:Schematic diagram of mutation site in IGFBP2; B:Western blotting analysis of IGFBP2 |
结果显示,肝癌细胞中ANXA7与IGFBP2共表达的细胞比仅表达ANXA7细胞的磷酸化ERK1/2蛋白水平低,提示过表达ANXA7能抑制IGFBP2激活的ERK1/2的磷酸化水平;反之,ANXA7的特异性干扰则使IGFBP2活化ERK1/2的作用进一步增强(图 5)。

|
图 5ANXA7影响IGFBP2激活的ERK1/2磷酸化的蛋白免疫印迹分析 Fig 5 Effect of ANXA7 on IGFBP2 activated ERK1/2 phosphorylation as shown by Western blotting analysis IGFBP2: Insulin-like growth factors binding protein 2. A:SMMC7721 cells were co-transfected with IGFBP2 and ANXA7 expressing plasmids.B:SMMC7721 cells were co-transfected with IGFBP2 expressing plasmid and siANXA7. Non-specific siRNA was used as control |
ANX是一类钙依赖的磷脂结合蛋白。其中某些成员的功能异常可引起肿瘤细胞增殖调控异常,结构缺失或改变影响肿瘤转移潜能;部分膜联蛋白还具有影响肿瘤凋亡和分化的功能[10, 11, 12, 13]。ANXA7是最早被分离纯化出来的膜联蛋白,以往的研究发现ANXA7在一些组织中表现出抑制基因活性,其表达失调与肿瘤进展和预后密切相关[14]。据报道,在4 061例包含多种肿瘤的组织芯片结果中发现ANXA7表达下调[6],这与本研究中病例样本和肝癌细胞中的结果一致。
本研究进一步通过免疫共沉淀实验发现ANXA7与IGFBP2能发生特异性结合,鉴于IGFBP2的RGD序列是与多种蛋白结合的关键位点,推测其与ANXA7结合也极有可能通过该位点介导。因此通过定点突变法得到IGFBP2的RGD位点突变质粒,采用免疫共沉淀结合蛋白免疫印迹的方法确定了ANXA7与IGFBP2的结合是通过IGFBP2中RGD序列介导的。
IGFBP2是一种在人的多种体液和组织中均有表达的分泌蛋白,属于IGF系统的组成成员,参与重要的网络调控,调节多种细胞过程[15, 16],激活ERK1/2、SAPK/JNK和p38途径[8],并且能升高ERK1/2、SAPK/JNK的磷酸化水平[9]。其中,ERK的信号转导 (Ras-Raf-MEK-ERK)被多种生长因子、细胞因子及促分裂剂激活,在细胞的增殖和分化调控中发挥重要作用,是多种信号的交汇点或共同通路[17, 18]。本研究发现,IGFBP2在肝癌中能够激活ERK1/2的磷酸化,在此基础上进一步分析了ANXA7是否通过IGFBP2参与了对ERK1/2磷酸化的调节作用。结果显示在IGFBP2存在的情况下,下调ANXA7表达能使ERK1/2的磷酸化水平升高,很好地解释了ANXA7抑制肝癌细胞生长的作用。我们后续将针对IGFBP2进行干预,观察其被干预后对肝癌细胞增殖的影响,进一步说明ANXA7与IGFBP2在功能上的相关性。
| [1] | Flores A, Marrero J A. Emerging trends in hepatocellular carcinoma: focus on diagnosis and therapeutics[J]. Clin Med Insights Oncol,2014,8:71-76. |
| [2] | Hashimoto E, Tokushige K. Hepatocellular carcinoma in non-alcoholic steatohepatitis: growing evidence of an epidemic?[J].Hepatol Res,2012,42:1-14. |
| [3] | Laohavisit A, Davies J M. Annexins[J]. New Phytol,2011,189:40-53. |
| [4] | Srivastava M, Bubendorf L, Srikantan V, Fossom L, Nolan L, Glasman M, et al. ANX7, a candidate tumor suppressor gene for prostate cancer[J]. Proc Natl Acad Sci USA,2001,98:4575-4580. |
| [5] | Taniuchi K, Yokotani K, Saibara T. BART inhibits pancreatic cancer cell invasion by PKCα inactivation through binding to ANX7[J]. PLoS One,2012,7:e35674. |
| [6] | Srivastava M, Torosyan Y, Raffeld M, Eidelman O, Pollard H B, Bubendorf L. ANXA7 expression represents hormone-relevant tumor suppression in different cancers[J]. Int J Cancer,2007,121:2628-2636. |
| [7] | Mears D, Zimliki C L, Atwater I, Rojas E, Glassman M, Leighton X, et al. The Anx7(+/-) knockout mutation alters electrical and secretory responses to Ca2+-mobilizing agents in pancreatic β-cells[J]. Cell Physiol Biochem,2012,29:697-704. |
| [8] | Madoz-Gurpide J, Lopez-Serra P, Martinez-Torrecuadrada J L, Sanchez L, Lombardia L, Casal J I. Proteomics-based validation of genomic data-applications in colorectal cancer diagnosis[J]. Mol Cell Proteom,2006,5:1471-1483. |
| [9] | Wozny W, Schroer K, Schwall G P, Poznanovic S, Stegmann W, Dietz K, et al. Differential radioactive quantification of protein abundance ratios between benign and malignant prostate tissues: cancer association of annexin A3[J]. Proteomics,2007,7:313-322. |
| [10] | Bandorowicz-Pikula J, Woś M, Pikula S. Participation of annexins in signal transduction, regulation of plasma membrane structure and membrane repair mechanisms[J]. Postepy Biochem,2012,58:135-148. |
| [11] | Gerke V, Creutz C E, Moss S E. Annexins: linking Ca2+ signalling to membrane dynamics[J]. Nat Rev Mol Cell Biol,2005,6:449-461. |
| [12] | Hayes M J, Longbottom R E, Evans M A, Moss S E. Annexinopathies[J]. Subcell Biochem,2007,45:1-28. |
| [13] | Rescher U, Gerke V. Annexins- unique membrane binding proteins with diverse functions[J]. J Cell Sci,2004,117:2631-2639. |
| [14] | Uzoh C C, Holly J M, Biernacka K M, Persad R A, Bahl A, Gillatt D, et al. Insulin-like growth factor-binding protein-2 promotes prostate cancer cell growth via IGF-dependent or -independent mechanisms and reduces the efficacy of docetaxel[J]. Br J Cancer,2011,104:1587-1593. |
| [15] | Hamidouche Z, Fromigué O, Ringe J, Häupl T, Marie P J. Crosstalks between integrin alpha 5 and IGF2/IGFBP2 signalling trigger human bone marrow-derived mesenchymal stromal osteogenic differentiation[J]. BMC Cell Biol,2010,11:44. |
| [16] | Chesik D, De Keyser J, Wilczak N. Insulin-like growth factor binding protein-2 as a regulator of IGF actions in CNS: implications in multiple sclerosis[J]. Cytokine Growth Factor Rev,2007,18:267-278. |
| [17] | Handra-Luca A, Bilal H, Bertrand J C, Fouret P. Extra-cellular signal-regulated ERK-1/ERK-2 pathway activation in human salivary gland mucoepidermoid carcinoma: association to aggressive tumor behavior and tumor cell proliferation[J].Am J Pathol,2003,163:957-967. |
| [18] | Tsukada Y, Miyazawa K, Kitamura N. High intensity ERK signal mediates hepatocyte growth factor-induced proliferation inhibition of the human hepatocellular carcinoma cell line HepG2[J]. J Biol Chem,2001,276:40968-40976. |
 2015, Vol. 36
2015, Vol. 36


