快速眼球运动(rapid eye movement,REM)睡眠与生长发育、学习记忆和认知功能等心理活动有关[1, 2]。REM期睡眠障碍或缺失会导致认知障碍等多种疾病。REM睡眠剥夺是通过模拟睡眠缺失对引发的生理性损害进行研究的常用方法,其作用机制与神经递质表达变化密切相关[3]。研究发现,神经肽S (neuropeptide S,NPS)在睡眠和觉醒方面有明显调节作用[4]。NPS最早发现于2002年,因其氨基端残基在已检定物种中均为丝氨酸(serine,S)而得名,其相应的G蛋白偶联受体被称为NPS受体(neuropeptide S receptor,NPSR),两者结合形成新的系统,共同影响生物个体的睡眠觉醒、抑郁焦虑、记忆学习、摄食代谢、内分泌甚至免疫功能等多种生理过程。初步研究证实,这可能与其主要集中在中枢神经系统并且随其在下丘脑的表达变化高度相关[5]。背内侧核是下丘脑内的重要核团,参与机体的睡眠、觉醒过程。当存在睡眠障碍导致睡眠减少时,机体是否会通过主动调节背内侧核内NPS来参与觉醒过程尚未可知。本研究采用改良多平台水环境睡眠剥夺法(modified multiple platform method,MMPM)[6]建立大鼠REM期睡眠剥夺模型,观察REM睡眠剥夺后下丘脑背内侧核NPS表达的变化情况。 1 材料和方法 1.1 动物分组
成年雄性SD大鼠24只,体质量200~220 g,由上海斯莱克实验动物有限责任公司提供(许可证号SCXK 沪2009-0005)。利用随机数字表将其随机均分为3组:正常对照 (cage control,CC) 组、环境对照 (tank control,TC) 组和REM睡眠剥夺 (sleep deprivation,SD) 组,每组8只。 1.2 睡眠剥夺模型的建立
采用改良多平台睡眠剥夺法(modified multiple platform method,MMPM) 建立大鼠REM期睡眠剥夺模型。SD组剥夺水槽内放置两排平台,每排设置8个平台,往水槽内注水,距离平台表面1.5 cm时停止,放置恒温棒,将水温保持在20~25℃。为保证大鼠可在平台间自由活动,平台间的间隔设定在15 cm左右,同时,为确保REM睡眠被剥夺的效果,平台设计较小,这样大鼠进入REM期睡眠时,会因肌肉放松导致身体失衡落水,从而惊醒。每个水槽内放8只大鼠,每12 h对明暗进行切换,保持实验环境安静。TC组水槽内同样放置两排平台,每排8个,平台设置相对较大,其他设计同上。CC组大鼠则照常规隔离笼养。 1.3 取材及切片制备
经睡眠剥夺的SD组大鼠,用CO2窒息,先后使用0.9% NaCl溶液和灌流固定液进行主动脉灌流,快速分离脑组织,置于灌流固定液中浸泡4 h,移至含20%蔗糖的磷酸缓冲液(PBS)中。制作下丘脑冠状切片,20 μm/片,收集切片置于0.05 mol/L PBS,4℃冰箱保存。 1.4 免疫组化染色
标本用含3% H2O2的磷酸盐缓冲液(PBS)漂洗35 min,消除内源性过氧化物酶;置于含10%正常马血清(NHS)、0.2% Triton X-100的PBS中,预孵育30 min;用0.05 mol/L PBS(pH 7.2)漂洗3×5 min;加入一抗(NPS抗体,1∶500,Santa Cruz),4℃过夜;用0.05 mol/L PBS (pH 7.2)漂洗3×5 min;加入二抗(Cy3标记的驴抗免IgG,1∶500,Abcam)和1% NHS/PBS溶液,孵育2 h;用0.05 mol/L PBS(pH 7.2)漂洗3×5 min;裱片,用含50%甘油的PBS封片。荧光显微镜下(E600,Nikon Eclipse,Japan)观察下丘脑背内侧核NPS蛋白的表达,应用Nikon公司的Digital Camera DXM 1200进行图像采集,对每组8只大鼠、每只大鼠2张下丘脑背内侧核切片的NPS蛋白阳性神经元进行计数。 1.5 原位杂交
探针的制备详见文献[7]。标本先用0.1 mol/L PBS(pH 7.2)漂洗3×5 min,含0.1 mol/L甘氨酸的PBS(pH 7.2)漂洗5 min,含0.4% Triton X-100的PBS(pH 7.2)漂洗15 min,然后加入1 μg/mL 蛋白酶K于37℃保温30 min;用含4%多聚甲醛的PBS(pH 7.2)固定5 min,0.1 mol/L PBS(pH 7.2)漂洗3×5 min;用0.25%醋酸酐浸泡10 min;用2×SSC漂洗10 min。用灭菌吸水纸将切片吸干,而后放入杂交液(核酸探针浓度为0.5 μg/mL)于56℃保温12~16 h;用4×SSC于37℃漂洗5 min,2×SSC(含RNaseA 20 μg/mL)于37℃保温30 min,1×SSC于37℃漂洗15 min,0.5×SSC于37℃漂洗20 min,0.05 mol/L PBS(pH 7.2)漂洗2×6 min;将碱性磷酸酶标记的抗地高辛抗体(Fab)按1∶1 000稀释,室温孵育4 h;0.05 mol/L PBS(pH 7.2)漂洗4×5 min;TSM1和TSM2分别漂洗2×5 min。 然后用BCIP/NBT碱性磷酸酶显色液避光反应1~3 h,以0.05 mol/L PBS(pH 7.2)漂洗2×5 min,终止显色。准备覆涂铬矾明胶载玻片,将切片贴在上面并放置于阴凉处干燥;中性树胶封片。荧光显微镜下观察下丘脑背内侧核NPS mRNA的表达,采集图像,对每组8只大鼠、每只大鼠2张下丘脑背内侧核切片的NPS mRNA阳性神经元进行计数。 1.6 统计学处理
采用SPSS 1.0软件进行数据统计和分析,结果以 x±s 表示,采用单因素方差分析(one-way ANOVA)及SNK检验比较组间差异。检验水准(α)为0.05。 2 结 果 2.1 REM睡眠剥夺后大鼠的一般情况及行为学表现
REM睡眠剥夺后,大鼠体质量有所减轻,皮毛蓬松杂乱、无光泽,部分大鼠爪子表面皮肤有出血现象;大鼠有狂躁表现,容易被激怒,同时表现出较强的攻击性。 2.2 REM睡眠剥夺后大鼠下丘脑背内侧核NPS蛋白表达变化
在大鼠下丘脑区域,能够观察到中等强度的NPS蛋白阳性染色。在下丘脑背内侧核区域,NPS蛋白阳性染色则较为明显。CC组和TC组的NPS阳性蛋白在背内侧核中表达较少,呈散在分布 (图 1A、1B),两组间阳性神经元数量差异无统计学意义(表 1);SD组大鼠经3 d睡眠剥夺后,背内侧核NPS蛋白阳性细胞数量较多,占背内侧核核团的大部分(图 1C),其阳性神经元数量与CC组和TC组比较差异有统计学意义(P<0.05,表 1)。
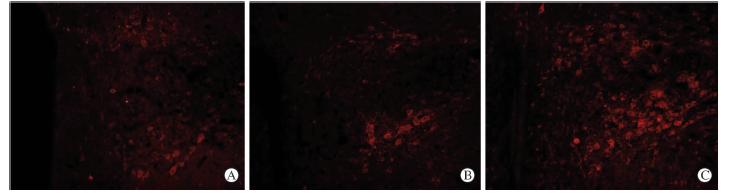 | 图 1 神经肽S蛋白在各组大鼠下丘脑背内侧核内的表达A:正常对照(CC)组;B:环境对照(TC)组;C: 快速眼球运动(REM)睡眠剥夺(SD)组. Original magnification:×200 |
| 表 1 各组大鼠背内侧核神经肽S(NPS)蛋白及mRNA阳性神经元数 |
在本实验中,下丘脑背内侧核内NPS mRNA的表达趋势与NPS蛋白一致。大鼠下丘脑背内侧核的NPS mRNA在CC组和TC组阳性表达较少,呈散在分布(图 2A、2B),阳性神经元数量在两组间差异无统计学意义(表 1)。SD组大鼠经3 d睡眠剥夺后,大鼠下丘脑背内侧核NPS mRNA阳性表达的细胞数较多,占该核团大部分(图 2C),与CC组和TC组比较差异均有统计学意义(P<0.05,表 1)。
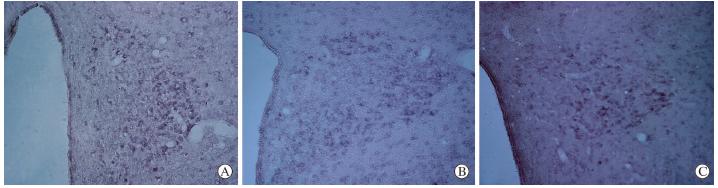 | 图 2 神经肽S(NPS) mRNA在各组大鼠下丘脑背内侧核内的表达A:正常对照(CC)组;B:环境对照(TC)组;C: 快速眼球运动(REM)睡眠剥夺(SD)组. Original magnification:×200 |
睡眠和觉醒的调节涉及复杂的神经环路,多种神经化学成分参与其中,而在参与觉醒系统的多种神经递质中,NPS是最新被报道的一种。NPS广泛分布在人、狗、牛、猪等动物组织中,尤其在脊椎动物的脑组织、唾液腺、甲状腺和乳腺中有较高表达,参与睡眠和觉醒、饮食、体温、代谢等多项生理功能的调节,其中尤其与睡眠及觉醒的关系最为密切[8]。
本实验中,我们对大鼠进行REM睡眠剥夺处理,试图探讨在REM睡眠缺失时机体是否会自动启动补偿机制。早期研究中,Xu等[9]对实验组和对照组小鼠分别进行侧脑室注射NPS和生理盐水,而后分别记录小鼠脑电图变化。结果发现,NPS注射组小鼠慢波睡眠的1期、2期和REM期睡眠时间明显缩短。作者认为,NPS介导的觉醒产生迅速,可能是通过激活单胺能系统起作用。这表明NPS能够促进唤醒,诱导觉醒,抑制睡眠。一项关于咖啡因与NPS关系的研究发现,大鼠下丘脑和脑干的NPS受体在经过咖啡因处理后均出现较高表达[5],说明NPS可能是咖啡因促进觉醒的机制。Oishi等[10]学者也证明NPS能有效促进觉醒,并显著缩短睡眠时间。这都提示NPS会显著促进或维持觉醒。
下丘脑背内侧核与机体的睡眠觉醒密切相关。本实验中,我们对进行REM睡眠剥夺处理的大鼠下丘脑NPS表达进行测定,结果显示,CC组与TC组之间大鼠下丘脑背内侧核内NPS阳性细胞数无明显差异,说明水环境对NPS蛋白和mRNA表达无明显影响。但SD组大鼠下丘脑背内侧核内NPS阳性细胞数比CC组、TC组明显升高,且与两组比较差异具有统计学意义(P<0.05),说明REM睡眠剥夺可引起下丘脑内背内侧核NPS蛋白和mRNA的表达上调。上述结果提示当存在外界刺激,导致机体无法正常睡眠时,机体会自动启动保护和调节机制,通过下丘脑分泌NPS以维持和促进觉醒,证实NPS可能参与机体的促觉醒调节过程。
| [1] | Alkadhi K, Zagaar M, Alhaider I, Salim S, Aleisa A. Neurobiological consequences of sleep deprivation[J]. Curr Neuropharmacol,2013, 11:231-249. |
| [2] | Nishida M, Pearsall J, Buckner R L, Walker M P. REM sleep, prefrontal theta, and the consolidation of human emotional memory[J]. Cereb Cortex,2009,19:1158-1166. |
| [3] | Rakitin B C, Tucker A M, Basner R C, Stern Y. The effects of stimulus degradation after 48 hours of total sleep deprivation[J]. Sleep, 2012, 35:113-121. |
| [4] | Valsalan R, Manoj N. Evolutionary history of the neuropeptide S receptor/neuropeptide S system[J]. Gen Comp Endocrinol,2014, 209:11-20. |
| [5] | Lage R, Diéguez C, López M. Caffeine treatment regulates neuropeptide S system expression in the rat brain[J]. Neurosci Lett, 2006,410:47-51. |
| [6] | Zagaar M, Alhaider I, Dao A, Levine A, Alkarawi A, Alzubaidy M, et al. The beneficial effects of regular exercise on cognition in REM sleep deprivation: behavioral, electrophysiological and molecular evidence[J]. Neurobiol Dis,2012, 45:1153-1162. |
| [7] | 刘 芳,许家军,龙建纲,向正华,沈 慧,张传森,等.地高辛原位杂交显示锌转运体3 mRNA在脑、脊髓和脊神经节中的分布[J].解剖学杂志,2008,31:747-750. |
| [8] | Reinscheid R K. Neuropeptide S: anatomy, pharmacology, genetics and physiological functions[J]. Results Probl Cell Differ, 2008,46:145-158. |
| [9] | Xu Y L, Gall C M, Jackson V R, Civelli O, Reinscheid R K. Distribution of neuropeptide S receptor mRNA and neurochemical characteristics of neuropeptide S-expressing neurons in the rat brain[J].J Comp Neurol,2007, 500:84-102. |
| [10] | Oishi M, Kushikata T, Niwa H, Yakoshi C, Ogasawara C, Calo G, et al. Endogenous neuropeptide S tone influences sleep-wake rhythm in rats[J]. Neurosci Lett,2014,581:94-97. |
 2015, Vol. 36
2015, Vol. 36


