胃癌是严重威胁人类生命健康的恶性肿瘤,70%以上新发病例和死亡病例在发展中国家,在发展中国家其发病率男性位于恶性肿瘤第2位,女性位于第4位,死亡率男性位于恶性肿瘤第3位,女性位于第4位[1],我国是胃癌高发国家。目前手术切除病灶并行D2淋巴结清扫是治愈胃癌的最主要方法之一,研究发现胃切缘镜下肿瘤残留是影响预后的不良因素,尤其是对于TNM分期为Ⅰ~Ⅱ期患者[2],术后病理N0者再手术保证切缘肿瘤无残留可明显改善患者预后[3, 4]。Aruello等[5]研究发现,对于R1切除且肿瘤转移淋巴结个数小于3个者预后主要取决于肿瘤切缘残留,应再次手术确保切缘无肿瘤残留。因此,在行胃癌根治术时选择距病灶恰当的位置离断胃腔至关重要,病灶距离切缘过短需要术中冰冻残端或面临再次手术的风险,病灶距离切缘过长则切除胃组织多,影响消化道重建,增加术后并发症的发生率及降低术后生活质量。
胃癌细胞易通过超越病灶范围的黏膜下层浸润转移,为了防止吻合口复发倾向,术中常增大病灶与切缘间的距离,且病灶距离切缘多≥5 cm。前期研究[6]发现肿瘤局限于肌层以下浸润超出病灶范围≤3 cm,肿瘤侵犯浆膜层浸润超出病灶距上切缘距离(PRM)≤6 cm。日本胃癌规约第3版规定T1期PRM≥2 cm,T2~T4期≥3 cm,弥漫浸润型≥5 cm[7]。我国胃癌诊疗规范(2011版)中要求局限性生长型病灶PRM≥3 cm,弥漫浸润生长型PRM≥5 cm。Kim等[8]研究发现在早期胃癌中保证切缘清晰的情况下PRM>1 mm即可达到不影响患者生存的目的,另有研究建议贲门胃底癌累及食管下端分化较好者PRM应≥2 cm,分化较差者应≥4 cm[9],PRM≥3.8 cm是影响食管胃结合部(gastroesophageal junction,GEJ)癌预后的独立危险因素[10]。病灶下端离断距离多至幽门环远端2~4 cm,下切缘距离(DRM)变化相对于PRM较小。上述研究或指南提示达到R0切除是手术的终极目标,而PRM和DRM的确切范围还存在争议,本研究主要探讨胃癌R0切除且无远处转移患者预后与PRM、DRM距离的关系。 1 资料和方法 1.1 患者入选情况
选取于2008年1月至2009年11月在我院普通外科行胃癌根治术患者进行回顾性研究,其纳入标准为:(1)胃癌根治术D2淋巴结清扫,术后病理证实为腺癌,上下切端无肿瘤残留,无远处转移或D3淋巴结肿瘤累及;(2)术前未行新辅助放化疗,术后按照TNM分期予规范放化疗;(3)未发生围手术期并发症,术后生存期大于1个月;(4)术前未合并其他部位恶性肿瘤;(5)具有完整规范的术后病理报告及随访资料。共288例符合纳入标准。患者临床病理信息通过我院信息科病历翻拍系统调阅汇总。 1.2 观察指标
手术方式分为全胃切除术和胃次全切除术(包括近端胃切除术和远端胃切除术);术前血清肿瘤标记物升高(CEA、CA19-9、CA72-4任何1项升高);病灶大小(最大长径)、PRM距离及DRM距离于切除大体标本甲醛充分固定大于12 h后测量;TNM分期(其中清扫淋巴结总数≥15个)及G分期按照胃癌NCCN指南(2013版)标准进行,其中G1~G3依次为高、中、低分化;术后复发:局部区域复发包括局部淋巴结复发(可致梗阻性黄疸)、残胃复发、吻合口复发等,远处复发包括血行转移(如肝、骨等)、腹膜转移等,术后复发诊断主要依靠体格检查、影像学检查及消化内镜。随访开始于患者出院,终点为死亡,随访截止时间为2014年12月,平均随访时间(52.10±27.24)个月,随访主要采用电话、住院治疗病程记录两种方式。 1.3 统计学处理
采用SPSS 18.0进行数据分析,计量资料采用Wilcoxon检验,计数资料采用χ2检验,采用Kaplan-Meier法进行生存分析,采用 Log-rank 法进行显著性检验,Cox单因素分析与生存相关因素,多因素分析采用Cox比例风险回归模型。检验水准(α)为0.05。 2 结 果 2.1 临床病理资料分析
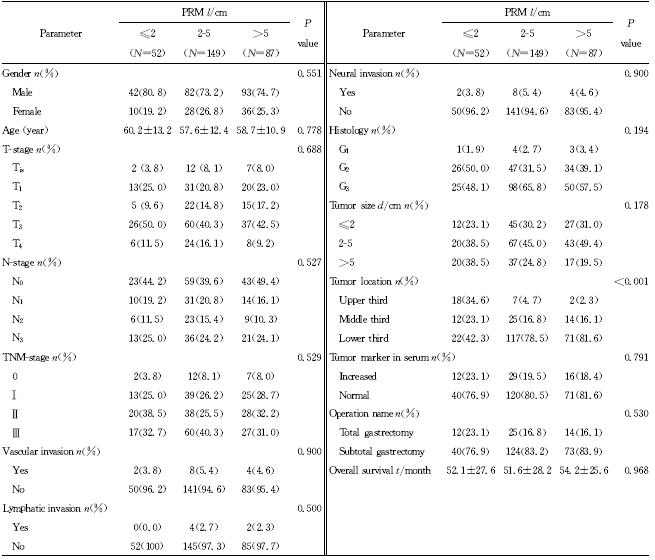
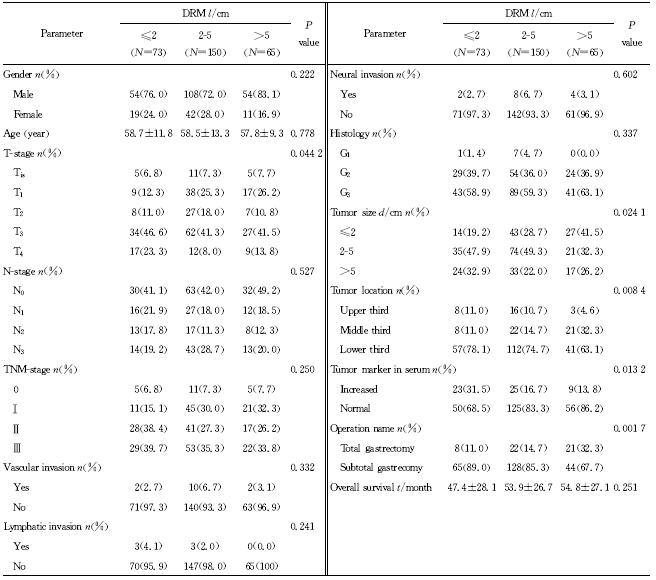
结果(表 1)表明:288例胃癌患者,男216例,女72例,男∶女=3∶1,平均年龄(58.4±12.1)岁。PRM 分布范围0.2~25 cm,平均(4.59±2.82)cm;PRM≤2 cm 52例(18.1%),2 cm<PRM≤5 cm 149例(51.7%),PRM>5 cm 87例(30.2%);DRM 分布范围0.1~12 cm,平均(4.03±2.32)cm,DRM≤2 cm 73例(25.3%),2 cm<DRM≤5 cm 150例(52.1%),DRM>5 cm 65例(22.6%)。PRM距离增大与病灶位于胃下1/3显著相关(P<0.001)。DRM 距离增大与肿瘤T分期较早(P=0.044 2)、病灶位于胃中1/3(P= 0.008 4)、病灶较小(P=0.024 1)、术前血清肿瘤标记物正常(P=0.013 2)和全胃切除术(P=0.001 7)显著相关(表 2),其中血清肿瘤标记物的变化可能与肿瘤大小、病灶T分期相关。不同PRM距离患者的平均生存期差异无统计学意义(P=0.968),不同DRM距离患者的平均生存期差异亦无统计学意义(P=0.251)。
| 表 1 PRM距离与临床病理指标的相关性分析 Tab 1 Association of clinicopathological factors with PRM distance |
| 表 2 DRM距离与临床病理指标的相关性 Tab 2 Association of clinicopathological factors with DRM distance |
通过Cox单因素分析得出与胃癌生存相关的具有统计学意义(P<0.05)的因素包括:术前肿瘤标记物、病灶部位、病灶大小、T分期、N分期、TNM分期、G分级、血管侵犯、淋巴管侵犯、神经侵犯,而PRM距离(P=0.650)及DRM距离(P=0.095)不是影响胃癌生存的主要因素。对单因素Cox回归分析有统计学意义的变量、PRM、DRM距离交叉肿瘤部位及 PRM、DRM距离交叉肿瘤大小进行多因素Cox回归分析发现:N分期、病灶部位、病灶大小、淋巴管侵犯是胃癌预后的独立危险因素(表 3),即病灶位 于胃下1/3、病灶直径较大、N分期晚、侵犯淋巴管提示胃癌预后不良。
| 表 3 胃癌预后影响因素的Cox比例风险回归模型分析 Tab 3 Multivariate analysis of prognostic factors by Cox proportional hazard regression model |
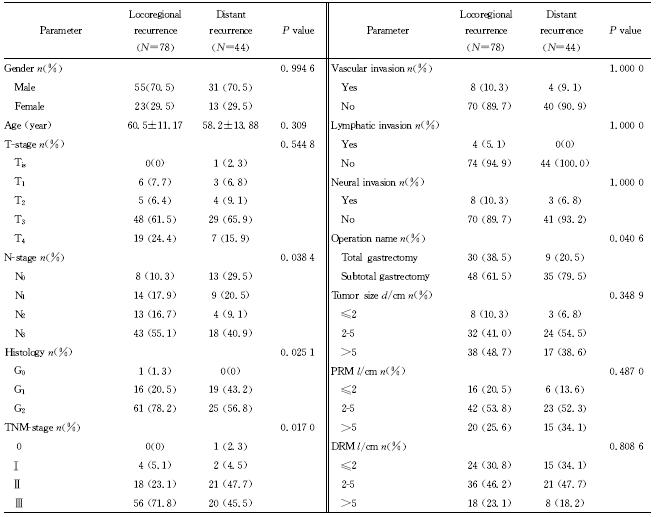
本研究288例胃癌患者,其中122例复发,随访截止时间全部死亡,局部区域复发78例,远处复发44例,不同复发形式 与N分期 (P=0.038 4)、TNM分期 (P=0.017 0)、 组织分化 (P=0.025 1)、全胃切除术(P=0.040 6)相关,而PRM距离及DRM距离在两种复发形式间差异无统计学意义(表 4)。
| 表 4 局部区域复发及远处复发临床病理特点的比较 Tab 4 Comparison of clinicopathological factors between locoregional recurrence and distant recurrence |
288例 胃癌患 者,不同PRM(P=0.650)、DRM(P=0.095) 距离对胃癌生存的影响无显著差异(图 1)。 亚组分析将全部病例按照N分期分为N0+N1(180例)和 N2+N3(108例)两组,组内分析PRM、DRM距离对 生存的影响,提示不同PRM距离对N0+N1组内生存的影响无显著差异(P=0.312),而DRM距离对于N0+N1组内胃癌生存的影响有 显著差异(P=0.011),其中DRM≤2 cm患者较 2 cm<DRM≤5 cm 及DRM>5 cm患者5年累计 生存率明显降低(图 2)。在N2+N3组内,不同 PRM距离(P=0.629)、不同DRM距离(P=0.760) 对生存情况的影响无显著差异。将全部病例按照 TNM分期分为0+Ⅰ+Ⅱ期(184例)和Ⅲ期(104 例)两组,进行生存分析发现0+Ⅰ+Ⅱ期组内,不同PRM距离(P=0.401)、不同DRM距离(P=0.094)对生存的影响无显著差异;Ⅲ期组内,不同PRM距离(P=0.486)、不同DRM距离(P=0.848)对生存的影响亦无显著差异。将全部病例按照G分级分为G1+G2(115例)和G3(173例)两组,进行生存分析发现G1+G2组及G3组内不同PRM、DRM距离对生存的影响均无显著差异。
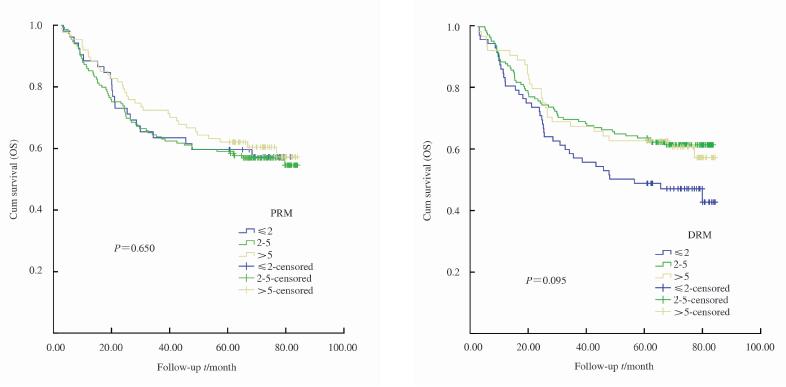 | 图 1 不同PRM、DRM距离胃癌患者术后生存曲线 Fig 1 Survival curves of patients with different PRM,DRM distances after gastrectomy |
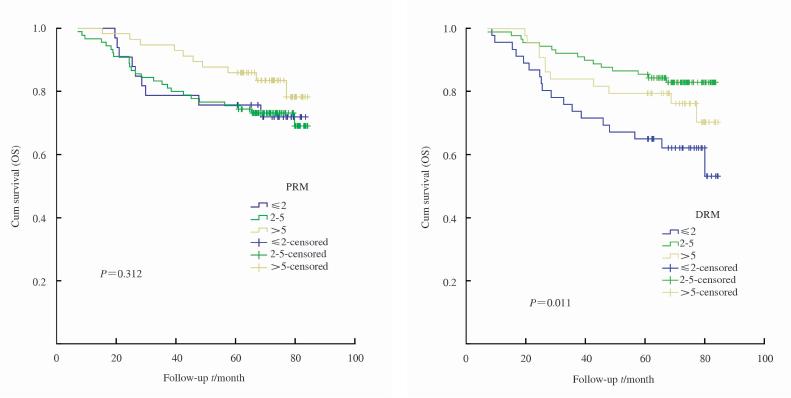 | 图 2 不同PRM、DRM距离N0+N1组胃癌患者术后生存曲线 Fig 2 Survival curves of patients with different PRM,DRM distances after gastrectomy in subgroup N0+N1 |
目前关于胃癌PRM距离的研究普遍认为:为保证切缘肿瘤无残留,建议进展期胃癌PRM距离为3~6 cm,早期胃癌PRM 距离为2~3 cm,浸润型胃癌适当延长PRM距离,必要时需要术中冰冻明确切缘肿瘤残留情况[11]。对于DRM距离研究较少,因为全胃切除术或远端胃切除术,离断胃远端的位置多为幽门环远端2~4 cm,增加DRM距离则增大损伤十二指肠乳头的风险,目前DRM距离对胃癌生存的影响不甚明确。Kim等[12]发现在病灶位于胃上部者中PRM小于2 cm增加复发风险;另有研究证实PRM小于3 cm降低胃癌患者生存率[13]。上述研究中的不良预后可能是肿瘤本 身恶性浸润或切缘肿瘤残留导致。本研究排除远处转移及切缘阳性患者,可以更好地明确切缘距离与胃癌生存的关系。
本研究结果发现PRM及DRM不是影响胃癌生存的独立危险因素,PRM及DRM对复发形式的影响亦无显著差异,与Ohe等[14]的研究结果类似。本研究发现与胃癌生存相关的独立危险因素包括:N分期、病灶部位、病灶直径、淋巴管侵犯。以N分期进行亚组分析发现不同PRM距离对N0+N1组内生存的影响无显著差异,而DRM距离对于N0+N1组内胃癌生存的影响有显著差异,其中DRM≤2 cm 患者较2 cm<DRM≤5 cm及DRM>5 cm患者5年累计生存率明显降低,提示在淋巴结阳性转移数目≤2个的胃癌患者中行胃癌根治术时保证DRM>2 cm可明显改善患者预后,如果病灶距幽门环较近,应注意防止损伤十二指肠乳头;若行近端胃切除术,DRM应在保证残胃大于1/2的情况下尽可能远离病灶离断残胃,除非病变分期较晚,否则应改行全胃切除术。G分级亚组分析中G1+G2组近似为Lauren组织分型中的肠型,而G3相当于Lauren分型中的弥漫型,所以提示不同Lauren分型下不同PRM、DRM距离亦非影响生存的关键因素,即使是弥漫型胃癌只要保证R0切除,增加切缘距离对预后无显著改善。上切缘肿瘤细胞无残留是术后预后良好的关键所在,切除标本肉眼观察切缘肿瘤残留情况,必要时应行术中组织冰冻检查,保证实现肿瘤R0切除。对于食管结合部肿瘤,切除食管下端距离过长可致消化道重建困难及术后并发症发生率增高,所以保证R0切除肿瘤即可,增大PRM距离对患者整体生存无意义且增加手术风险。
当然,本研究样本量仍有限,相关结论存在一定的偏倚,关于胃癌上下切缘距离与预后的确切关系还需要多中心病例的更深一步研究,获得更细致的亚组分析结果以指导手术治疗。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Jemal A, Bray F, Center M M, Ferlay J, Ward E, Forman D. Global cancer statistics[J]. CA Cancer J Clin,2011,61:69-90. |
| [2] | Sun Z, Li D M, Wang Z N, Huang B J, Xu Y, Li K, et al. Prognostic significance of microscopic positive margins for gastric cancer patients with potentially curative resection[J]. Ann Surg Oncol, 2009, 16: 3028-3037. |
| [3] | Lee J H, Ahn S H, Park do J, Kim H H, Lee H J, Yang H K. Clinical impact of tumor infiltration at the transected surgical margin during gastric cancer surgery[J]. J Surg Oncol, 2012, 106: 772-776. |
| [4] | Cho B C, Jeung H C, Choi H J, Rha S Y, Hyung W J, Cheong J H, et al. Prognostic impact of resection margin involvement after extended (D2/D3) gastrectomy for advanced gastric cancer: a 15-year experience at a single institute[J]. J Surg Oncol, 2007, 95: 461-468. |
| [5] | Aurello P, Magistri P, Nigri G, Petrucciani N, Novi L, Antolino L, et al. Surgical management of microscopic positive resection margin after gastrectomy for gastric cancer: A systematic review of gastric R1 management[J]. Anticancer Res, 2014, 34: 6283-6288. |
| [6] | Bozzetti F, Bonfanti G, Bufalino R, Menotti V, Persano S, Andreola S, et al. Adequacy of margins of resection in gastrectomy for cancer[J]. Ann Surg, 1982, 196: 685-690. |
| [7] | Japanese Gastric Cancer A. Japanese gastric cancer treatment guidelines 2010 (ver.3) [J]. Gastric Cancer, 2011, 14: 113-123. |
| [8] | Kim B S, Oh S T, Yook J H, Kim H S, Lee I S, Kim B S. Appropriate gastrectomy resection margins for early gastric carcinoma[J]. J Surg Oncol, 2014, 109: 198-201. |
| [9] | Tsujitani S, Okuyama T, Orita H, Kakeji Y, Maehara Y, Sugimachi K, et al. Margins of resection of the esophagus for gastric cancer with esophageal invasion[J]. Hepatogastroenterology, 1995, 42: 873-877. |
| [10] | Barbour A P, Rizk N P, Gonen M, Tang L, Bains M S, Rusch V W, et al. Adenocarcinoma of the gastroesophageal junction: influence of esophageal resection margin and operative approach on outcome[J]. Ann Surg, 2007, 246: 1-8. |
| [11] | Shin D, Park S S. Clinical importance and surgical decision-making regarding proximal resection margin for gastric cancer[J]. World J Gastrointest Oncol, 2013, 15: 4-11. |
| [12] | Kim J H, Park S S, Kim J, Boo Y J, Kim S J, Mok Y J, et al. Surgical outcomes for gastric cancer in the upper third of the stomach[J]. World J Surg, 2006, 30: 1870-1878. |
| [13] | Ha T K, Kwon S J. Clinical importance of the resection margin distance in gastric cancer patients[J]. J Korean Gastric Cancer Assoc, 2006, 6: 277-283. |
| [14] | Ohe H, Lee W Y, Hong S W, Chang Y G, Lee B. Prognostic value of the distance of proximal resection margin in patients who have undergone curative gastric cancer surgery[J]. World J Surg Oncol, 2014, 23: 296. |
 2015, Vol. 36
2015, Vol. 36