2. 复旦大学附属妇产科医院病理科, 上海 200090;
3. 南通大学神经再生重点实验室, 南通 226001
2. Department of Pathology, the Obstetrics and Gynecology Hospital Affiliated to Fudan University, Shanghai 200090, China;
3. Key Laboratory of Neuroregeneration, Nantong University, Nantong 226001, Jiangsu, China
神经再生研究(neural regeneration research)是目前神经科学的热点和难点,其中具有良好组织相容性和低免疫原性人工神经的制备是神经再生领域重要的研究方向[1, 2, 3]。细菌纤维素(bacterial cellulose,BC)是一种纳米材料,是由葡萄糖以β-1,4糖苷键连接而成的高分子化合物,与天然纤维素的结构非常相似[4],具有作为优良生物材料的如下特性[5]:高化学纯度和高结晶度;较强的持水能力;生物适应性高,可直接降解,在酸性微生物及纤维素酶催化等条件下,最终降解成单糖等小分子物质,对环境无污染;具有很强的亲水性、黏稠性和稳定性;生物合成过程可调控;BC的纤维直径 0.01~0.1 μm,且抗拉强度高。近年来,BC已被广泛用于食品、造纸、纺织、建材、声学器材以及生物医学等许多领域,成功应用于烧烫伤、慢性溃疡患者皮肤移植,并作为骨支架和人工血管材料初步应用于临床[6, 7, 8, 9, 10]。但目前将BC用于外周神经修复的报道较少。
雪旺细胞是周围神经的胶质细胞,在外周神经损伤后,大量增殖并分泌多种神经生长因子,对外周神经的再生起着至关重要的作用,能否将细菌纤维素这种新型的生物材料制备成组织工程化神经应用于外周神经修复,首先要考虑细菌纤维素对雪旺细胞有无影响[11, 12]。因此,本研究采用细菌纤维素膜与背根神经节共培养来观察雪旺细胞在其表面的生长情况,并观察坐骨神经来源的雪旺细胞在细菌纤维素浸出液中的生长情况,综合评价细菌纤维素与雪旺细胞的生物相容性,为细菌纤维素应用于外周神经损伤后的修复提供实验依据。 1 材料和方法 1.1 主要试剂及实验动物
DMEM培养基(Gibco公司);胎牛血清(杭州四季青有限公司);L-多聚赖氨酸(Sigma公司),mouse anti rat S-100 monoclonal antibody,goat anti mouse IgG conjugated TRITC,青-链霉素均购自Sigma公司;0.01 mol/L PBS(pH 7.2)、 0.2 mol/L PBS(pH 7.2)、封闭液、0.2 mol/L二甲砷酸钠缓冲液、4%戊二醛、2%锇酸(OSO4)、1%锇酸溶液、荧光封片液均购自国药集团化学试剂有限公司。实验动物选用新生1 d的SD大鼠(SPF级,南通大学实验动物中心提供)。 1.2 主要仪器
细胞培养箱(TEHER CPD-170EX,Japan);正置研究级显微镜(DMR HC Leica,Germany;配荧光及Leica DC300F数码相机);荧光倒置显微镜(Ⅸ-70 Olympus,Japan);扫描电镜(JEM-T300 JEOL Inc.,Japan)。 1.3 细菌纤维素膜及其浸出液的制备
参照文献[4],按绿茶(干基)∶糖∶水=0.5∶100∶1 000的比例制成基础发酵培养基,将红茶菌菌种置于盛有基础发酵培养基的消毒后浅盘中,在恒温(30℃)条件下静态培养7 d后,产生的细菌纤维素膜会浮于液面,取出后用双蒸水反复冲洗以去除表面培养基及杂质。再将细菌纤维素膜浸泡于0.1 mol/L NaOH溶液,100℃煮沸20 min,以去除其中的残留培养基和菌体,细菌纤维素膜呈乳白色、半透明。将制备好的细菌纤维素膜置于烧杯中,消毒备用。
参照文献[13],将消毒后细菌纤维素膜用DMEM完全培养基在(37±0.5)℃下浸泡72 h (6 cm2膜:1 mL完全培养基),制备好的浸出液在24 h内使用。 1.4 背根神经节与细菌纤维素膜共培养
取出生1 d的SD大鼠,分离双侧背根神经节后置于DMEM培养基中,除去表面结缔组织;将细菌纤维素膜贴附于圆形盖玻片上消毒(不必烘干)后置于培养基中湿润浸泡30 min;再将背根神经节放置于细菌纤维素膜上,加入DMEM培养基(含10% FBS,每孔约1 000 μL),置于37℃、5% CO2培养箱中孵育,隔天半量更换培养液,在倒置显微镜下观察背根神经节中细胞生长、迁移情况,培养第1天、第2天和第5天时行免疫细胞化学染色及扫描电镜观察。其中,免疫细胞化学染色主要观察周围神经组织中雪旺细胞特殊标记物S-100蛋白的表达[14]。 1.5 雪旺细胞在细菌纤维素膜浸出液中的生长
取新生1 d的SD大鼠,取出双侧坐骨神经,尽量剥除神经外膜,采用0.125%胰蛋白酶消化的方法得到相对纯化的雪旺细胞;以105接种于六孔板,24 h后可见细胞贴壁,后每24 h将其中1孔的完全培养基置换成细菌纤维素浸出液,可以得到总生长时间相同,但在浸出液中生长时间分别为24、48、72 h的雪旺细胞,倒置显微镜观察浸出液中雪旺细胞生长情况,并将每个时间点细胞予以拍照,并行免疫细胞化学染色、MTT细胞活力检测、流式细胞仪检测细胞周期[15]。 1.6 统计学处理
采用SPSS 19.0统计软件,计量数据以 x±s 表示,检验水准(α)为0.05。 2 结 果 2.1 背根神经节在细菌纤维素膜上生长 2.1.1 光镜下观察
背根神经节在细菌纤维素膜上培养24 h后,光镜下可见神经纤维从背根节上伸出,一端连接于背根节上,一端连接于细菌纤维素膜上;2 d时少量细胞爬出背根神经节,此时大多细胞呈球形,贴附于细菌纤维素膜上,有些为短梭形,突起较少且短;5 d时更多细胞从背根节爬出,此时细胞 胞体呈长梭形,其两个长长的突起一端与背根节相连,另一端附着于细菌纤维素膜上,有些细胞成团贴附于膜上,有的为单个细胞黏附于膜上;培养5 d后更多细胞从背根神经节中爬出,细胞成串珠样或放射状排列(图 1)。
 | 图 1 光镜下观察不同时间点背根节在细菌纤维素膜上生长A: 24 h; B: 2 d; C: 5 d. Original magnification:×100 |
2.1.2 免疫细胞化学染色
背根神经节在细菌纤维素膜上培养2 d时,免疫细胞化学结果显示培养的细胞为S-100蛋白阳性表达的雪旺细胞,呈圆形或梭形,突起较短;培养5 d时细胞呈长梭形,突起较长,细菌纤维素膜贴附良好(图 2)。
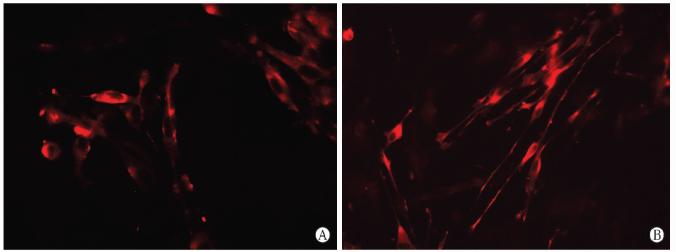 | 图 2 免疫细胞化学染色观察细菌纤维素膜上细胞S-100蛋白表达背根神经节在细菌纤维素膜上培养2 d(A)、5 d(B). Original magnification:×400 |
背根神经节在细菌纤维素膜上培养24 h后,在扫描电镜下观察可见神经纤维从背根节上伸出;培养2 d后,雪旺细胞呈圆形或短梭形紧紧贴附在细菌纤维素膜上;培养5 d后,可见细胞形态规则,呈长梭形并肩或首尾相连、排列紧密,单层甚至多层细胞紧密贴附于细菌纤维素膜上(图 3)。
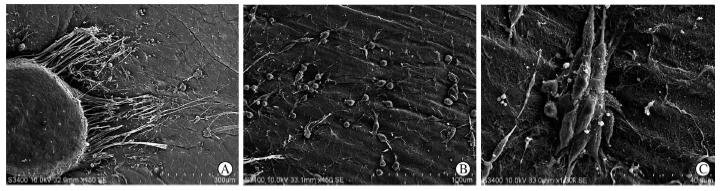 | 图 3 背根神经节在细菌纤维素膜上培养不同时间点扫描电镜观察A: 培养24 h;B: 培养2 d;C:培养5 d |
分别将雪旺细胞在15% DMEM培养基及细菌纤维素浸出液中培养24、48、72 h,在整个培养过程中,细菌纤维素浸出液中雪旺细胞的形态与正常培养基中雪旺细胞的形态在光镜下无明显差别,细胞均呈梭形,边缘清晰,透亮有光泽(图 4)。
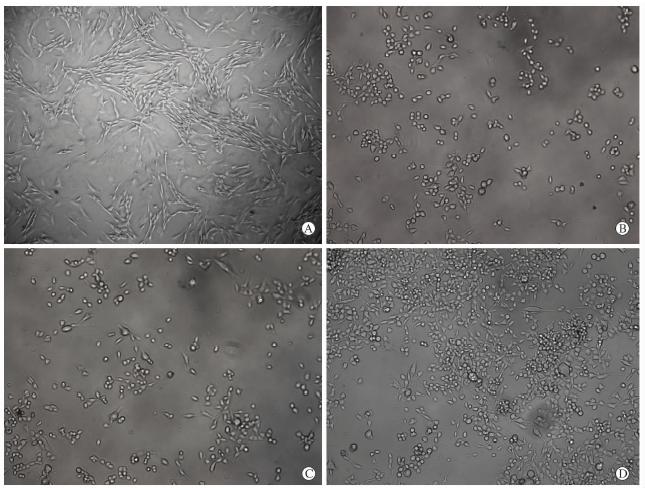 | 图 4 雪旺细胞在普通培养基(A)及细菌纤维素浸出液(B~D)中培养不同时间点光镜下观察A:普通培养基; B: 24 h; C: 48 h; D: 72 h. Original magnification:×100 |
免疫细胞化学染色显示细菌纤维素浸出液中培养的细胞S-100蛋白阳性,随着培养时间的延长(24~72 h),细胞胞体逐渐由圆形变成长梭形,突起也逐渐变长,可以证实为雪旺细胞,其与正常培养基中生长的雪旺细胞没有明显形态学差异(图 5)。
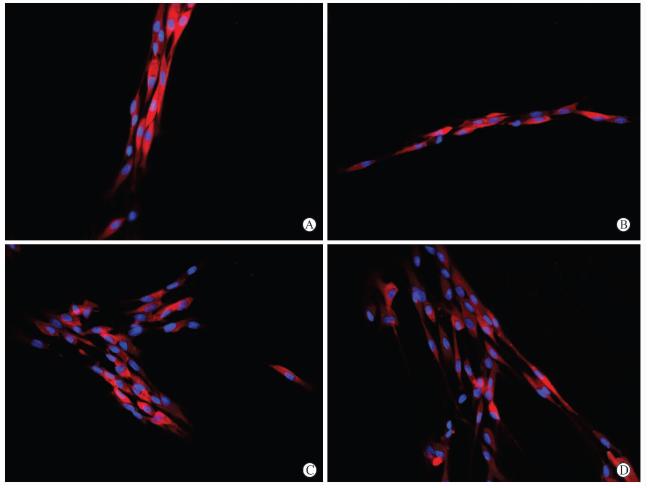 | 图 5 普通培养基及细菌纤维素浸出液中雪旺细胞免疫细胞化学染色A:普通培养基;B:细菌纤维素浸出液中培养24 h;C:细菌纤维素浸出液中培养48 h;D:细菌纤维素浸出液中培养72 h. Original magnification:×400 |
2.2.3 雪旺细胞活力的观察
MTT结果(图 6)显示:在细菌纤维素浸出液中生长 24、48、72 h的雪旺细胞活力与在普通培养基中生长的雪旺细胞差异无统计学意义(P>0.05,图 6)。
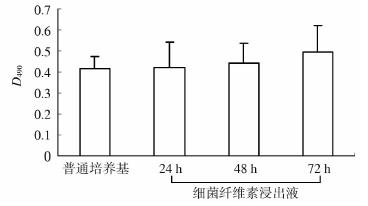 | 图 6 普通培养基及细菌纤维素浸出液中雪旺细胞活力的对比 n=3,x±s |
2.2.4 雪旺细胞增殖能力的观察
雪旺细胞在15% DMEM培养基及在细菌纤维素浸出液中分别培养24 h、48 h和72 h,使用流式细胞仪进行细胞周期分析,结果显示各组间各期细胞的比例差异无统计学意义(表 1)。
| 表 1 细菌纤维素浸出液及15% DMEM中雪旺细胞细胞周期的比较 |
细菌纤维素是一种新型的纳米生物材料,其表面可以通过机械或化学修饰有利于细胞及一些具有生物活性的分子黏附,并在降解过程中释放生物活性物质。临床上已被用作烧伤皮肤的敷料、骨支架、人工血管等,但其应用于外周神经损伤后的修复报道较少。本研究采用细菌纤维素与雪旺细胞共培养,初步探讨细菌纤维素与雪旺细胞的生物相容性,为今后将细菌纤维素制备成组织工程化神经提供了实验依据。
雪旺细胞是周围神经最主要的胶质细胞,参与髓鞘形成,在外周神经出现损伤或病变后,雪旺细胞大量增殖并形成Büngner带,桥连神经缺损区,引导轴突生长;同时分泌多种促神经生长因子,进一步引导和促进轴突再生,并且包裹轴突形成髓鞘。因此在研究细菌纤维素能否作为生物材料来修复外周神经损伤时,首先要考虑细菌纤维素对雪旺细胞生长的影响。背根神经节是脊神经背侧一椭圆形膨大组织,由雪旺细胞、感觉神经元及成纤维细胞组成,它既含有髓神经纤维,又有无髓神经纤维存在,能很好地模拟体内神经再生的环境,是研究周围神经再生及中枢神经发育良好的模型[16]。
本研究通过扫描电镜、免疫细胞化学染色发现雪旺细胞能在细菌纤维素膜表面良好生长;将纯化的雪旺细胞在细菌纤维素浸出液中培养,通过形态学观察、细胞活力检测、细胞周期检测及免疫细胞化学染色发现细菌纤维素浸出液对细胞的正常生长、增殖及蛋白的表达没有明显影响。这些结果都提示细菌纤维素与雪旺细胞在体外具有良好的生物相容性,为其将来作为人工神经应用于临床提供了实验依据。当然,细菌纤维素能否作为修复周围神经缺损的生物材料并应用于临床还需要更多的实验证明,尤其是动物体内实验显得尤为重要,这方面我们会在今后的实验中进一步研究和探讨。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Pan Y, Zhang Y, Gao X, Jia J, Gao J, Ma Z. Scientific progress regarding neural regeneration in the Web of Science: A 10-year bibliometric analysis[J].Neural Regen Res,2013,8:3449-3454. |
| [2] | Ogawa T, Takezawa K, Shimizu S, Shimizu T. Valproic acid promotes neural regeneration of olfactory epithelium in adult mice after methimazole-induced damage[J].Am J Rhinol Allergy, 2014,28:e95-e99. |
| [3] | Bakhshinejad B, Sadeghizadeh M. Bacteriophages and development of nanomaterials for neural regeneration[J]. Neural Regen Res,2014,9:1955-1958. |
| [4] | Dugan J M, Gough J E, Eichhorn S J. Bacterial cellulose scaffolds and cellulose nanowhiskers for tissue engineering[J]. Nanomedicine (Lond), 2013,8:287-298. |
| [5] | Yamanaka S, Watanabe K, Kitamura N, Iguchi M, Mitsuhashi S, Nishi Y, et al. The structure and mechanical properties of sheets prepared from bacterial cellulose[J].J Mater Sci,1989,24:3141-3145. |
| [6] | Bodin A, Bharadwaj S, Wu S, Gatenholm P, Atala A, Zhang Y. Tissue-engineered conduit using urine-derived stem cells seeded bacterial cellulose polymer in urinary reconstruction and diversion[J]. Biomaterials,2010,31: 8889-8901. |
| [7] | Bäckdahl H, Helenius G, Bodin A, Nannmark U, Johansson B R, Risberg B, et al. Mechanical properties of bacterial cellulose and interactions with smooth muscle cells[J].Biomaterials,2006,27:2141-2149. |
| [8] | Saska S, Scarel-Caminaga R M, Teixeira L N, Franchi L P, Dos Santos R A, Gaspar A M, et al. Characterization and in vitro evaluation of bacterial cellulose membranes functionalized with osteogenic growth peptide for bone tissue engineering[J].J Mater Sci Mater Med,2012,23:2253-2266. |
| [9] | Esguerra M, Fink H, Laschke M W, Jeppsson A, Delbro D, Gatenholm P,et al. Intravital fluorescent microscopic evaluation of bacterial cellulose as scaffold for vascular grafts[J].J Biomed Mater Res A,2010, 93: 140-149. |
| [10] | Wippermann J, Schumann D, Klemm D, Kosmehl H, Salehi-Gelani S, Wahlers T. Preliminary results of small arterial substitute performed with a new cylindrical biomaterial composed of bacterial cellulose[J]. Eur J Vasc Endovasc Surg,2009,37:592-596. |
| [11] | Ramesh V. Merlin and the ERM proteins in Schwann cells, neurons and growth cones[J].Nat Rev Neurosci, 2004, 5:462-470. |
| [12] | Dubovy P. Schwann cells and endoneurial extra cellular matrix molecules as potential cues for sorting of regenerated axons[J]. A nat Scient,2004,79 :198-208. |
| [13] | Fini M, Motta A, Torricelli P, Giavaresi G, Nicoli Aldini N, Tschon M, et al. The healing of confined critical size cancellous defects in the presence of silk fibroin hydrogel[J].Biomaterials,2005,26:3527-3536. |
| [14] | Yang Y, Chen X, Ding F, Zhang P, Liu J, Gu X. Biocompatibility evaluation of silk fibroin with peripheral nerve tissues and cells in vitro[J].Biomaterials,2007,28:1643-1652. |
| [15] | Bäckdahl H, Helenius G, Bodin A, Nannmark U, Johansson B R, Risberg B, et al. Mechanical properties of bacterial cellulose and interactions with smooth muscle cells[J].Biomaterials,2006,27:2141-2149. |
| [16] | Snider W D, Zhou F Q, Zhong J, Markus A. Signaling the pathway to regeneration[J].Neuron,2002,35:13-16. |
 2015, Vol. 36
2015, Vol. 36


