2. 唐山市第二医院关节一科, 唐山 063000;
3. 河北联合大学基础医学院人体解剖学系, 唐山 063000;
4. 河北联合大学附属医院骨科, 唐山 063000;
5. 河北联合大学实验中心, 唐山 063000
2. Department of Joint Surgery Ⅰ, Second People's Hospital of Tangshan, Tangshan 063000, Hebei, China;
3. Department of Anatomy, Basic Medical College, Hebei United University, Tangshan 063000, Hebei, China;
4. Department of Orthopaedics, Affiliated Hospital, Hebei United University, Tangshan 063000, Hebei, China;
5. Experimental Center, Hebei United University, Tangshan 063000, Hebei, China
关节软骨外伤所导致软骨缺损日益增多,已成为临床常见骨科疾病之一。由于关节软骨的特殊结构使其内部无血液供应、无淋巴网络循环,因此成熟的关节软骨细胞在外伤后再生修复十分缓慢[1, 2]。以组织工程学方法修复缺损组织要考虑到支架材料、种子细胞及生长因子间的相互作用。良好的生物金属支架材料应具有适宜的强度及韧性、抗疲劳性及耐磨性,良好的生物相容性,在其植入位置上具有与生物体相适应的的理化性能,与宿主之间不引起毒性反应,能够承受生物体的各种不同的机械动作,同时当植入人体或动物体内后可支撑组织[3]。目前骨科使用的金属材料主要有不锈钢、镍、铬、钛及其合金。金属钽是近年兴起的骨科植入材料,属于贵金属材料。它克服了临床上常用的非孔隙植入材料的缺点,孔隙率可达到75%~80%,三维立体空间构型同时具有适宜的孔径,这种结构具有与人类松质骨相似并有利于细胞黏附、向内生长及增殖的特点[4]。
除多孔金属支架材料外,细胞因子与种子细胞的关系是极为重要的基础环节。如关节软骨损伤修复时,除了需要从体外分离培养出足够优良的保有完整软骨细胞表型及分泌功能的软骨细胞外,还需要一些对软骨细胞生长、分化有利的细胞因子的刺激及调控[5]。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)广泛存在于多种细胞,是细胞有丝分裂促进蛋白,能参与细胞生长发育和组织损伤修复过程。其对软骨细胞增殖及分化具有促进作用,体外培养的软骨细胞在其作用下能有效地维持细胞表型,保持其分化状态,从而更好地保持软骨细胞的功能状态[6, 7]。
本研究采用与关节软骨修复密切相关的 bFGF、具有自主知识产权的国产多孔钽材料以及兔关节软骨细胞体外共同培养形成bFGF-多孔钽-软骨细胞复合物,通过形态学观察,细胞生长、增殖实验以及软骨相关基因表达等方法,检测不同浓度bFGF对促进软骨细胞生长与增殖,抑制其去分化差异,从而探讨bFGF-多孔钽-软骨细胞复合物作为组织工程复合材料对加速修复软骨缺损的可能性,为进一步体内移植实验提供依据。 1 材料和方法 1.1 实验动物、试剂及仪器
3周龄新西兰幼兔8只,雌雄不限,体质量300~350 g,由河北联合大学实验动物中心提供,合格证号:SCXK(京)010-0001。多孔钽材料由重庆润泽医疗器械有限公司提供。DMEM-F12培养液(Hyclone公司,美国),胎牛血清(杭州四季青生物公司),MTT试剂(Gibco公司,美国),TRIzol试剂(Invitrogen,美国),PrimeScriptTM RT Master Mix反转录试剂盒及SYBR Premix Ex TaqTM PCR扩增试剂盒(TaKaRa,日本),SABC免疫组化试剂盒(北京博奥森生物科技公司),bFGF(Sigma公司,美国),Ⅰ、Ⅱ、Ⅸ和Ⅹ型胶原抗兔多克隆抗体(北京博奥森生物科技公司),倒置相差显微镜(Nikon公司,日本),Multiskan-mk3型酶标仪、S-4800扫描电镜(Thermo公司,美国),Rotor Gene 3000定量PCR仪(Corbett Research,澳大利亚)。 1.2 兔双膝关节软骨细胞分离培养
3周龄新西兰幼兔,耳缘静脉空气栓塞处死。无菌条件下剪开幼兔两侧膝关节,手术尖刀片刮取关节表面软骨组织,放入PBS中浸泡,超净台内将软骨剪碎至1 mm3大小。加入5 mL 0.25%的胰蛋白酶消化,吹打后弃上清,PBS充分清洗,加入2 g/L的Ⅱ型胶原酶5 mL,消化3~4 h。到大部分细胞游离时,经200目筛网过滤,收集细胞,低温1 000 r/min (r=8 cm) 离心10 min,弃上清,加入体积分数为15%胎牛血清的DMEM培养基,使细胞密度达1×105/mL,接种于细胞培养瓶中,放置于37℃、5% CO2培养箱中培养。倒置相差显微镜观察细胞形态及生长,待细胞生长达80%左右时传代。 1.3 bFGF-多孔钽-软骨细胞复合物的制备及分组
多孔钽材料经75%乙醇、超纯水浸泡及清洗,高压蒸汽灭菌后干燥,37℃、5% CO2培养箱内备用。 取第3代培养的软骨细胞,调整细胞密度为1×105/mL,接种于多孔钽材料中心部位,后置于37℃、5% CO2孵育箱内孵育1 h,翻转,加入DMEM-F12完全培养基继续培养。每日倒置相差显微镜下观察软骨细胞与多孔钽复合生长情况。根据培养基内加入细胞因子bFGF的浓度分为5组:1 ng/mL bFGF-多孔钽-软骨细胞(A组),10 ng/mL bFGF-多孔钽-软骨细胞(B组),50 ng/mL bFGF-多孔钽-软骨细胞 (C组),多孔钽-软骨细胞(D组),单纯软骨细胞(E组)。 1.4 MTT法检测bFGF-多孔钽-软骨细胞复合物中软骨细胞增殖状态
按上述分组将不同浓度 bFGF-多孔钽-软骨细胞复合物依次接种于5块24孔板内,恒温箱中培养。分别于1、2、3、4、5、6 d时每孔加入10 μL MTT试剂及150 μL DMSO,待紫色结晶形成后,在酶标仪上检测,选用波长为590 nm的滤光片进行光密度(D590)值的测定。 1.5 bFGF-多孔钽-软骨细胞复合物扫描电镜观察
参照张岭等[8]方法,取体外培养1~6 d的bFGF-多孔钽-软骨细胞复合物,经固定、脱水、干燥、喷金等扫描电镜样品制备,观察软骨细胞在多孔钽材料表面及内部生长、增殖以及分泌细胞外基质情况。 1.6 免疫细胞化学染色检测软骨细胞Ⅰ、Ⅱ、Ⅸ和Ⅹ型胶原表达
将24孔板内复合物软骨细胞消化并转至6孔板内盖玻片,待细胞爬片至70%时,按照SABC试剂盒操作行Ⅰ、Ⅱ、Ⅸ、Ⅹ型胶原免疫细胞化学染色。结果判定:各组选取3张细胞爬片,200倍镜下每张细胞爬片选择5个视野,取其均值。阳性细胞采用统计分析软件Image-Pro Puls进行分析,用积分光密度(IOD)值来表示其表达量。 1.7 Real-time PCR检测软骨细胞Ⅱ和Ⅹ型胶原mRNA表达
取24孔板内bFGF-多孔钽-软骨细胞复合物共培养第7天时软骨细胞消化并收集处理,提取总RNA。于NCBI GenBank中找出新西兰兔内参基因GAPDH以及目的基因Ⅱ、Ⅹ型胶原基因序列,并由Invitrogen公司合成。使用SYBR Premix Ex TaqTM试剂盒将制备好的各组软骨细胞cDNA用PCR扩增仪通过相应引物进行扩增。通过2-ΔΔCt方法计算基因相对表达量[9]。具体引物序列见表 1。
| 表 1 PCR引物序列 Tab 1 PCR primers sequences |
采用SPSS 17.0软件进行统计分析,多组间比较采用单因素方差分析,方差齐采用LSD检验进行两两比较,检验水准(α)为0.05。 2 结 果 2.1 兔关节软骨细胞形态
原代分离的软骨细胞形态呈椭圆形,10~12 h后开始贴壁,24 h后呈三角形或长梭形单层生长;72 h软骨细胞开始增殖,当爬满瓶底时变为类圆形,胞质丰满、均匀,核大且圆。 2.2 电镜观察bFGF-多孔钽-软骨细胞复合物
多孔钽材料外观体积为1 cm×1 cm×0.2 cm,扁圆形,深灰色,光亮,充满针尖大的蜂窝状孔隙(图 1A)。扫描电镜观察可见孔隙直径约200~700 μm,凹凸不平的颗粒间呈现互相连通三维空间网络样结构(图 1B)。软骨细胞有长短不一突起贴附多孔钽表面或向孔隙内部生长(图 1C、1D),初期呈现为大小不一的球形,24 h后细胞数量开始增多、变形,胞质延展并相互交联融合在一起,并随时间的延长逐渐覆盖多孔钽大部分区域(图 1E、1F)。
 | 图 1 bFGF-多孔钽-软骨细胞复合物扫描电镜观察 Fig 1 Observation of bFGF-chondrocyte-porous tantalum composites under scanning electron microscopeA: Appearance of porous tantalum; B:Tantalum diameter 200-700 μm; C: The chondrocytes extended pseudopodia,attached to porous tantalum surface,the arrow showed the pseudopodia; D: The chondrocytes grew within scaffold pores,the arrow showed the pseudopodia; E: The chondrocytes connected with each other across the pores,and the arrow showed the chondrocytes connected with each other; F: The chondrocytes covered the scaffold and the pores,and the arrow showed the chondrocytes covered the pores. Original magnification: ×1 000(B),×500 (C,D,E,and F) |
应用MTT法测定5块24孔板内bFGF-多孔钽-软骨细胞复合物中软骨细胞D590值,并绘制细胞生长曲线。结果显示(图 2):软骨细胞接种到多孔钽第1~6 天,各组细胞数量均由缓慢增殖到快速增殖,最终生长趋于平稳。1~6 d各组细胞D590值统计分析得出:各实验组(1 ng/mL bFGF、10 ng/mL bFGF、50 ng/mL bFGF及钽-细胞组)细胞D590值均高于单纯软骨细胞组),差异有统计学意义(P<0.05);同时在1、2、3、4、5、6 d时各组间比较差异也有统计学意义(P<0.05)。
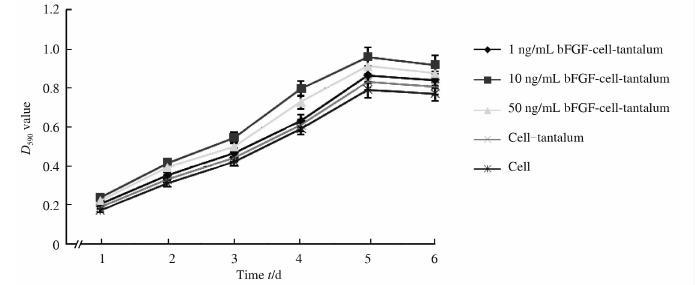 | 图 2 bFGF-多孔钽-软骨细胞复合物软骨细胞增殖生长曲线 Fig 2 Growth curve of chondrocytes on bFGF-chondrocyte-porous tantalum compositesn=3,x±s |
伴随着bFGF浓度的增加,代表软骨细胞表型的Ⅱ型及Ⅸ型胶原的阳性表达呈上升趋势。检测第7天各组不同浓度bFGF对软骨细胞Ⅱ型胶原表达强度的影 响依次为:B组>C组>D组>A组>E组;对Ⅸ型胶原表达强度的影响依次为:B组>C组>A组>D组>E组。以B组 (10 ng/mL bFGF-多孔钽-软骨细胞) 表达强度最为显著(图 3),且各实验组(A、B、C、D)与对照组(E)相比,差异均有统计学意义(P<0.05);各组间两两比较差异均有统计学意义(P<0.05)。 2.4.2 bFGF对多孔钽-软骨细胞去分化状态的影响 结果(图 3)表明:随着bFGF浓度的增加,代表软骨细胞去分化状态的Ⅰ及Ⅹ型胶原的阳性表达量呈下降趋势,第7天各组不同浓度bFGF对软骨细胞Ⅰ型胶原表达强度的强弱依次为:E组>D组>A组>C组>B组;对Ⅹ型胶原表达强度的强弱依次为:E组>D组>C组>A组>B组。各实验组与对照组相比差异均有统计学意义(P<0.05);各组间两两比较差异均有统计学意义(P<0.05)。
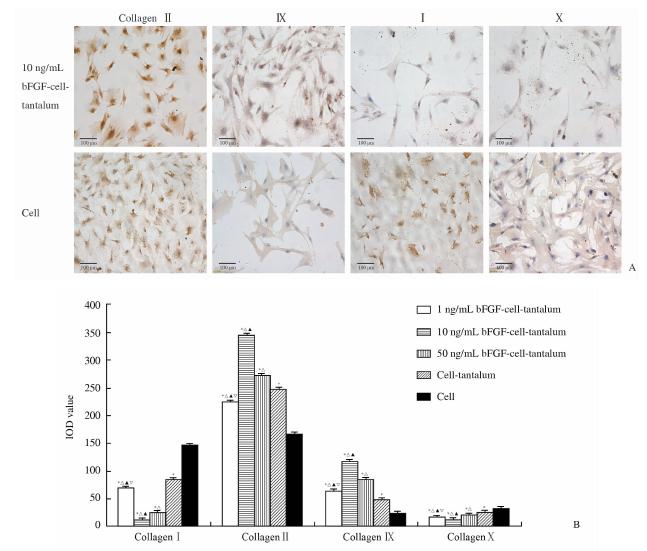 | 图 3 bFGF-多孔钽-软骨细胞复合物软骨细胞Ⅰ、Ⅱ、Ⅸ及Ⅹ型胶原免疫细胞化学染色结果(A)及IOD值(B) Fig 3 Collagen type Ⅰ,Ⅱ,Ⅸ,and Ⅹ immunocytochemical staining (A) and IOD values (B) of chondrocytes on bFGF-chondrocyte-porous tantalum composites*P<0.05 vs cell group;△P<0.05 vs cell-tantalum group;▲P<0.05 vs 50 ng/mL bFGF-cell-tantalum group;P<0.05 vs 10 ng/mL bFGF-cell-tantalum group. n=5,x - ±s |
E组细胞Ⅱ型胶原mRNA相对表达量第3天、第7天均为1.000,A~D组Ⅱ型胶原mRNA表达量明显高于E组(P<0.05),同时各组间比较也存在统计学差异(P<0.05);而Ⅹ型胶原mRNA的相对表达量明显低于E组(P<0.05),各组间两两比较差异也具有统计学意义(P<0.05)。实验组中以 10 ng/mL bFGF(B组)Ⅱ型胶原mRNA表达量最高,Ⅹ型胶原mRNA表达量最低(图 4)。
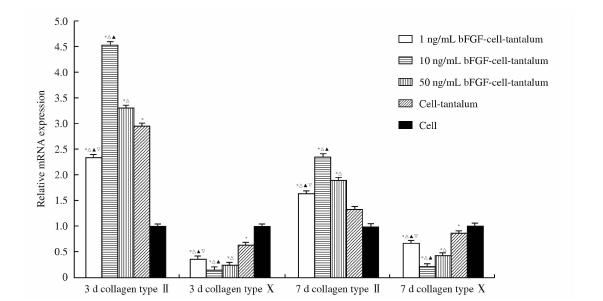 | 图 4 bFGF-多孔钽-软骨细胞复合物软骨细胞Ⅱ型、Ⅹ型胶原mRNA表达量的测定 Fig 4 Expression of collagen type Ⅱ and Ⅹ mRNA in chondrocytes on bFGF-chondrocyte-porous tantalum composites* P<0.05 vs cell group;△ P<0.05 vs cell-tantalum group;▲ P<0.05 vs 50 ng/mL bFGF-cell-tantalum group; P<0.05 vs 10 ng/mL bFGF-cell-tantalum group. n=5,x±s |
3 讨 论
用于软骨损伤缺损修复的支架材料有很多类型,但远期力学性能不容乐观。软骨组织工程支架材料的研发为软骨损伤缺损修复提供了新方法及思路。多孔钽是一种具有高孔隙率、低弹性模量的小梁金属,其外观类似于人类松质骨。以其良好的力学特性、生物相容性和生物学活性在临床上广泛应用于骨科各个领域,如髋、膝关节置换术,骨移植替代物,关节融合等[10, 11]。在前期研究中,已将国产多孔钽-成骨细胞体外构建复合体,为骨缺损修复提供了理论依据[12]。在此基础上,为了探讨软骨缺损修复过程中生长因子的刺激、调控作用,本实验加入3种不同浓度bFGF与多孔钽-软骨细胞共培养形成bFGF-多孔钽-软骨细胞复合物,观察bFGF对软骨细胞在钽支架表面及孔隙内生长及增殖的影响。
扫描电镜观察细胞形态显示,软骨细胞在多孔钽表面及孔隙内部生长良好,细胞体积逐渐变大并伸出突起分泌细胞外基质相互交织成网状结构。MTT细胞增殖检测得出:随着培养时间的延长,bFGF的浓度在1~50 ng/mL范围内对软骨细胞增殖的刺激作用表现出了量效关系。虽然对软骨细胞生长、增殖均有促进作用,但以10 ng/mL bFGF促增殖作用最为明显,当bFGF浓度超过10 ng/mL时,其促增殖效果不再随剂量升高而提高。这说明 10 ng/mL bFGF是促进多孔钽-软骨细胞复合物细胞增殖的最佳浓度。我们认为软骨细胞在上述条件下的增殖效果可能与优良的具有三维空间结构的多孔钽支架共培养,从而使软骨细胞生长在良好的生长环境有关。良好的氧气供给,加上适宜浓度的bFGF生长因子,可能是细胞增殖能力增强的原因。
软骨细胞是一种稳定细胞,通常处在静息状态,分裂及增殖能力较差,即使受到外部环境刺激,增殖也较缓慢[13]。成人关节软骨中主要胶原为Ⅱ、Ⅵ、Ⅸ、Ⅹ及Ⅺ型,其中Ⅱ型胶原占总量的90%~95%,Ⅱ型及Ⅸ型胶原是维持软骨细胞表型的主要标记物。当软骨细胞分化成熟后,细胞增殖能力也开始下降。同时在其生长发育过程中存在着去分化现象,这也增加了修复软骨缺损的不稳定因素[14]。所谓的软骨细胞去分化现象是指软骨细胞在体外多次传代或培养时间较长所造成的表型变化,随之而来的是软骨细胞形态的改变以及分泌功能的下降。而正常的透明软骨细胞具有分泌Ⅱ型胶原及糖胺多糖的功能,细胞形态呈圆形或多角形。当去分化现象发生时,细胞表型改变,表达Ⅱ、Ⅸ型胶原能力下降,而表达具有肥大的软骨细胞及成骨分化的Ⅰ、Ⅹ型胶原,细胞形态也随之变为梭形或纤维状。其结果是软骨细胞与支架材料修复软骨损伤及缺损能力的不足[15]。
bFGF广泛存在于人体组织,主要由巨噬细胞、软骨细胞分泌,能促关节软骨细胞有丝分裂,促进软骨细胞增殖、成熟,使分化中的软骨细胞发生迁移并分泌细胞外基质,对胚胎发育及软骨修复起重要的调节作用[16]。本实验中bFGF-多孔钽-软骨细胞3者共培养时,随着bFGF浓度的增加,代表软骨细胞表型标志物的Ⅱ、Ⅸ型胶原阳性表达增强,以10 ng/mL bFGF 组表达强度最强,而代表软骨细胞去分化状态的标志物Ⅰ、Ⅹ型胶原阳性表达减弱,也以10 ng/mL bFGF 组表达最弱。上述结果表明bFGF促使软骨细胞在多孔钽上生长状态良好,维持了正常的表型结构,并没有明显的去分化现象发生。这也是本实验以bFGF作为刺激因子与软骨细胞-多孔钽共培养的原因。而未加bFGF刺激的单纯软骨细胞组却失去了其正常的表型,发生了去分化现象,Ⅱ、Ⅸ型胶原表达最弱,而Ⅰ、Ⅹ型胶原表达最强。
有研究者将软骨细胞接种于三维环境中,如具有三维结构的支架材料,使其能增加细胞的分泌功能,还可使去分化的软骨细胞再度恢复到具有软骨细胞表型。Passaretti等[17]在二维平面培养皿中单层培养软骨细胞时发现,第1、2代细胞与支架材料共培养时维持了正常的表型结构,当软骨细胞传到第3代时,无论是否有支架材料,其表型结构均不能维持正常。这说明处于二维平面的细胞单层培养会逐渐失去原有表型。Schuurman等[18]在三维结构藻酸盐微球与软骨细胞复合培养时,均存在软骨细胞表型结构。这说明三维状态的藻酸盐微球结构的空间结构可使软骨细胞具有充分的氧气供给。因此,为了维持软骨细胞的正常表型,在体外应模拟体内三维空间结构的支架材料培养[19]。本实验所采用的国产多孔钽材料具有三维立体多孔结构,软骨细胞与其共培养时比平面二维单层细胞培养更具有充足的氧气供应,为细胞提供机械支撑及较好的力学环境。当加入生长因子bFGF后,还可促使软骨细胞 均匀黏附其表面并分泌细胞外基质,减少细胞流失。bFGF、软骨细胞及多孔钽材料3者之间优势互补,最终形成新型三维立体结构,更有利于软骨缺损修复。
本实验还通过实时荧光定量PCR方法从基因水平检测了Ⅱ、Ⅹ型胶原mRNA表达,以验证bFGF能维持软骨细胞表型,抑制去分化。结果显示:培养3、7 d时加bFGF刺激的3组中仍然以10 ng/mL bFGF组Ⅱ型胶原mRNA表达量最高,Ⅹ型胶原表达量最低;而未加bFGF的钽-软骨细胞组及单纯软骨细胞组Ⅱ型胶原mRNA表达量均低于加bFGF刺激组,而Ⅹ型胶原表达量均高于加bFGF刺激组。更进一步证明了bFGF可使软骨细胞在与多孔钽共培养时维持表型,抑制去分化,从而保持了成软骨的能力[20, 21]。bFGF维持软骨细胞表型及抑制去分化的最佳浓度,我们认为可能与软骨细胞膜上的bFGF受体密度有关,10 ng/mL bFGF可最大限度地与细胞膜bFGF受体结合,当bFGF浓度高于10 ng/mL时,则出现了软骨细胞去分化现象,使软骨细胞成熟化及肥大化进程加快。上述实验进一步证实了bFGF与软骨细胞及多孔钽共培养形成复合的支架材料可对软骨缺损的修复起到了一定的促进作用。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Kitamura N, Yasuda K, Ogawa M, Arakaki K, Kai S, Onodera S, et al.Induction of spontaneous hyaline cartilage regeneration using a double-network gel: efficacy of a novel therapeutic strategy for an articular cartilage defect[J].Am J Sports Med,2011,39:1160-1169. |
| [2] | Zhao C,Tan A,Pastorin G,Ho H K.Nanomaterial scaffolds for stem cell proliferation and differentiation in tissue engineering[J].Biotechnol Adv,2013,31:654-668. |
| [3] | Mrosek E H, Schagemann J C, Chung H W, Fitzsimmons J S, Yaszemski M J, Mardones R M, et al. Porous tantalum and poly-epsilon-caprolactone biocomposites for osteochondral defect repair: preliminary studies in rabbits[J].J Orthop Res,2010,28:141-148. |
| [4] | Fernandez-Fairen M, Querales V, Jakowlew A, Murcia A, Ballester J.Tantalum is a good bone graft substitute in tibial tubercle advancement[J].Clin Orthop Relat Res,2010,468:1284-1295. |
| [5] | 吴凤麟,宇 丽,汪卓赟.碱性成纤维细胞生长因子对生长板软骨细胞增殖与分化的影响[J]. 中国组织工程研究与临床康复, 2008, 12:9973-9976. |
| [6] | 李思佳,许艳华. 碱性成纤维生长因子(bFGF)对软骨生物学的影响[J]. 现代生物医学进展,2014,14:380-382. |
| [7] | Varkey M, Kucharski C, Doschak M R, Winn S R, Brochmann E J, Murray S, et al.Osteogenic response of bone marrow stromal cells from normal and ovariectomized rats treated with a low dose of basic fibroblast growth factor[J].Tissue Eng,2007,13:809-817. |
| [8] | 张 岭,李琪佳,甘洪全,刘英杰,王志强.医用多孔钽材料对大鼠软骨细胞增殖细胞周期及凋亡的影响[J].中国矫形外科杂志,2014,22:346-351. |
| [9] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25:402-408. |
| [10] | Levine B, Sporer S, Della Valle C J, Jacobs J J, Paprosky W. Porous tantalum in reconstructive surgery of the knee: a review[J]. J Knee Surg, 2007, 20:185-194. |
| [11] | Balla V K, Bodhak S, Bose S, Bandyopadhyay A. Porous tamalum structures for bone implants: fabrication. mechanical and in vitro biological properties[J]. Acta Biomater, 2010, 6: 3349-3359. |
| [12] | 耿丽鑫,甘洪全,王 茜,张 辉,刘英杰,王志强,等.国产多孔钽对成骨细胞生物相容性及其相关成骨基因表达的影响[J].第三军医大学学报,2014,36:1163-1167. |
| [13] | Rahman M S, Tsuchiya T. Enhancement of chondrogenic differentiation of human articular chondrocytes by biodegradable polymers[J]. Tissue Eng, 2001,7:781-790. |
| [14] | Kang S W, Yoo S P, Kim B S. Effect of chondrocyte passage number on histological aspects of tissue-engineered cartilage[J].Biomed Mater Eng, 2007, 17:269-276. |
| [15] | Panseri S, Russo A, Cunha C, Bondi A, Di Martino A, Patella S, et al. Osteochondral tissue engineering approaches for articular cartilage and subchondral bone regeneration[J]. Knee Surg Sports Traumatol Arthrosc, 2012,20:1182-1191. |
| [16] | Shida J I, Jingushi S, Izumi T, Ikenoue T, Iwamoto Y. Basic fibroblast growth factor regulates expression of growth factors in rat epiphyseal chondrocytes[J]. J Orthop Res, 2001, 19: 259-264. |
| [17] | Passaretti D, Silverman R P, Huang W, Kirchhoff C H, Ashiku S, Randolph M A,et al. Cultured chondrocytes produce injectable tissue-engineered cartilage in hydrogel polymer[J].Tissue Eng, 2001, 7: 805-815. |
| [18] | Schuurman W, Gawlitta D, Klein T J, ten Hoope W, van Rijen M H, Dhert W J,et al. Zonal chondrocyte subpopu-lations reacquire zone-specific charact-eristics during in vitro redifferentiation[J]. Am J Sports Med, 2009, 37: 97-104. |
| [19] | Kim J H, Lee M C, Seong S C, Park K H, Lee S. Enhanced proliferation and chondrogenic differentiation of human synovium-derived stem cells expanded with basic fibroblast growth factor[J]. Tissue Eng Part A, 2011, 17: 991-1002. |
| [20] | Sive J I, Baird P, Jeziorsk M, Watkins A, Hoyland J A, Freemont A J. Expression of chondrocyte markers by cells of normal and degenerate intervertebral discs[J]. Mol Pathol, 2002, 55: 91-97. |
| [21] | Xu C, Rosler E, Jiang J, Lebkowski J S, Gold J D, O'Sullivan C, et al. Basic fibroblast growth factor supports undifferentiated human embryonic stem cell growth without conditioned medium[J]. Stem Cells, 2005, 23: 315-323. |
 2015, Vol. 36
2015, Vol. 36


