2. 第二军医大学长海医院影像医学科, 上海 200433
△共同第一作者
2. Department of Radiology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
△Co-first authors.
脊髓型颈椎病 (cervical spondylotic myelopathy,CSM) 是一种颈椎退变性疾病,由颈椎及相邻软组织退变导致颈髓慢性受压所引起[1, 2]。MRI检查是诊断CSM的常规手段,可显示椎管是否狭窄、脊髓受压的程度和信号的改变。 脊髓T1加权像低信号预示着损伤严重、临床预后较差,但是这种情况出现较少且缺乏敏感性[1];脊髓T2加权像上高信号改变较常出现,反映了脊髓非特异性水肿、炎症反应、缺血等急性改变和脊髓长期受压出现的软化、坏死及胶质增生等多种病理状态[2],但T2高信号与临床表现及手术预后的相关性目前仍存在较大争议[3]。
弥散张量成像 (diffusion tensor imaging,DTI)是在弥散加权成像 (diffusion weighted imaging,DWI)的基础上发展而来的一种新技术,主要用于反映活体组织细微结构和功能的改变,评价参数包括表观弥散系数(apparent diffusion coefficient,ADC)和各向异性分数(fractional anisotropy,FA),并且可利用纤维束示踪成像(diffusion tensor tractography,DTT)技术显示白质纤维束的三维形态改变,是目前唯一可无创显示活体神经纤维束的方法。研究发现,DTI较常规MRI对CSM的诊断和预后预测价值更高[4, 5],但尚无公认的测量方法,目前的研究均选择脊髓横截面的全部或大部分作为感兴趣区域(region of interest,ROI)进行参数测量,得到的参数值是白质和灰质的混合值。研究[5]显示,脊髓中白质纤维束各向异性较高,而灰质各向异性较低,并有研究[6]发现DTI参数和年龄间呈明显相关性,且不同颈脊髓平面的参数之间也存在一定差异。因此直接将CSM不同年龄、不同节段之间的DTI参数进行对比分析显然并不合适。
本研究采用病变节段的DTI参数与自身C1/2平面DTI参数的比值进行对比分析,以期能消除年龄和病变节段不同所造成的偏倚,为临床应用研究提供帮助。 1 资料和方法 1.1 一般资料
纳入2012年3月至2013年3月我科收治的脊髓型颈椎病患者62例,排除有颈腰椎外伤、神经系统疾病及手术史的患者,入院后术前接受MRI检查和DTI检查。招募40例健康志愿者作为正常对照组,排除有颈腰椎外伤、脊柱手术或其他神经系统病史者,接受常规MRI和DTI检查,常规MRI如显示脊髓有受压则予以排除。患者及志愿者在行MRI检查前均签署知情同意书。本研究通过第二军医大学长海医院医学伦理委员会审查并批准。
所有患者均由同一高年资主任医师进行手术,神经功能评估采取JOA评分,术后随访并计算改善率:(术后JOA—术前JOA)/(17—术前JOA)×100%。术前JOA评分按≤8分为重度损伤,9~12分为中度损伤,13~16分为轻度损伤分成3组,术后改善率按0~34%、35%~67%、68%~100%分成差、中、优3组。 1.2 MRI、DTI成像与分析 1.2.1 扫描过程
GE HDxt Twinspeed 3.0 T双梯度超导MR仪,梯度场强为40 mT/m,切换率为150 mT·m-1·ms-1,采用NV-full 8通道线圈。常规行矢状位及横轴位T1WI和T2WI扫描。 矢状位flair-T1WI序列,重复时间(repetition time,TR)/回波时间(echo time,TE) 3 200 ms /116.8 ms,层厚3.0 mm,层间距1.0 mm,视野(field of view,FOV) 24 mm×24 mm,矩阵320×224,NEX 2。矢状位FRFSE-T2WI序列,TR/TE 2 698 ms/ 25.8 ms,层厚3.0 mm,层间距1.0 mm,FOV 240 mm×240 mm,矩阵320×224,NEX 2。横轴位FRFSE-T2WI序列,TR/TE 3 200 ms/121 ms,层厚 4.0 mm,层间距0.5 mm,带宽41.7 kHz,FOV 180 mm×180 mm,矩阵288×224,NEX 4。DTI检查与常规横轴位扫描定位相同,采用单次激发自旋回波平面回波成像(echo planner imaging,EPI)序列,扩散加权系数b值为1 000 s/mm2,扩散敏感梯度方向取15,重复次数为2,TR/TE 8 000 ms/87.6 ms,层厚4.0 mm,层间距0 mm,带宽250 kHz,FOV 240 mm×240 mm,矩阵130×128,NEX 2。DTI扫描时间共5 min。 1.2.2 图像处理及ROI选择
采用GE Functool 9.4软件对DTI数据进行后处理,用Correct程序对原始数据进行校正,以减少图像变形伪影。由2名影像科医师对DTI图像进行参数测量,对照组测量C1/2、C3/4、C4/5、C5/6、C6/7共5个平面(图 1A),CSM组测量C1/2和受压程度最重的平面(图 1B),在b0图像上手工选择ROI测量ADC和FA值。白质的前索、侧索和后索以及中央灰质左右各划取1个ROI测量相应的ADC和FA值,每个层面的左右两个对称ROI取平均值[7]。选择白质纤维ROI时尽量靠近脊髓内侧以避免周围脑脊液的影响。
 | 图 1 颈椎MRI T2加权矢状位图像 Fig 1 Sagittal MRI T2WI of cervical vertebraA: In control group,ADC,FA ratios of the WM (VF,LF,and DF) to central GM were measured and calculated at the C3/4,C4/5,C5/6,and C6/7 levels compared with C1/2 level,respectively; B: In CSM group,ADC,FA ratios of the WM (VF,LF,and DF) to central GM were measured and calculated at the most compressed levels (C5/6) and the corresponding C1/2 levels. WM: White matter,GM: Gray matter,VF: Ventral funiculus,LF: Lateral funicali,DF: Dorsal funiculus |
两名影像科医师在每个部位各测量2次取平均值,得到的2个值再次取平均值作为最终参数值进行统计分析,ADC值偏差超过10-3 mm2/s、 FA值偏差超过0.5,则由两名医师共同测量确定最后参数值。正常对照组计算C3/4、C4/5、C5/6、C6/7平面脊髓白质(white matter,WM)的前索(ventral funiculus,VF)、侧索(lateral funiculi,LF)、后索(dorsal funiculus,DF)及中央灰质(gray matter,GM)的ADC和FA值分别与自身C1/2平面相应位置参数值的比值;CSM组计算脊髓受压最大平面与C1/2平面白质VF、LF、DF及GM的ADC比值、FA比值(图 2)。
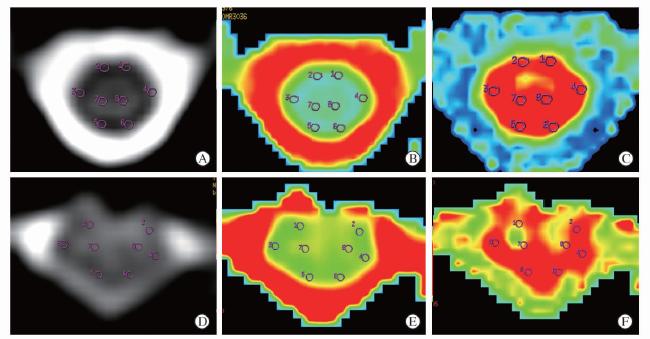 | 图 2 CSM患者颈髓横截面ROI选择及数据分析 Fig 2 Measurement of the ROI selection of patient with CSMA,B,and C were b0,ADC and FA figures at the C1/2 level of the patient shown in Fig 1B; D,E,and F were b0,ADC and FA figures at the C5/6 level of the patient shown in Fig 1B. Two ROIs were selected symmetrically in the WM (VF,LF,and DF) and central GM for ADC and FA measurements,and then the means of the two ROIs were used for further analysis. 1-8: No. of different ROIs. WM: White matter,GM: Gray matter |
采用SPSS 18.0统计软件,正常对照组采用单因素方差分析比较不同平面、不同年龄分组间ADC比值、FA比值的差异;正常对照组脊髓白质前索、侧索、后索和中央灰质4个部位所有测量平面的ADC、FA比值作为整体,采用单因素方差分析比较不同部位间有无差异。线性相关分析比较CSM患者脊髓白质前索、侧索、后索和中央灰质4个部位DTI参数和DTI参数比值分别与JOA评分、JOA改善率之间的相关性。JOA分组、JOA改善率分组和正常对照组间白质轴索、中央灰质的ADC比值、FA比值采用单因素方差分析,并采用Student-Newman-Keuls (SNK)进行两两之间的组间比较。检验水准(α)为0.05。 2 结 果 2.1 患者基本人口学资料及分组
排除颈腰椎外伤或手术史患者6例,排除神经系统疾病史患者6例,CSM组最后共纳入50例,男25例、女25例,年龄42~69岁,平均年龄(57.2±3.2)岁。发病时间 最短为3个月,最长为25个月,平均(9.7±1.4)个月。JOA分组轻度组14例(男5/女9)、中度组23例(男14/女9)、重度组13例(男6/女7)。所有患者术后随访时间均在1年以上,JOA改善率优18 例(男9/女9)、中23例(男11/女12)、差9例(男5/ 女4)。排除MRI提示脊髓压迫者4例,正常对照组共纳入36例患者,男22例、女14例,年龄20~77岁,平均(51.3±2.7)岁。 2.2 正常对照人群不同节段、年龄间DTI参数比值的比较 2.2.1 年龄与DTI参数比值
正常对照人群不同年龄组间前索、侧索、后索和中央灰质4个部位的ADC、FA比值间差异无统计学意义(表 1)。
| 表 1 正常对照人群不同年龄间ADC比值、FA比值的比较 Tab 1 Comparison of ADC ratio and FA ratio among different age groups in the control group |
C3/4、C4/5、C5/6、C6/7各个平面间脊髓白质前索、侧索、后索的ADC、FA比值差异均有统计学意义(表 2)。
| 表 2 正常对照人群不同节段间ADC比值、FA比值的比较 Tab 2 Comparison of ADC ratio and FA ratio among different levels in the control group |
线性相关分析结果(表 3)显示:脊髓前索、侧索、后索和中央灰质的ADC比值、FA比值与JOA评分、JOA改善率相关性优于ADC值、FA值(P<0.05或P<0.01),且FA比值的相关性优于ADC比值。
| 表 3 CSM患者DTI参数/参数比值与JOA评分及JOA改善率的相关系数对比 Tab 3 Correlation coefficients between ADC,FA and ADC,FA ratios,and JOA scores and JOA recovery rates |
结果(表 4)表明:与正常对照人群相比,轻度损伤组患者白质前索ADC比值升高,白质前索、中央灰质FA比值降低(P<0.05); 与正常对照人群及轻度损伤组相比,中度损伤组白质前索、侧索和中央灰质ADC比值升高,FA比值降低(P<0.05);与其余3组相比,重度损伤组白质各轴索(前索、侧索、后索)和中央灰质的ADC比值均升高、FA比值均降低,差异有统计学意义(P<0.05)。
| 表 4 不同临床症状患者DTI参数比值的对比 Tab 4 Comparison of ADC ratio and FA ratio in the clinical symptom subgroups and control group |
2.4.2 不同临床预后与DTI参数比值
结果(表 5)表明:改善率优、中、差3组CSM患者白质前索、侧索、后索及中央灰质ADC比值与对照组相应部位间的ADC比值差异均有统计学意义(P<0.05);改善率为中组脊髓4个部位的ADC比值与优组比较差异无统计意义,而差组4个部位的ADC比值与轻组、中组比较差异均有统计学意义(P<0.05)。改善率优组CSM患者仅白质前索和中央灰质FA比值与正常对照相比差异有统计学意义(P<0.05),改善率中组患者白质前索、侧索和中央灰质的FA比值与正常对照组比较差异有统计学意义(P<0.05),改善率差组白质各轴索和中央灰质的FA比值与其余3组差异均有统计学意义(P<0.05)。
| 表 5 不同临床预后CSM患者DTI参数比值的比较 Tab 5 Comparison of ADC ratio and FA ratio of the prognosis subgroups and control group |
3 讨 论
2003年,Demir等[8]首次提出DTI对CSM的诊断比常规MRI更敏感,DTI成像较MRI能更早发现脊髓微观病理改变,但限于当时的成像技术,并未能提出相应的DTI量化参数标准。近年来,随着磁共振硬件的更新和DTI成像参数的完善,DTI在CSM中的研究取得了较大进展,主要集中在两方面:(1)通过DTI参数进行量化评估,(2)通过DTT重建脊髓纤维束进行病情评估和预后预测。
CSM患者DTI量化评估的相关研究[4, 9, 10, 11, 12]表明:DTI参数与CSM临床症状和预后均相关,DTI可在CSM早期、常规MR无异常信号之前对脊髓病变进行量化评估,敏感性和特异性较高。但对于DTI参数测量目前尚无统一标准,目前的研究均选择脊髓横截面的全部或大部分作为ROI进行参数测量,得到的参数是白质和灰质的混合值。随着DTI图像质量的改善,目前的DTI成像可以清晰分辨出灰质和白质的解剖形态。不断有研究[5, 6]发现正常人颈脊髓白质与灰质ADC、FA值存在差异,并且DTI参数在不同脊髓平面、不同年龄间也有差异。因此,患者年龄和病变节段不同等因素均会对分析结果产生影响,严重制约了该项技术的推广应用。
本研究采用CSM受压平面与自身C1/2平面的DTI参数比值进行对比分析,以消除年龄、病变节段所造成的偏倚。本研究正常对照组选择了不同年龄段健康志愿者,以分析不同年龄间ADC、FA比值的差异。CSM最常发生于活动度较大的颈椎中下段(C4-7),而活动度相对较小的上段颈椎(C1-3)极少发生病变[4]。因此,本研究选择对志愿者C3/4、C4/5、C5/6、C6/7等4个平面DTI参数比值进行分析。研究结果发现:正常对照组不同年龄分组间前索、侧索、后索和中央灰质4个部位的ADC比值、FA比值间差异无统计学意义。正常对照人群不同节段(C3/4、C4/5、C5/6、C6/7)间脊髓白质前索、侧索、后索ADC比值、FA比值间差异均有统计学意义(P<0.05)。进一步的线性分析结果显示:脊髓前索、侧索、后索和中央灰质ADC比值、FA比值与JOA评分相关性优于ADC值、FA值本身;脊髓4个部位ADC比值、FA比值与JOA改善率相关性也优于ADC值、FA值本身。结果提示,DTI参数比值能够部分消除年龄及病变节段所造成的测量偏倚,诊断价值优于DTI参数本身。
JOA评分不同分组间DTI参数比值分析结果显示:轻度损伤组仅白质前索的ADC比值与正常对照组差异有统计学意义,白质前索、中央灰质FA比值与正常对照组差异有统计学意义(P<0.05)。我们推测,在压迫较轻或病程较短时压迫仅来自脊髓前方,表现为ADC比值增高和FA比值降低,与之前报道[9, 10, 11, 12]相符。中度损伤组白质前索、侧索和中央灰质ADC比值和FA比值与正常对照组、轻度损伤组相比差异有统计学意义(P<0.05)。重度损伤组白质各轴索和中央灰质ADC比值、FA比值与其余3组比较差异均有统计学意义(P<0.05)。既往文献[13, 14]报道,在脊髓重度受压时,即使致压物是来自前方,由于后方黄韧带的肥厚和颈椎活动时剪切力的作用,也可造成白质后索的损伤。1953年 Taylor[15]首先报道了脊髓前方髓核、骨赘和后方黄韧带从前、后方同时压迫脊髓的现象,并称之为“钳夹效应”。关于“钳夹型”脊髓型颈椎病后方致压物的产生,目前的观点认为其主要来源于静态压迫和动态压迫的共同作用。静态压迫一般认为是继发于椎间盘退变,椎间隙狭窄后所致黄韧带松弛皱褶,甚至增生肥厚;另外,随着年龄的增长,黄韧带本身的退变也可以导致其出现原发性增生肥厚。动态压迫主要来源于节段不稳,相互运动,造成脊髓卡压[16]。
DTI参数对CSM手术预后的预测价值也有文献[10, 11]报道。Jones等[10]对DTI与神经功能及预后间关系的研究发现,FA值与神经功能状态明显相关,在FA、T2WI高信号、椎管狭窄三者中,FA值对预测患者神经功能改善情况的精确性最高,而ADC与神经功能及预后无明显相关性。Kerkovsk等[11]认为,与脊髓T2WI高信号和脊髓横断面积减少相比,FA、ADC值对CSM手术预后的敏感性和特异性更高。本研究结果显示JOA改善率优、中、差3组的白质前索、侧索、后索、中央灰质的ADC比值与正常对照组相比差异有统计学意义,组间比较差异也有统计学意义。有观点[15, 16]认为当后索受损时,脊髓损伤已经非常严重,手术耐受性差,预后不佳。本研究结果也发现,JOA严重组和JOA改善率最差的组中,后索ADC、FA比值与正常对照组相比差异有统计学意义(P<0.05),ADC比值增大,而FA比值降低。因此,当后索ADC和FA比值出现异常时,可作为患者病情较重、预后较差的有效预测指标。
本研究不足主要有以下几方面:(1)脊髓本身体积小,图像分辨率较低,测量面积小,容易出现误差。因此,如何进一步改善图像质量,是临床医师和放射专家共同面临的难题,这也是DTI技术能否用于临床的关键。(2)正常对照组样本较小,每个年龄组中仅数例样本,对于颈髓整体的DTI参数比值分布特征有待进一步大样本分析。(3) C3/4、C4/5、C5/6、C6/7 4个平面间DTI比值有差异,所以我们将4个平面的DTI参数比值作为整体进行对照,研究结果会产生或多或少的偏倚。另外,导致DTI参数值改变的病理因素众多,ADC比值和FA比值能否精确反映脊髓损伤的真实情况有待进一步研究。(4)影响CSM预后的因素众多,年龄、发病时间、术前神经功能、病变节段、手术方式等均可能影响疾病预后,本研究仅分析了DTI参数、DTI比值与预后的相关性,仍有待进一步深入研究。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Chen C J, Lyu R K, Lee S T, Wong Y C, Wang L J. Intramedullary high signal intensity on T2-weighted MR images in cervical spondylotic myelopathy: prediction of prognosis with type of intensity[J]. Radiology, 2001, 221:789-794. |
| [2] | Takahashi M, Yamashita Y, Sakamoto Y, Kojima R. Chronic cervical cord compression: clinical significance of increased signal intensity on MR images[J]. Radiology, 1989, 173:219-224. |
| [3] | Yukawa Y, Kato F, Yoshihara H, Yanase M, Ito K. MR T2 image classification in cervical compression myelopathy: predictor of surgical outcomes[J]. Spine (Phila Pa 1976), 2007, 32: 1675-1678. |
| [4] | Kara B, Celik A, Karadereler S, Ulusoy L, Ganiyusufoglu K, Onat L,et al. The role of DTI in early detection of cervical spondylotic myelopathy: a preliminary study with 3-T MRI[J]. Neuroradiology, 2011, 53:609-616. |
| [5] | Rossi C, Boss A, Steidle G, Martirosian P, Klose U, Capuani S,et al. Water diffusion anisotropy in white and gray matter of the human spinal cord[J]. Magn Reson Imaging, 2008, 27:476-482. |
| [6] | Vedantam A, Jirjis M B, Schmit B D, Wang M C, Ulmer J L, Kurpad S N. Characterization and limitations of diffusion tensor imaging metrics in the cervical spinal cord in neurologically intact subjects[J]. J Magn Reson Imaging, 2013,38:861-867. |
| [7] | Yoo W K, Kim T H, Hai D M, Sundaram S, Yang Y M, Park M S, et al. Correlation of magnetic resonance diffusion tensor imaging and clinical findings of cervical myelopathy[J]. Spine J, 2013, 13: 867-876. |
| [8] | Demir A, Ries M, Moonen C T, Vital J M, Dehais J, Arne P, et al. Diffusion-weighted MR imaging with apparent diffusion coefficient and apparent diffusion tensor maps in cervical spondylotic myelopathy[J]. Radiology, 2003, 229: 37-43. |
| [9] | Xiangshui M, Xiangjun C, Xiaoming Z, Qingshi Z, Yi C, Chuanqiang Q, et al. 3 T magnetic resonance diffusion tensor imaging and fibre tracking in cervical myelopathy[J]. Clin Radiol, 2010, 65: 465-473. |
| [10] | Jones J G, Cen S Y, Lebel R M, Hsieh P C, Law M. Diffusion tensor imaging correlates with the clinical assessment of disease severity in cervical spondylotic myelopathy and predicts outcome following surgery[J]. AJNR Am J Neuroradiol, 2013, 34:471-478. |
| [11] | Kerkovský M, Bednarík J, Dušek L, Sprláková-Puková A, Urbánek I, Mechl M, et al. Magnetic resonance diffusion tensor imaging in patients with cervical spondylotic spinal cord compression: correlations between clinical and electrophysiological findings[J]. Spine, 2012, 37:48-56. |
| [12] | Song T, Chen W J, Yang B, Zhao H P, Huang J W, Cai M J, et al. Diffusion tensor imaging in the cervical spinal cord[J]. Eur Spine J, 2011, 20:422-428. |
| [13] | Shimomur T, Sumi M, Nishida K, Maeno K, Tadokoro K, Miyamoto H, et al. Prognostic factors for deterioration of patients with cervical spondylotic myelopathy after nonsurgical treatment[J]. Spine (Phila Pa 1976), 2007, 32:2474-2479. |
| [14] | Guo J J, Luk K D, Karppinen J, Yang H, Cheung K M. Prevalence,distribution,and morphology of ossification of the ligamentum flavum:a population study of one tousand seven hundred thiry-six magnetic resonance imaging scans[J]. Spine (Phila Pa 1976), 2010, 35:51-56. |
| [15] | Taylor A R. Mechanism and treatment of spinal-cord disorders associated with cervical spondylosis[J]. Lancet, 1953, 1:717-720. |
| [16] | Baptiste D C, Fehlings M G. Pathophysiology of cervical myelopathy[J]. Spine J,2006,6(6 Suppl): 190S-197S. |
 2015, Vol. 36
2015, Vol. 36


