2. 重庆医科大学临床检验诊断学教育部重点实验室, 重庆 400016
2. Key Laboratory of Clinical Diagnostics of Ministry of Education, Chongqing Medical University, Chongqing 400016, China
急性早幼粒细胞白血病(acute promyeolic leukemia,APL)是一类造血干细胞的恶性克隆性疾病,在FAB分型中被定义为急性髓细胞白血病M3型[1],其特征是发生t(15;17)(15q22;17q21)染色体易位,形成早幼粒细胞白血病-维甲酸受体α融合基因(PML-RARα)[2],约90%的APL患者表现为出血并发症[3],发病迅速,致死率高。现在临床上把具有融合基因PML-RARα作为APL的主要诊断依据。根据PML基因断裂点不同,PML-RARα融合基因可分为L型、V型、S型3种,所占比例分别为50%、5%、45%[4]。本文研究的是长型(L型)。该融合基因表达的PML-RARα融合蛋白干扰了野生型RARα的信号传递和PML及其核体(NBs)的正常结构与功能[5],在APL的发生、发展中起了关键作用。但PML-RARα融合蛋白并非始终以整体的形式发挥作用。Lane等[6]发现,中性粒细胞弹性蛋白酶(neutrophil elastase,NE)可将PML-RARα融合蛋白切割成相对分子质量为52 000的缺失核定位信号的早幼粒白血病蛋白[PML(NLS-)]和相对分子质量为61 000的带核定位信号的维甲酸受体α(NLS-RARα)两种变异蛋白。且文献[7]报道,PML-RARα转染入早期髓细胞中,很容易发展成为APL白血病细胞;但将其转染入晚期髓细胞,却不能发展为APL细胞。Lane等[8]的后续研究也表明,在不含NE的早期髓细胞中,单纯导入的PML-RARα未被裂解,其发生APL的概率仅为2%~3%,远低于富含NE的早期髓细胞。
本课题前期研究中,我们选择NB4作为APL代表细胞株。由于NB4中不含有NE[6],我们构建了重组腺病毒Ad-NE,将NE转入NB4细胞来模拟这种切割作用变化,并证实了这种切割会造成相应蛋白分布位置的变化[6, 7, 8, 9]。在APL患者的疾病发展早期有NE的作用,因此在本实验中我们希望通过收集初诊APL患者的血液并分离得到肿瘤细胞,用感染成功的NB4细胞做阳性对照,来验证是否在患者的疾病发展中也存在这种切割作用,并对切割产物NLS-RARα蛋白进行验证和定位,为以后运用于临床奠定基础。 1 材料和方法 1.1 标本来源
急性早幼粒细胞白血病患者血样(经确诊为M3-L型)及正常人血样皆由重庆医科大学附属第一医院提供,10例患者为20~35岁女性,均为初诊,未经治疗,白血病细胞含量均大于70%。正常人血来源于25~35岁健康体检女性。重组腺病毒Ad-NE和Ad-KZ(空载)由本课题组前期构建保存,NB4细胞株由重庆医科大学临床检验诊断学实验室保存。 1.2 主要试剂
培养NB4细胞的RPMI 1640培养基、胎牛血清(FBS)购自美国Gibco公司;高保真Taq DNA多聚酶、 PCR mixture、总RNA提取试剂盒、反转录试剂盒购自日本TaKaRa公司;琼脂糖购自美国Invitrogen公司;红细胞裂解液、人外周血中性粒细胞分离液购自天津灏洋生物公司;细胞质核蛋白提取试剂盒、RIPA细胞裂解液、核染料PI和DAPI均购自碧云天生物技术研究所;兔抗人NE多抗、兔抗人Histone H3多抗购自Bioworld公司;兔抗人RARα多抗购自美国Santa Cruz公司;鼠抗人β-actin单抗、HRP标记的羊抗兔和羊抗鼠的IgG、异硫氰酸荧光素 (FITC)标记的羊抗兔IgG均购自北京中杉金桥生物技术有限公司,引物合成由生工生物工程(上海)股份有限公司完成。 1.3 阳性对照组细胞的制备 1.3.1 细胞培养
NB4细胞用含20%优质胎牛血清的RPMI 1640培养基,于37℃、5%CO2的饱和湿度孵箱内常规培养,每1~2 d换液传代,选择对数生长期的细胞用于后续实验。 1.3.2 重组腺病毒感染NB4细胞感染效率检测
用 重组腺病毒pAdEasy-NE和阴性对照腺病毒Ad-KZ感染NB4细胞,48 h后收集细胞,流式细胞仪检测感染效率。效率合格后,收集细胞用于后续实验。 1.3.3 RT-PCR检测感染细胞中NE mRNA的表达
取对数生长期的NB4细胞分别感染重组腺病毒pAdEasy-NE及阴性对照腺病毒Ad-KZ,48 h后提取细胞总RNA,取2 μL测浓度。分别取RNA各500 ng反转录成cDNA。分别取1.5 μL cDNA产物进行PCR。通过查询NCBI,找到NE基因的CDS序列,设计引物,上游引物序列:5′-TACAAGCTTATGACCCTCGGCCGCCGA-3′,下游引物序列:5′-ATCGATATCTCAGTGGGTCCTGCTGGC-3′,扩增片段长度为803 bp。PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸50 s,共34个循环;72℃再延伸5 min。取PCR产物各10 μL进行1.0%琼脂糖凝胶电泳检测。以未感染病毒的细胞为对照。 1.4 人外周血肿瘤细胞和中性粒细胞的提取
取2 mL新鲜抗凝血,与PBS稀释液1∶1混匀后小心加于4 mL人血中性粒细胞分离液液面上,500×g离心25 min。此时离心管中由上至下细胞分4层,弃去第1层和第2层,收集第3层和第4层,放入含10 mLPBS的试管中,充分混匀后,以500×g离心30 min洗涤,去上清后加入3~5倍体积的红细胞裂解液,吹打混匀,反应2 min后500×g离心3 min,然后再用PBS反复洗涤3次,离心后即为所需的肿瘤细胞(对照组为中性粒细胞),可用于后续实验。 1.5 血肿瘤细胞NE的检测
采用蛋白质印迹法。分别收集患者血肿瘤细胞、正常人血中性粒细胞以及重组腺病毒pAdEasy-NE感染48 h后的NB4细胞,RIPA裂解后提取细胞总蛋白,用BCA法定量,分别取100 μg蛋白进行SDS-PAGE电泳,以半干转膜法转至PVDF膜上,用含5%脱脂奶粉的TBST封闭4 h后,加入兔抗人NE多抗(5%脱脂奶粉1∶500稀释),4℃ 8 h。洗膜:用TBST洗2次,每次10 min,再用TBS洗10 min,加入羊抗兔IgG (5%脱脂奶粉1∶1 000稀释),37℃孵育1 h,然后洗膜(步骤同上)。于暗室化学发光显影成像。以β-actin 作为内参。 1.6 血肿瘤细胞NLS-RARα蛋白表达的检测
采用蛋白质印迹法。分别收集患者血肿瘤细胞、正常 人血中性粒细胞、重组腺病毒pAdEasy-NE感染48 h 后的NB4细胞,按说明书分别提取胞核蛋白,用BCA法定量,分别取100 μg蛋白,进行SDS-PAGE电泳,以半干转膜法转至PVDF膜上,用含5%脱脂奶粉的TBST封闭4 h后,加入兔抗人RARα多抗(5%脱脂奶粉1∶500稀释),4℃ 8 h。洗膜:用TBST洗2次,每次10 min,再用TBS洗10 min,加入羊抗兔IgG(5%脱脂奶粉1∶500稀释),37℃孵育1 h,然后洗膜(步骤同上),最后进行化学发光显色和成像分析。以Histone H3作为核内参。 1.7 血肿瘤细胞NLS-RARα蛋白的表达及定位 1.7.1 免疫荧光法
分别收集患者血肿瘤细胞、正常人血中性粒细胞、重组腺病毒pAdEasy-NE感染48 h后的NB4细胞,用PBS洗3次,各取10 μL涂片;用4%多聚甲醛固定20 min后,PBS漂洗3次;再用0.1% Triton X-100 透膜处理15 min。10%山羊血清室温封闭30 min,加上兔抗人RARα抗体(封闭血清1∶200),4℃过夜。PBS洗3次,加上FITC标记的荧光二抗(封闭血清1∶200),37℃孵育1 h。PBS洗3次,加入核染色液DAPI 5 min,PBS漂洗3次,用70%甘油封固,荧光显微镜下观察拍照。 1.7.2 激光共聚焦显微镜法
除核染液换成PI外,制作片子方法与1.7.1项下免疫荧光相同。以红绿双色荧光通道扫描观察。绿光的激发波长为488 nm,在600 nm 波长以上观察。红光的激发波长为 540 nm,在 600 nm波长以上观察。每张切片选取荧光表达最强的10个视野观察并由计算机扫描软件LAS AF lite 进行扫描分析。 1.8 统计学处理
采用SPSS 17.0统计软件,用Student’s t检验及方差分析进行统计学分析,所有实验独立重复3次,RT-PCR及蛋白质印迹结果均用Quantity One进行灰度分析,实验结果的计量数据以 x±s 表示,检验水准(α)为0.05。 2 结 果 2.1 阳性对照组细胞的制备
感染病毒48 h后,感染效率达到70%~80%。PCR结果显示,Ad-NE感染组特异性条带位于约803 bp处,大小符合预期;而Ad-KZ空载组在相同位置未出现条带。结果说明Ad-NE感染组中NE基因成功表达其mRNA (图 1)。
 | 图 1 RT-PCR产物凝胶电泳图 Fig 1 Gel electrophoresis result of RT-PCR products M: DL2000; 1: Ad-NE group; 2: Ad-KZ group |
患者组、正常人组、转染NB4组(阳性对照组)在29 000附近均出现了与NE蛋白相对分子质量大小相近的特异性条带。这说明患者血肿瘤细胞和正常人血中性粒细胞中均含有NE,能发生融合蛋白被切割的情况(图 2)。
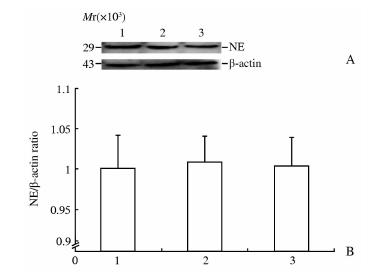 | 图 2 蛋白质印迹验证患者血肿瘤细胞中的NE Fig 2 Western blotting analysis of enzyme NE expression in peripheral blood tumor cells of APL patients1: Normal group; 2: APL group; 3: Positive control group. B was the quantitative graphs for A. NE: Neutrophil elastase. n=3, x±s |
患者组和转染NB4组(阳性对照组)均在相对分子质量约61 000处出现了与NLS-RARα蛋白相对分子质量大小相近的特异性条带,而正常人血细胞在相同位置未出现条带。这说明可以通过蛋白质印迹检测患者血肿瘤细胞中 NLS-RARα蛋白的表达情况,以Histone H3作为对照,其相对分子质量约为20 000(图 3)。
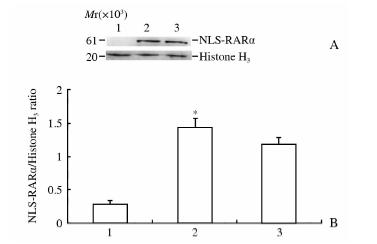 | 图 3 蛋白质印迹检测患者血肿瘤细胞NLS-RARα蛋白的表达 Fig 3 Western blotting analysis of NLS-RARα protein expression in peripheral blood tumor cells of APL patients1: Normal group; 2: APL group; 3: Positive control group. B was the quantitative graphs for A. NLS-RARα: Nuclear localization signal-retinoic acid receptor alpha. * P<0.05 vs normal group; n=3,x±s |
患者血肿瘤细胞中FITC染色区域与胞核DAPI染色几乎重叠,说明NLS-RARα蛋白在患者血肿瘤细胞中主要在胞核内表达,与转染NB4组(阳性对照组)相同。而正常人血中性粒细胞中FITC染色区域明显大于胞核DAPI染色区域,且胞核区域染色较浅,推测正常人血中性粒细胞中野生型RARα蛋白主要在胞质表达(图 4)。
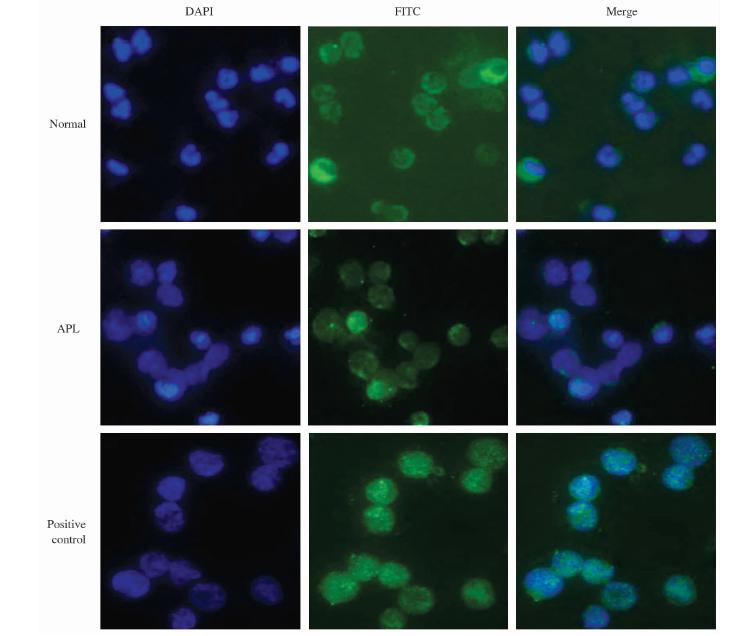 | 图 4 细胞免疫荧光图 Fig 4 Results of immunofluorescenceDAPI:4’,6-diamidino-2-phenylindole; FITC:Fluorescein isothiocyanate; APL: Acute promyelocytic leukemia. Original magnification: ×400 |
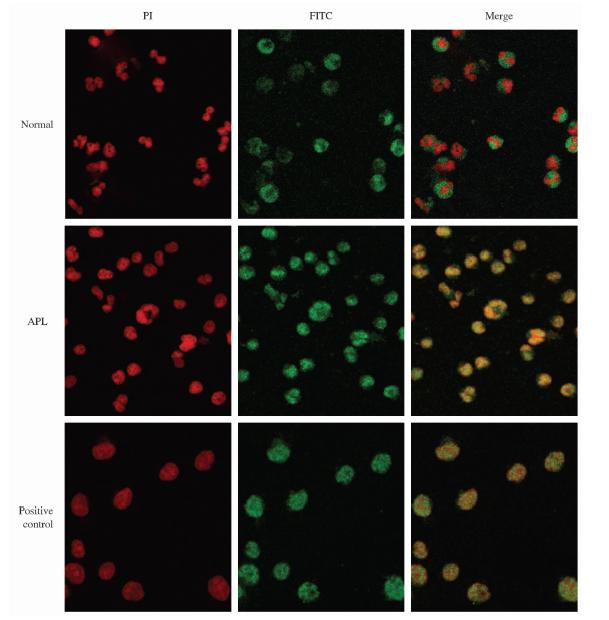 | 图 5 激光共聚焦图 Fig 5 Results of laser confocal microscopePI: Propidium iodide; FITC: Fluorescein isothiocyanate; APL: Acute promyelocytic leukemia. Original magnification: ×400 |
维甲酸是来自维生素A与细胞分化相关的一个信号分子家族。生理活性维甲酸通过RAR和 RXR受体介导细胞的转录。RARα基因染色体易位,致维甲酸信号受损,导致APL的发生。我们通过前期研究证实了NE对PML-RARα切割作用的存在,且PML(NLS-)能够促进细胞增殖,并可能通过上调Bcl-2和c-myc基因的表达、下调Bax基因的表达抑制细胞凋亡[10]。而NLS-RARα具有促进细胞增殖的作用,并通过上调c-myc基因的表达,抑制ATRA诱导的细胞分化[11]。且NLS-RARα蛋白与Ubiquilin 1蛋白、JTV1蛋白、谷氨酸氨连接酶等均有相互作用[12, 13, 14]。NLS是存在于某些蛋白质上的特殊序列,是介导其入核的特殊信号。NLS 通过被相应的核转运蛋白识别后,与核孔蛋白相互作用,帮助含NLS的货物蛋白通过核孔到达细胞核[15]。因此我们推测NLS-RARα蛋白中NLS信号区域在定位中有重要作用。我们发现NE切割以后,与野生型相比,原先主要在胞核的PML蛋白变成PML(NLS-)蛋白并大部分转移至胞质,而原本主要在胞质表达的RARα蛋白在切割后,成为NLS-RARα蛋白而迁至胞核。我们以这一系列的变化为线索,展开NLS-RARα蛋白的作用机制和检测方法相关研究。
随着近年来对APL的诊断和治疗的研究逐渐深入,包括染色体分析、荧光标记的原位杂交技术(fluorescence in situ hybridization,FISH)等[16]APL常规临床诊断方法逐渐被广泛应用,但APL的确诊仍停留在骨髓细胞形态学和细胞遗传学检测上,方法较为单一。最新的研究中对其他检测指标的探索较少。最新有关于肾母细胞瘤1基因(Wilms’ tumor 1,WT1)在APL中高表达的报道,但具体机制和特异性尚不明确[17]。因此,本课题希望通过研究NLS-RARα蛋白,开发一种简便、灵敏、快速、经济、准确的APL基因诊断技术应用于临床。
APL是急性髓细胞白血病的一个特殊亚型,其特点是白细胞异常增生,分化阻滞于早幼粒细胞阶段。其血液学特点表现为外周血及骨髓中出现大量形态异常的早幼粒细胞。外周血白细胞分类计数异常,以早幼粒细胞为主,可高达90%。因此APL患者外周血中存在大量的早幼粒细胞,本研究标本采用APL患者外周血的早幼粒细胞和正常人外周血中性粒细胞。本课题希望通过对APL患者血肿瘤细胞中NLS-RARα蛋白的存在及定位的验证,为APL早期诊断和复发检测新的指标提供思路。故本研究在前期成功重组腺病毒Ad-NE的基础上用3种方法验证了APL患者血肿瘤细胞中NLS-RARα蛋白的存在及定位,以正常人血中性粒细胞作阴性对照,已感染了重组腺病毒Ad-NE的NB4细胞作阳性对照。先将重组腺病毒Ad-NE的NB4细胞,用PCR验证感染成功,证明其作为APL疾病阳性对照组模型的可行性;再用蛋白质印迹法验证急性早幼粒细胞白血病患者血肿瘤细胞中NE的表达,证明该患者作为APL疾病模型的可行性。再通过蛋白质印迹法、细胞免疫荧光法、激光共聚焦显微镜观察法检测该患者血肿瘤细胞中 NLS-RARα蛋白的表达及定位。实验结果显示,成功获得阳性对照组。成功在患者血肿瘤细胞中检测到NE表达,通过蛋白质印迹法检测到患者血肿瘤细胞中 NLS-RARα的表达,并通过细胞免疫荧光法、激光共聚焦显微镜观察法推测其主要位于胞核。当然,这3种方法的方法学评价和其他新的检测方法有待进一步实验论证和探索。针对APL患者不同疾病阶段进行分组,观察NLS-RARα蛋白的定位研究仍需要进一步探索。
综上所述,本研究成功用3种方法验证了APL患者血肿瘤细胞中NLS-RARα蛋白的表达,并明确其定位于胞核,为进一步研究APL的临床诊断和治疗提供了新思路。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 顾伟英,胡绍燕,陈子兴,岑建农,曹祥山,何海龙,等.CD34+急性早幼粒细胞白血病的临床特点及预后[J].中华内科杂志, 2010,5:432-433. |
| [2] | Lengfelder E, Hofmann W K, Nowak D.Treatment of acute promyelocytic leukemia with arsenic trioxide: clinical results and open questions[J]. Expert Rev Anticancer Ther,2013, 13:1035-1043. |
| [3] | Lee H J, Park H J, Kim H W, Park S G.Comparison of laboratory characteristics between acute promyelocytic leukemia and other subtypes of acute myeloid leukemia with disseminated intravascular coagulation[J]. Blood Res, 2013,48:250-253. |
| [4] | González M, Barragán E, Bolufer P, Chillón C, Colomer D, Borstein R, et al. Pretreatment characteristics and clinical outcome of acute promyelocytic leukaemia patients according to the PML-RAR alpha isoforms: a study of the PETHEMA group[J].Br J Haematol,2001,114:99-103. |
| [5] | Laurenzana A, Pettersson F, Miller W H Jr. Role of PML/RARα in the pathogenesis of APL[J]. Drug Discovery Today: Disease Mechanisms, 2007, 3:499-505. |
| [6] | Lane A A, Ley T J. Neutrophil elastase cleaves PML-RARalpha and is important for the development of acute promyelocytic leukemia in mice[J]. Cell,2003,115:305-318. |
| [7] | Westervelt P, Ley T J. Seed versus soil: the importance of the target cell for transgenic models of human leukemias[J]. Blood, 1999, 93:2143-2148. |
| [8] | Lane A A, Ley T J. Neutrophil elastase is important for PML-retinoic acid receptor alpha activities in early myeloid cells[J]. Mol Cell Biol, 2005, 25:23-33. |
| [9] | 王 慧,钟 梁,蒋开玲,朱新瑜,马鹏鹏,阳小群,等. NLS-RARα蛋白在重组腺病毒Ad-NE感染的NB4中定位的验证[J].中国细胞生物学学报,2014,36:331-337. |
| [10] | 高远梅,刘北忠,张 曦,胡秀秀,钟 梁. 腺病毒介导的PML(NLS-)对大黄素引起的HL-60细胞存活的影响及其机制[J]. 四川大学学报:医学版,2013,44:703-707. |
| [11] | 胡秀秀,刘北忠,钟 梁,高远梅,张 曦,吴秀娟,等. Ad-NLS-RARα对HL-60细胞增殖及ATRA诱导的HL-60细胞分化的影响及其机制[J]. 四川大学学报:医学版,2013,44:897-901. |
| [12] | Zhu D, Wang C, Liu B, Wu Y, Zhong L, Wang C.Interaction between nuclear localization signal-retinoic acid receptor alpha and Ubiquilin 1[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2010,35:649-654. |
| [13] | 王 翀,王东生,刘北忠,郝 坡,刘 畅,金丹婷,等.带核定位信号的RARα与JTV1蛋白相互作用的验证实验[J].四川大学学报:医学版, 2009,40:382-384. |
| [14] | 吴 燕,刘北忠,王 翀,钟 梁,朱 丹,王春光,等.带核定位信号的RARα与谷氨酸氨连接酶蛋白相互作用的胞内外验证[J].第二军医大学学报,2010,31:468-471. Wu Y, Liu B Z, Wang C, Zhong L, Zhu D, Wang C G, et al. Verification of interaction between glutamate-ammonia ligase and nuclear localization signal-retinoic acid receptor α protein inside and outside cells[J]. Acad J Sec Mil Med Univ, 2010,31:468-471. |
| [15] | 赵元茵,王元忠,曹 念,周度金,李渝萍. 核定位信号及其分析策略[J]. 中国生物化学与分子生物学报,2009,25:683-689. |
| [16] | 汪红梅,翁少煌,林丽清,林新华,陈元仲.计时电量法用于检测急性早幼粒细胞白血病PML/RARα融合基因的研究[J].分析测试学报,2011, 30:872-876. |
| [17] | Hecht A, Nolte F, Nowak D, Nowak V, Reinwald M, Hanfstein B, et al. Prognostic importance of expression of the Wilms' tumor 1 gene in newly diagnosed acute promyelocytic leukemia[J]. Leuk Lymphoma,2014, 26:1-28. |
 2015, Vol. 36
2015, Vol. 36


