原发免疫性血小板减少症(primaryimmunethrombocytopenia,ITP)是临床上最为常见的出血性疾病,其特点为机体主要产生针对自身血小板膜糖蛋白GPⅡb/Ⅲa的自身抗体,导致血小板被自身单核巨噬细胞系统吞噬破坏[1]。临床表现以皮肤淤点淤斑、黏膜出血及内脏出血为特征,严重者可危及生命[2]。ITP是一种公认的自身免疫性疾病,其发病机制尚未完全阐明,因而导致难以根治。
国内外已有的研究多认为,T细胞免疫紊乱是ITP发病机制中的重要环节。如Th1/Th2细胞失衡,Th17、Treg细胞数量及功能异常均参与了ITP的发病[3]。Th9细胞是近年来新发现的一种辅助性T细胞亚群,以分泌IL-9为特点。Th9细胞的发育主要受TGF-β、PU.1(由Spi1基因编码)和IRF4信号的调控[4]。Th9细胞在多种自身免疫性疾病的发病中均发挥重要作用,如系统性红斑狼疮(SLE)[5]、炎症性肠病(IBD)[6]等,但其在ITP中的表达尚不明确。本研究旨在探讨新诊断的成人ITP患者外周血中Th9细胞的表达及其临床意义。 1 材料和方法 1.1 研究对象
本研究共纳入2012年7月至2014年6月间在第二军医大学长海医院新诊断的未经治疗的成人ITP患者共25例,其诊断均满足中华医学会血液学分会血栓与止血学组2012年制定的成人原发免疫性血小板减少症诊断与治疗中国专家共识[7]。其中男10例,女15例,平均年龄(41.32±13.70)岁。另纳入年龄、性别相匹配的25名健康者作为正常对照组,其中男11例,女14例,平均年龄(40.12±14.02)岁。同时根据参考文献[8]分析血小板(PLT)≤30×109/L患者和PLT>30×109/L患者组间相应指标的差别。本研究经过长海医院伦理委员会批准,所有受试对象均签署知情同意书。 1.2 试剂与仪器
流式细胞仪(FACSCalibur,BD公司);酶标仪(Thermo公司);实时荧光定量PCR仪(ABI7500);血细胞计数仪(SysmexXE-2100);FITC标记的抗CD4抗体、PE标记的抗CD9抗体、固定与穿膜试剂盒(BD公司);cDNA反转录试剂盒、血清IL-9ELISA检测试剂盒(R&D公司)。 1.3 标本收集
取3mL静脉血,使用枸橼酸钠抗凝。使用Ficoll密度梯度离心法分离外周血单个核细胞(PBMC),留取血清用于后续ELISA分析,所得PBMC分装为两管,一管用于后续流式细胞术分析,另一管用于实时荧光定量PCR分析。 1.4 ELISA法检测血清中IL-9的表达
根据试剂盒说明书,采用ELISA法检测血清IL-9表达量。 1.5 流式细胞术检测PBMC中Th9细胞分类
使用RPMI1640培养液调整细胞密度为5×106个/mL,根据试剂盒说明加入丙二醇甲醚醋酸酯(PMA)、离子霉素、莫能菌素刺激,于37℃、5%CO2孵箱中孵育4h后取出,以PBS洗涤2次。将上述培养好的标本分别进行荧光抗体染色,每106个/mL细胞中加入5μLFITC-CD4,避光孵育30min。根据试剂盒说明固定、破膜后进行细胞内染色,加入10μLPE-IL-9,避光孵育30min。同步设定同型对照管及阴性对照管,PBS洗涤后,250×g离心5min,弃上清,重复洗2次,加入300μLPBS重悬,上机检测。定义CD4+IL-9+者为Th9细胞。 1.6 实时荧光定量PCR检测PBMC中IL-9、TGF-β、PU.1和IRF4的表达
在PBMC中加入TRIzol试剂,按照试剂盒操作说明提取总RNA,然后进行反转录反应,制备cDNA,使用SYBRgreen法进行实时荧光定量PCR,引物序列见表 1。扩增条件:95℃30s;95℃5s;60℃20s,72℃30s,进行40个循环。使用GAPDH为内参基因,根据2-ΔΔCt法(其中ΔΔCt=ΔCt,Q-ΔCt,C。ΔCt,Q为疾病组靶基因的Ct值与管家基因Ct值之差;ΔCt,C为对照组靶基因的Ct值与管家基因Ct值之差)计算两组标本IL-9、TGF-β、PU.1和IRF4的相对表达量。
|
|
表 1 IL-9、TGF-β、PU.1和IRF4的引物序列 Tab 1 Primer sequences for IL-9,TGF-β,PU.1,and IRF4 |
所有受试对象取静脉血2mL置于EDTA抗凝管中,通过血细胞计数仪(SysmexXE-2100)进行PLT计数。 1.8 随访
随访11例患者至治疗结束并达到完全缓解,即治疗后PLT计数≥100×109/L,且无出血症状[7]。这11例患者接受的治疗方案均为地塞米松(40mg/d)连续治疗4d,治疗结束后采集标本分析相关指标的变化情况。其余患者中有6例未达到完全缓解标准,8例患者未能获取治疗后标本。 1.9 统计学处理
使用SPSS17.0软件进行统计分析。计量资料以 x±s 表示,两组间差异的比较采用Mann-WhitneyU检验,相关性分析采用Spearman相关分析。检验水准(α)为0.05。 2 结 果 2.1 ITP患者一般情况
25例患者病程(根据患者主诉发病起始时间)为1~26个月,平均(10.20±7.16)个月,治疗前PLT为(34.48±21.63)×109/L,对照组PLT为(193.12±52.03)×109/L,两组比较差异有统计学意义(P<0.05)。其中随访的11例患者治疗前PLT为(31.36±21.72)×109/L,治疗后PLT为(182.27±26.06)×109/L,治疗后PLT明显升高(P<0.05)。 2.2 ITP患者细胞比例分析
与健康对照组相比,ITP患者外周血Th9细胞比例增高[(0.99±0.40)%vs(0.25±0.11)%,P<0.05],且在PLT≤30×109/L的患者(n=13)中Th9细胞比例也高于PLT>30×109/L的患者(n=12)[1.21±0.36)%vs(0.77±0.32)%,P<0.05],见图 1。 2.3 ITP患者外周血IL-9mRNA和蛋白的表达
与 健康对照组相比,ITP患者外周血IL-9mRNA和蛋白水平均增高(P<0.05),且在PLT≤30×109/L 患者中IL-9mRNA和蛋白水平均高于PLT>30×109/L的患者(P<0.05),见表 2。
|
|
表 2 ITP患者和对照组IL-9mRNA和蛋白的表达 Tab 2 IL-9 mRNA and protein expressions in ITP patients and healthy controls |
 | 图 1 ITP患者Th9细胞百分比分析 Fig 1 ercentages of Th9 cells in peripheral blood of ITP patients ITP:Primary immune thrombocytopenia;HC:Healthy control; PLT: Platelet.*P<0.05.n=25 for ITP and HC n=13 for ITP patients with PLT≤30×109/Landn=12for ITP patients with PLT >30×109/L |
与健康对照组相比,ITP患者TGF-β (3.15±1.10vs1.00±0.20)、PU.1(4.05±0.80vs1.00±0.18)和IRF4(2.87±0.58vs1.00±0.18)水平增高,差异均具有统计学意义(P<0.05),见图 2。
 | 图 2 ITP患者TGF-β、PU.1和IRF4mRNA相对表达量分析 Fig 2 mRNA expressions of TGF-β,PU.1,and IRF4 in peripheral blood of ITP patients ITP:Primary immune thrombocytopenia;HC:Healthy control *P<0.05.n=25,x±s |
在ITP患者中,Th9细胞比例和IL-9蛋白水平均与患者PLT计数负相关(r=-0.4281,P=0.0328;r=-0.5375,P=0.0056),见图 3。
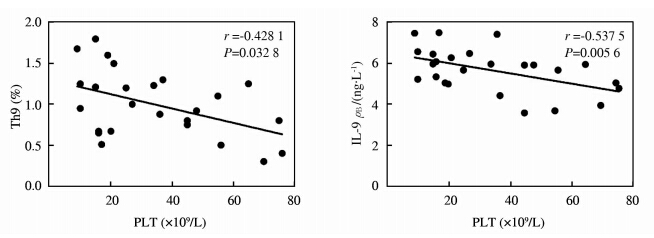 | 图 3 ITP患者Th9、IL-9与血小板计数的相关性分析 Fig 3 Correlation analysis of Th9 and IL-9 with PLT count in ITP patients ITP:Primary immune thrombocytopenia;PLT:Platelet |
随访11名ITP患者,经有效治疗后,患者Th9细胞比例和IL-9水平均呈下降趋势(P<0.05),见图 4。
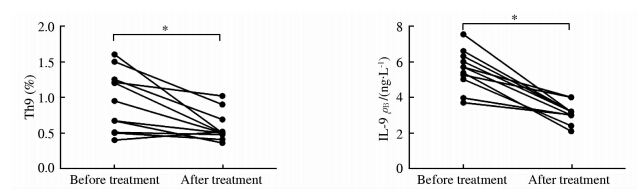 | 图 4 ITP患者治疗前后Th9细胞比较和IL-9水平的变化趋势 Fig 4 Change of Th9 and IL-9 expressions in ITP patients before and after treatment ITP:Primary immune thrombocytopenia *P<0.05.n=11,x±s |
Th9细胞是最新被发现的一种Th细胞亚群,尽管IL-9最初被认为是一种典型的Th2型细胞因子,但在近来的研究中已经确定IL-9主要由Th9细胞亚群产生[9,10]。Th9细胞主要由IL-4和TGF-β信号诱导而分化产生,其IL-9的产生同样由多种细胞因子及转录因子调节,包括PU.1、GATA-3和IRF4等[4]。其中PU.1对IL-9产生的调控作用尤为重要,使用TGF-β刺激T细胞可产生PU.1,PU.1可直接结合在IL-9基因的启动子区域,与组蛋白乙酰转移酶GCN5组成复合体,从而激活IL-9启动子[11],PU.1是控制Th9细胞分化的关键因素之一,同时可负向调控Th2细胞的分化[12]。本研究发现与健康对照组相比,成年ITP患者Th9细胞比例以及IL-9mRNA和蛋白水平均增高(P<0.05),且PLT≤30×109/L的ITP患者Th9细胞比例以 及IL-9mRNA和蛋白水平均高于PLT>30×109/L 的ITP患者(P<0.05),同时ITP患者中调控Th9/IL-9的重要因子TGF-β、PU.1和IRF4均增高(P<0.05)。这些结果表明成年ITP患者中Th9/IL-9信号异常活化,且在病情较重的患者中Th9/IL-9调节紊乱现象更为严重,提示Th9/IL-9在ITP的发病机制中可能发挥重要作用,且可能是由于上游转录因子和细胞因子紊乱所导致的。其具体的调控机制仍待进一步研究。
Th9与其分泌的细胞因子IL-9在多种自身免疫性疾病中均有重要作用,如系统性红斑狼疮[5]、系统性硬化[13]和自身免疫性脑脊髓炎[14]等。研究表明,给小鼠注入Th9细胞可诱导更严重的实验性变态反应性脑脊髓炎(EAE)症状及中枢神经系统损害[15],使用抗IL-9单抗或IL-9受体缺陷,可能通过减轻髓鞘少突胶质细胞糖蛋白(MOG)激活的Th1和Th17反应,从而显著减轻EAE的症状[16]。IL-9可促进Th17和Treg细胞的存活并激活STAT3和STAT5信号通路,使用IL-9抗体阻断IL-9信号通路后,使Treg细胞功能下降,使用重组IL-9后Treg细胞的抑制功能加强[17]。上述研究表明,Th9/IL-9可能作为自身免疫性疾病治疗的潜在靶点。
本研究发现在成年ITP患者中,Th9/IL-9与PLT计数相关,这进一步证实了Th9/IL-9参与ITP的疾病进展,并提示Th9/IL-9可能作为评估疾病严重程度的指标。Th9/IL-9可能通过促进Th17和Treg细胞的功能,从而加剧ITP患者免疫紊乱。通过进一步随访11例ITP患者,发现经有效治疗后,患者Th9/IL-9均呈下降趋势。有研究表明,ITP患者使用糖皮质激素治疗,可以纠正Th细胞亚群失衡[18]。本研究发现,经有效治疗后,ITP患者Th9/IL-9也有恢复正常的趋势,该结果同样表明,Th9/IL-9可能与ITP的疾病进程密切相关。
综上所述,本研究发现成年ITP患者Th9细胞、IL-9水平增高,在PLT≤30×109/L的患者中Th9/IL-9异常活化程度更为严重,且其与患者血小板计数显著相关,提示Th9/IL-9的异常活化可能参与了疾病的发生与发展,这为进一步理解ITP的免疫学发病机制及免疫调节治疗潜在靶点的选择提供了新的线索。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | McKenzie C G, Guo L, Freedman J, Semple J W. Cellular immune dysfunction in immune thrombocytopenia (ITP)[J]. Br J Haematol, 2013, 163:10-23. |
| [2] | Kuhne T. Update on the Intercontinental Cooperative ITP Study Group (ICIS) and on the Pediatric and Adult Registry on Chronic ITP (PARC ITP)[J]. Pediatr Blood Cancer, 2013, 60 (Suppl) 1:S15-S18. |
| [3] | Semple J W, Provan D. The immunopathogenesis of immune thrombocytopenia: T cells still take center-stage[J]. Curr Opin Hematol, 2012, 19:357-362. |
| [4] | Gerlach K, Hwang Y, Nikolaev A, Atreya R, Dornhoff H, Steiner S, et al. TH9 cells that express the transcription factor PU.1 drive T cell-mediated colitis via IL-9 receptor signaling in intestinal epithelial cells[J]. Nat Immunol, 2014, 15:676-686. |
| [5] | Ouyang H, Shi Y, Liu Z, Feng S, Li L, Su N, et al. Increased interleukin9 and CD4+IL-9+ T cells in patients with systemic lupus erythematosus[J]. Mol Med Rep, 2013, 7:1031-1037. |
| [6] | Nalleweg N, Chiriac M T, Podstawa E, Lehmann C, Rau T T, Atreya R, et al. IL-9 and its receptor are predominantly involved in the pathogenesis of UC[J]. Gut, 2014 Jun 23. pii: gutjnl-2013-305947. doi: 10.1136/gutjnl-2013-305947. |
| [7] | 中华医学会血液学分会血栓与止血学组. 成人原发免疫性血小板减少症诊断与治疗中国专家共识(2012年版)[J]. 中华血液学杂志, 2012, 33:975-977. |
| [8] | Dolasik I, Birtas Atesoglu E, Tarkun P, Mehtap O, Keski H, Dogru A, et al. Decreased serum heat shock protein 60 levels in newly diagnosed immune thrombocytopenia patients[J]. Platelets, 2014 Apr 21. |
| [9] | Kaplan M H. Th9 cells: differentiation and disease[J]. Immunol Rev, 2013, 252:104-115. |
| [10] | Raphael I, Nalawade S, Eagar T N, Forsthuber T G. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J]. Cytokine, 2014 Oct 30. pii: S1043-4666(14)00539-0. doi: 10.1016/j.cyto.2014.09.011. |
| [11] | Goswami R, Kaplan M H. Gcn5 is required for PU.1-dependent IL-9 induction in Th9 cells[J]. J Immunol, 2012, 189:3026-3033. |
| [12] | Chang H C, Sehra S, Goswami R, Yao W, Yu Q, Stritesky G L, et al. The transcription factor PU.1 is required for the development of IL-9-producing T cells and allergic inflammation[J]. Nat Immunol, 2010, 11:527-534. |
| [13] | Yanaba K, Yoshizaki A, Asano Y, Kadono T, Sato S. Serum interleukin 9 levels are increased in patients with systemic sclerosis: association with lower frequency and severity of pulmonary fibrosis[J]. J Rheumatol, 2011, 38:2193-2197. |
| [14] | Murugaiyan G, Beynon V, Pires Da Cunha A, Joller N, Weiner H L. IFN-gamma limits Th9-mediated autoimmune inflammation through dendritic cell modulation of IL-27[J]. J Immunol, 2012, 189:5277-5283. |
| [15] | Jager A, Dardalhon V, Sobel R A, Bettelli E, Kuchroo V K. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes[J]. J Immunol, 2009, 183:7169-7177. |
| [16] | Li H, Nourbakhsh B, Ciric B, Zhang G X, Rostami A. Neutralization of IL-9 ameliorates experimental autoimmune encephalomyelitis by decreasing the effector T cell population[J]. J Immunol, 2010, 185:4095-4100. |
| [17] | Elyaman W, Bradshaw E M, Uyttenhove C, Dardalhon V, Awasthi A, Imitola J, et al. IL-9 induces differentiation of TH17 cells and enhances function of FoxP3+ natural regulatory T cells[J]. Proc Natl Acad Sci U S A, 2009, 106:12885-12890. |
| [18] | Li J, Wang Z, Hu S, Zhao X, Cao L. Correction of abnormal T cell subsets by high-dose dexamethasone in patients with chronic idiopathic thrombocytopenic purpura[J]. Immunol Lett, 2013, 154:42-48. |
 2015, Vol. 36
2015, Vol. 36


