2. 第二军医大学基础医学部生理学教研室, 上海 200433
2. Department of Physiology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
Corresponding author
随着经皮腔内冠状动脉成形术(PTCA)、冠状动脉内支架植入术(ICS)、冠状动脉旁路移植术(CABG)等新技术的应用,缺血性心脏病的治疗取得了显著进展[1],患者的病死率和致残率明显降低,但心肌血供再通后的缺血再灌注(ischemia/reperfusion,I/R)损伤仍是临床常见的心脏损害[2,3,4]。如何减轻和避免I/R对心脏的损伤一直是医学研究中亟待解决的临床问题。
自噬(autophagy)是真核生物对细胞内物质进行周转的重要过程,是细胞死亡的重要过程和机制,在进化中高度保守[5]。在自噬过程中,细胞中一些损坏的蛋白或细胞器被双层膜结构的自噬小泡包裹,送入溶酶体(动物)或液泡(酵母和植物)中进行降解并得以循环利用,以实现细胞稳态和细胞器的更新[6,7]。我们的前期研究发现I/R能诱导心肌发生自噬[8],说明自噬在I/R损伤过程中具有重要作用,但其具体调控机制尚未阐明[9]。
长链非编码RNA(long non-coding RNA,lncRNA)是继microRNA后发现的又一种细胞内源性的RNA小分子,其长度超过200 nt,以RNA的形式在表观遗传调控、转录调控以及转录后调控等多层面上调控基因的表达[10]。近年来的研究表明,lncRNA参与了X染色体沉默、基因组印记及染色质修饰、转录激活及干扰、核内运输等多种重要的调控过程[11],引起人们广泛关注。研究发现在心肌肥厚、纤维化以及I/R等过程中许多lncRNA都发挥 了重要的调控作用[12,13]。HIF1A-AS1是位于人14号染色体上的一种lncRNA,其成熟体长度约为652 nt,对平滑肌细胞的增殖和凋亡具有调控作用[14]。目前HIF1A-AS1在心肌细胞中的表达及其作用尚不清楚,本研究旨在探讨HIF1A-AS1对大鼠I/R心肌损伤是否具有保护作用,并初步探索其与心肌细胞自噬的关系。 1 材料和方法 1.1 大鼠I/R损伤模型制备[15]
本研究中的动物实验经第二军医大学动物伦理委员会批准。成年雄性SD大鼠(250~300 g)购自第二军医大学实验动物中心[许可证号:SCXK(沪)2012-0003],随机分成2组,分别为假手术组和I/R组,每组10只。所有大鼠经水合氯醛麻醉并气管插管,呼吸机机械通气。I/R大鼠采用结扎左冠状动脉前降支的方法造成心肌缺血1 h,随后恢复血供再灌注2 h。结扎后心电 图Ⅱ导联ST段出现弓背向上抬高、T波高耸等表现,开放血供后抬高的ST段下降1/2以上为I/R成功。 1.2 新生大鼠心肌细胞缺氧/复氧(hypoxia/reoxygenation,H/R)培养[16]
取新生3 d内SD乳鼠(购自第二军医大学实验动物中心)的心脏,用胰蛋白酶和胶原酶(Gibco公司)联合消化,采用差速贴壁法纯化心肌细胞,培养于含20%小牛血清(杭州四季青生物工程材料有限公司)、0.1 mmol/L BrdU(Sigma公司)的DMEM培养液(Gibco公司)中。培养72 h后,更换无血清的DMEM培养液,在1%O2、5%CO2和94%N2的条件下培养24 h,随后转移至5% CO2的常规条件下继续培养2 h,造成心肌细胞H/R损伤。 1.3 转染siRNA抑制心肌细胞HIF1A-AS1的表达
原代分离乳鼠心肌细胞,血细胞计数板计数细胞,以5×105/mL的密度接种于12孔板,于5%CO2、37℃条件下培养。利用脂质体(Invitrogen公司)转染的方法,以50 pmol/L针对HIF1A-AS1的siRNA(si-HIF1A-AS1)转染心肌细胞。Si-HIF1A-AS1的序列为:5′-GAGUCUGUGUGGGACAAGCACUUCA-3′。该序列采用Primer 3软件设计,由生工生物工程(上海)股份有限公司合成。 1.4 HIF1A-AS1表达的检测
利用TRI Reagent试剂(MRC公司)提取组织或细胞总RNA,用紫外分光光度计测定样品浓度。取500 ng总RNA为模板,利用oligo dT和随机引物合成cDNA,利用SYBR Green染料法进行实时定量PCR反应。反应体系:20 μL,含cDNA 2 μL,引物5 pmol,SYBR Green Master mix 10 μL;反应条件:95℃ 10 s;60℃ 30 s;40个循环。结果用Ct值分析,以GAPDH基因作为内参,折算为相对倍数,确定基因表达的相对变化。所用引物采用Primer 3软件设计,由生工生物工程(上海)股份有限公司合成,序列为:HIF1A-AS1 F:5′-TTCGGTACTTTACGCACCCT-3′;R:5′-TTTTCCTCCTTTTCGCCAGC-3′;GAPDH F: 5′-CAAGTTCAACGGCACAGTCA-3′;R:5′-CCC-CATTTGATGTTAGCGGG-3′。
1.5 心肌细胞损伤的检测
采用CCK-8方法检测心肌细胞存活率,全自动生化分析仪检测细胞培养液上清中乳酸脱氢酶(lactic dehydrogenase,LDH)含量。CCK-8试剂购自碧云天公司。 1.6 心肌细胞自噬标志蛋白Beclin-1的检测
利用蛋白质印迹法检测自噬标志蛋白Beclin-1的表达以确定自噬水平的变化。具体方法为:利用RIPA试剂提取心肌细胞总蛋白,BCA定量后取30 μg蛋白,经SDS-PAGE分离,经转膜、封闭,抗体杂交后显影,通过Image J扫描灰度值后计算相对水平。RIPA试剂、BCA试剂盒分别购自碧云天公司,Beclin-1抗体购自MBL公司,GAPDH和二抗购自博士德公司。 1.7 统计学处理
采用SPSS18.0软件进行数据分析。每组实验至少重复3次,数据以 x±s 表示。 样本间比较采用单因素方差分析,各组均数的多重比较采用最小显著差值法(LSD)。检验水准(α)为0.05。 2 结 果 2.1 HIF1A-AS1在心肌I/R损伤中表达上调
在大鼠I/R损伤模型中,HIF1A-AS1在心肌组织中的表达 增加,与对照组比较差异有统计学意义(P<0.01); 同时在心肌细胞H/R损伤模型中,HIF1A-AS1的表达也明显上调,与对照组比较差异有统计学意义(P<0.01)。见图 1。
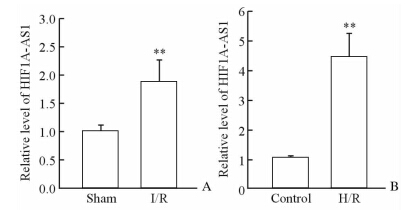 | 图 1 HIF1A-AS1在I/R大鼠的心肌组织(A)和H/R刺激的心肌细胞(B)中的表达 Fig 1 Expression of HIF1A-AS1 in myocardium from I/R rats (A) and cardiac myocytes stimulated by H/R (B) I/R: Ischemia/reperfusion; H/R: Hypoxia/reoxygenation. **P<0.01 vs sham or control group,respectively. n=3,x±s |
利用siRNA转染心肌细胞,结果发现 HIF1A-AS1的水平降低(P<0.01,图 2A),说明 siRNA的抑制效果有效。随后进行H/R刺激,结果发现培养液上清中LDH的水平与未抑制组比较降低(P<0.01,图 2B),心肌细胞的存活率与未抑制组 比较增加,差异均有统计学意义(P<0.01,图 2C)。说明抑制HIF1A-AS1对H/R损伤的心肌细胞具有保护作用。
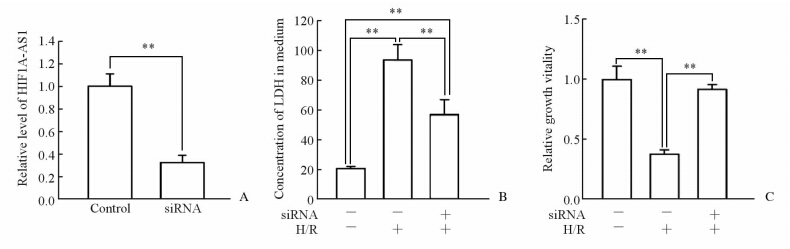 | 图 2 抑制HIF1A-AS1保护H/R损伤的心肌细胞 Fig 2 Inhibiting HIF1A-AS1 protects against myocardial H/R injury A:The inhibitory effect of siRNA on HIF1A-AS1;B: LDH concentration in culture medium; C: Growth vitality of myocardial cells. I/R: Ischemia/reperfusion; H/R: Hypoxia/reoxygenation; LDH: Lactic dehydrogenase. **P<0.01. n=3,x±s |
H/R刺激可引起心肌细胞自噬相关蛋白Beclin-1表达增加(P<0.01),抑制心肌细胞HIF1A-AS1后再进行H/R刺激,结果发现心肌细胞自噬相关蛋白Beclin-1的表达减少,与非抑制组比较差异有统计学意义(P<0.01)。说明抑制HIF1A-AS1能降低心肌细胞自噬水平。见图 3。
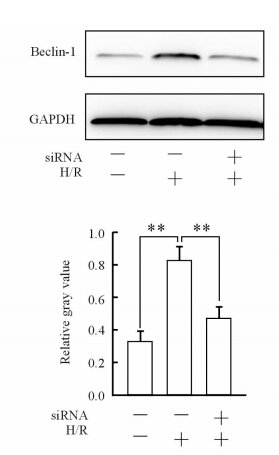 | 图 3 HIF1A-AS1对H/R诱导的心肌细胞自噬相关蛋白Beclin-1表达的影响 Fig 3 Effect of HIF1A-AS1 on growth and autophagy of cardiac myocytes induced by H/R H/R: Hypoxia/reoxygenation. **P<0.01. n=3,x±s |
LncRNA一般在表观遗传调控、转录调控以及转录后调控等多种层面上调控基因的表达。研究发现HIF1A-AS1在神经元和神经胶质细胞中通过表观遗传过程的调节控制神经胶质细胞的命运决定[18]。有研究确认HIF1A-AS1在主动脉夹层的血管壁组织中表达上调,抑制其水平可减少平滑肌细胞凋亡,促进其生长[14]。我们发现在心肌I/R过程中,HIF1A-AS1的表达升高可能与心肌细胞的损伤密切相关,抑制HIF1A-AS1可降低心肌细胞H/R诱导的损伤。
自噬是细胞内普遍存在的一种降解机制,细胞内基础状态下的自噬可以清除细胞内损伤的细胞器,从而对维持细胞稳态有重要意义,但是过度的自噬可以导致细胞死亡,并且对坏死和凋亡都有促进作用[19]。研究发现心肌在I/R发生以后,大量生成活性氧,诱导Beclin-1基因的表达,细胞自噬的水平明显增加[20]。我们的前期研究也发现缺氧能诱导心肌发生自噬[8]。Beclin-1是自噬相关基因(autophagy related gene,ATG)在哺乳动物中的同源基因,是细胞自噬发生的必需蛋白,介导其他因子定位于自噬泡,调控自噬体的形成和成熟[21,22]。有研究显示细胞中Beclin-1的活性似乎受到信号激酶的严密调控,细胞生长促进激酶Akt在远端位点磷酸化Beclin-1,并通过控制其细胞内定位抑制Beclin-1的自噬活性[23]。
我们的研究发现,抑制HIF1A-AS1的水平能够减少Beclin-1的表达,从而降低心肌细胞的自噬水平。缺氧是心肌细胞自噬的重要诱导因素,在I/R过程中的缺氧阶段,细胞自噬水平升高,起到抑制心肌细胞坏死或凋亡的作用,保护心肌组织;而在再灌注阶段,细胞中自噬仍处于较高水平,起到了促坏死或促凋亡的作用,造成心肌损伤[19]。因此,心肌I/R损伤可能是由细胞过度自噬造成的,HIF1A-AS1对自噬的调控作用,可能在I/R损伤的预防和治疗中具有重要意义。
本研究主要发现了lncRNA HIF1A-AS1在I/R心肌组织和H/R诱导的心肌细胞中表达升高,抑制HIF1A-AS1的水平对心肌I/R损伤具有保护作用。这种保护作用可能通过降低心肌细胞的过度自噬实现的。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Makaryus J N, Volfson A, Azer V, Bogachuk E, Lee A.Acute stent thrombosis in the setting of cocaine abuse following percutaneous coronary intervention[J].J Interv Cardiol, 2009, 22:77-82. |
| [2] | Hausenloy D J, Yellon D M.Myocardial ischemia-reperfusion injury:a neglected therapeutic target[J].J Clin Invest, 2013, 123:92-100. |
| [3] | Jennings R B.Historical perspective on the pathology of myocardial ischemia/reperfusion injury[J].Circ Res, 2013, 113:428-438. |
| [4] | Müller A L, Hryshko L V, Dhalla N S.Extracellular and intracellular proteases in cardiac dysfunction due to ischemia-reperfusion injury[J].Int J Cardiol, 2013, 164:39-47. |
| [5] | Boya P, Reggiori F, Codogno P.Emerging regulation and functions of autophagy[J].Nat Cell Biol, 2013, 15:713-720. |
| [6] | Nixon R A.The role of autophagy in neurodegenerative disease[J].Nat Med, 2013, 19:983-997. |
| [7] | Ryter S W, Cloonan S M, Choi A M.Autophagy:a critical regulator of cellular metabolism and homeostasis[J].Mol Cells, 2013, 36:7-16. |
| [8] | 张冠鑫, 韩 林, 郭志福, 王 崇, 任安经, 钟 铿, 等.Urocortin抑制心肌缺血再灌注诱导的自噬[J].第二军医大学学报, 2013, 34:11-16. Zhang G X, Han L, Guo Z F, Wang C, Ren A J, Zhong K, et al.Urocortin inhibits myocardium ischemia/reperfusion-induced autophagy[J].Acad J Sec Mil Med Univ, 2013, 34:11-16. |
| [9] | Dirks-Naylor A J.The role of autophagy in doxorubicin-induced cardiotoxicity[J].Life Sci, 2013, 93:913-916. |
| [10] | Geisler S, Coller J.RNA in unexpected places:long non-coding RNA functions in diverse cellular contexts[J].Nat Rev Mol Cell Biol, 2013, 14:699-712. |
| [11] | Wapinski O, Chang H Y.Long noncoding RNAs and human disease[J].Trends Cell Biol, 2011, 21:354-361. |
| [12] | Liu Y, Li G, Lu H, Li W, Li X, Liu H, et al.Expression profiling and ontology analysis of long noncoding RNAs in post-ischemic heart and their implied roles in ischemia/reperfusion injury[J].Gene, 2014, 543:15-21. |
| [13] | Chen Z, Jia S, Li D, Cai J, Tu J, Geng B, et al.Silencing of long noncoding RNA AK139328 attenuates ischemia/reperfusion injury in mouse livers[J].PLoS One, 2013, 8:e80817. |
| [14] | Wang S, Zhang X, Yuan Y, Tan M, Zhang L, Xue X, et al.BRG1 expression is increased in thoracic aortic aneurysms and regulates proliferation and apoptosis of vascular smooth muscle cells through the long non-coding RNA HIF1A-AS1 in vitro[J].Eur J Cardiothorac Surg, 2014 May 29.pii:ezu215.[Epub ahead of print] |
| [15] | Jeanes H L, Tabor C, Black D, Ederveen A, Gray G A.Oestrogen-mediated cardioprotection following ischaemia and reperfusion is mimicked by an oestrogen receptor (ER) alpha agonist and unaffected by an ER beta antagonist[J].J Endocrinol, 2008, 197:493-501. |
| [16] | Brar B K, Jonassen A K, Egorina E M, Chen A, Negro A, Perrin M H, et al.Urocortin-Ⅱ and urocortin-Ⅲ are cardioprotective against ischemia reperfusion injury:an essential endogenous cardioprotective role for corticotropin releasing factor receptor type 2 in the murine heart[J].Endocrinology, 2004, 145:21-35. |
| [17] | Cao X, Wang X, Ling Y, Song X, Yang P, Liu Y, et al.Comparison of the degree of autophagy in neonatal rat cardiomyocytes and H9c2 cells exposed to hypoxia/reoxygenation[J].Clin Lab, 2014, 60:809-814. |
| [18] | Mercer T R, Qureshi I A, Gokhan S, Dinger M E, Li G, Mattick J S, et al.Long noncoding RNAs in neuronal-glial fate specification and oligodendrocyte lineage maturation[J].BMC Neurosci, 2010, 11:14. |
| [19] | Ryter S W, Nakahira K, Haspel J A, Choi A M.Autophagy in pulmonary diseases[J].Annu Rev Physiol, 2012, 74:377-401. |
| [20] | Matsui Y, Takagi H, Qu X, Abdellatif M, Sakoda H, Asano T, et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J].Circ Res, 2007, 100:914-922. |
| [21] | Liang X H, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, et al.Induction of autophagy and inhibition of tumorigenesis by beclin 1[J].Nature, 1999, 402:672-676. |
| [22] | Decuypere J P, Parys J B, Bultynck G.Regulation of the autophagic bcl-2/beclin 1 interaction[J].Cells, 2012, 1:284-312. |
| [23] | Wang R C, Wei Y, An Z, Zou Z, Xiao G, Bhagat G, et al.Akt-mediated regulation of autophagy and tumorigenesis through Beclin 1 phosphorylation[J].Science, 2012, 338:956-959. |
 2015, Vol. 36
2015, Vol. 36


