2. 重庆医科大学附属第一医院内分泌科, 重庆 400016
2. Department of Endocrinology, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
糖尿病脑病以认知功能障碍和大脑的神经损伤及结构异常为主要特点,已引起了人们的广泛关注[1,2]。长期的高血糖及其代谢紊乱可在结构、神经生理及神经精神等诸方面对大脑产生不良影响,且糖尿病患者发展成阿尔茨海默病(AD)的危险性大大增高[3]。近年来研究发现,大脑内炎症加重了AD的不断恶化,非类固醇类抗炎药阿司匹林有预防AD发生的作用[4]。目前,糖尿病脑病的具体发病机制尚不清楚,亦缺乏有效的防治手段。研究发现,胰岛素样生长因子1受体(IGF-1R)信号通路障碍诱导了神经细胞生长发育障碍及细胞凋亡,参与了糖尿病脑病的发生、发展[5,6,7]。目前缺乏阿司匹林与糖尿病脑病关系的研究。因此,本研究初步观察阿司匹林治疗状态下糖尿病脑病大鼠的学习记忆及海马IGF-1R/磷酸化胰岛素样生长因子1受体(p-IGF-1R)表达的变化,初步探讨阿司匹林对糖尿病脑病认知障碍的防治作用及可能的作用机制。 1 材料和方法 1.1 实验动物及试剂
健康雄性8周龄SD大鼠,体质量200~250 g,由重庆医科大学实验动物中心提供,动物使用许可证号:SYXK(渝)2012-0001。水迷宫程序自动控制仪(重庆市神经病学重点实验室);链脲佐菌素(STZ,Sigma公司);阿司匹林(湖北远成药业有限公司,批号:20090218);IGF-1R抗体、p-IGF-1R抗体(美国Immunoway生物技术公司);β-actin抗体、山羊抗兔IgG-HRP、兔抗小鼠IgG-HRP(北京中杉金桥生物技术有限公司)。 1.2 糖尿病大鼠模型的建立和分组
大鼠适应性饲养1周,禁食12 h,以pH为4.5的0.1 mol/L柠檬酸钠缓冲液稀释STZ后,避光并快速以60 mg/kg量一次性腹腔注射建立糖尿病大鼠模型。3 d后,造模大鼠隔夜禁食不禁饮8 h以上,取大鼠尾静脉血检测空腹血糖值,将空腹血糖>18 mmol/L的大鼠定为糖尿病大鼠,剔除血糖未达标者。建模成功一周后,将糖尿病大鼠随机分为糖尿病脑病组(DM)和阿司匹林治疗组(DM+Asp),每组10只;正常大鼠随机分为正常对照组(Con)和阿司匹林对照组 (Con+Asp),每组10只。DM+Asp组、Con+Asp组给予阿司匹林10 mg/(kg·d)灌胃,Con组给以同等剂量生理盐水灌胃,持续14周。在实验过程中,每周检测各组大鼠体质量和血糖值。 1.3 Morris水迷宫实验
第14周时,采用Morris水迷宫观察大鼠认知功能变化。Morris水迷宫为一直径200 cm的圆形水池,内置有一可移动位置的圆形站台(直径15 cm),站台位于水下2 cm,水温恒定在(25±2)℃。 水迷宫实验一共6 d,第1天为水迷宫环境适应期。第2~5天为实验训练期,记录从放入点到站台所用的时间即逃避潜伏期,每次测试时间为120 s,若未找到站台将大鼠引至站台并使其停留10~15 s以记忆站台位置。第6天为空间搜索实验,撤离站台,每次测试时间为60 s,记录每只大鼠在站台所在位置的平台穿越次数及在目的象限内的徘徊时间。 1.4 心脏灌注及标本采集
水迷宫实验结束后,从每组随机抽取1只大鼠,用10%水合氯醛3 mL/kg腹腔注射进行麻醉,固定并剪开胸腔暴露心脏,分离心包膜后,灌注针插入左心室并固定,同时剪开右心房。先用生理盐水快速冲洗,再用4%多聚甲醛进行缓慢灌注。待大鼠体内充分固定后,剪开颅骨,将整个大脑完整移至4%多聚甲醛中浸泡3 d等待包埋用于H-E染色。其余的大鼠断头取脑,置于冰上快速分离出海马,放入冻存管储存在-120℃用于蛋白质印迹分析。 1.5 H-E染色
将石蜡包埋的组织以冠状位固定后行连续切片,将含有海马组织的切片粘贴到经3-氨丙基-3-甲氧基硅烷(APES)处理过的载玻片上并置于60~65℃烤箱中烤片30~60 min。切片脱蜡至水,苏木精溶液浸染,冲洗多余染液,而后用梯度乙醇脱水,最后封片。光学显微镜下观察大鼠海马组织CA1区神经元形态及其病理改变。 1.6 蛋白质印迹分析
选取β-actin作为内参蛋白,每组蛋白量50 μg,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SD-PAGE)分离后,电转至聚偏氟乙烯(PVDF)膜,用5%脱脂奶粉(脱脂奶粉溶于Tween-20-Tris-buffered saline,TTBS)进行封闭,再将PVDF膜孵育一抗(IGF-1R抗体1∶1 000、p-IGF-1R抗体1∶1 000、β-actin抗体1∶3 000)于4℃条件下过夜。第2天,经TTBS充分洗涤后,37℃条件下将PVDF膜置于相应的由辣根过氧化物酶标记的二抗稀释液中孵育2 h。洗膜后,曝光显影,使用Quantity One(Bio-Rad,Hercules,CA)软件进行分析统计。 1.7 统计学处理
所有数值采用SPSS 19.0(SPSS Inc.,Chicago,IL,USA)软件进行统计分析,数据用x±s形式表示,运用多因素及单因素方差分析比较组间差异。检验水准(α)为0.05。 2 结 果 2.1 各组大鼠的一般情况
糖尿病大鼠出现明显的多饮、多尿、多食症状,大鼠毛色灰黄,精神萎靡,鼠尾出现不同程度的溃烂以及断尾现象。实验2个月时,糖尿病大鼠因感染出现腹泻和皮下脓肿,经抗生素腹腔注射治疗后,感染症状得以控制。糖尿病大鼠行动迟缓,自主行动减少,出现易激惹或对外界刺激反应淡漠等行为表现。实验期间,糖尿病大鼠血糖值保持在(27±6) mmol/L,同时正常大鼠血糖值保持在(6±2) mmol/L。 2.2 水迷宫实验结果
大鼠血糖值持续升高3个月以后,在水迷宫实验训练期DM组逃避潜伏期较Con组、DM+Asp组明显增加(表 1,P<0.01或P<0.05);水迷宫正式实验期间,DM组平台穿越次数和在目的象限内的徘徊时间均较Con组、DM+Asp组减少(表 2,P<0.01或P<0.05)。
|
|
表 1 各组大鼠水迷宫实验逃避潜伏期的比较 Tab 1 Comparison of escape latencies in Morris water maze tests between different groups |
|
|
表 2 各组大鼠水迷宫空间搜索实验平台穿越次数和目的象限徘徊时间 Tab 2 Times of platform crossing and time spent in the target |
长期暴露于高血糖状态使大鼠海马组织CA1区神经元有了显著的病理学改变。H-E染色可见DM组大鼠海马CA1区神经元排列紊乱,数目减少,大量胶质细胞增生,凋亡神经元增多。Con组与Con+Asp组大鼠海马CA1区神经元排列整齐、紧密,胞体圆形。与DM组相比,DM+Asp组大鼠海马CA1区神经元排列稍整齐,胶质细胞数量增多,但仍少于正常对照组(图 1)。
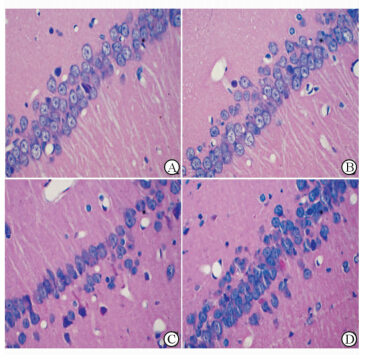 | 图 1 各组大鼠海马CA1区H-E染色 Fig 1 H-E staining of hippocampal CA1 region in each group A: Control group (Con); B: Control group treated with aspirin (Con + Asp); C: Diabetic group (DM); D: Diabetic group treated with aspirin (DM + Asp). Original magnification: ×400 |
实验结果(图 2)显示:各组间大鼠海马总的IGF-1R蛋白水平并未见明显差异。DM组p-IGF-1R蛋白水平与Con组相比明显减低(P<0.01);DM组p-IGF-1R蛋白水平低于DM+Asp组,且差异具有统计学意义(P<0.01)。
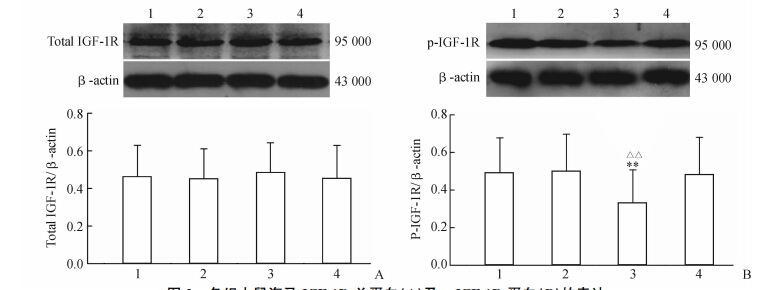 | 图 2 各组大鼠海马IGF-1R 总蛋白(A)及p-IGF-1R 蛋白(B)的表达 Fig 2 Protein expression levels of total IGF-1R (A) and p-IGF-1R (B) in the hippocampus 1: Control group (Con); 2: Control group treated with aspirin (Con+Asp); 3: Diabetic group (DM); 4: Diabetic group treated with aspirin (DM+Asp). IGF-1R: Insulin-like growth factor-1 receptor; p-IGF-1R: Phosphorylated insulin-like growth factor-1 receptor. **P<0.01 vs Con group; △△P<0.01 vs DM + Asp group,n=6,x±s |
糖尿病脑病是糖尿病的主要并发症之一,表现为轻、中度认知功能障碍和大脑神经生理及结构的改变,以获得性认知和行为缺陷为特征,在临床上表现为认知功能障碍、痴呆、精神性疾患等慢性脑病症状[8,9]。海马是大脑中记忆功能相关的重要核团,与认知功能密切相关,且海马CA1区是其主要功能区。研究证实,海马对高血糖反应敏感,在持续高血糖状态下,海马神经元数量减少,胞体形态异常,突触功能失常[5]。IGF-1广泛存在于脑组织中,特别是海马组织,在神经元生长、分化、能量代谢、神经保护等方面起重要作用[10,11]。IGF-1主要通过与特异性的靶细胞表面受体结合而发挥功能。IGF-1与IGF-1R的胞外域结合后引起跨膜β亚基结构的改变,β亚基内酪氨酸激酶被激活后产生自动磷酸化,或直接活化PI3K,或通过激活胰岛素受体底物(IRS),活化的IRS通过改变信号分子PI3K两个亚基的比例使之活化,从而激活Akt和ERK信号通路来调节大脑活动[12]。
阿司匹林是非类固醇类抗炎药,具有很多潜在的应用价值,它能选择性地使细胞内环氧化酶乙酰化,抑制环氧化酶的活性,从而影响下丘脑中强致热因子前列腺素的合成,发挥解热、镇痛、抗炎作用;小剂量阿司匹林具有抑制血小板聚集及血栓形成的作用,用于预防和治疗缺血性心脏病、心绞痛、心肺梗死、脑血栓形成[13]。研究发现,大脑内炎症加重了AD的不断恶化[14],而长期低剂量服用阿司匹林可使AD的发生率明显减少。近几年研究已经证实,糖尿病所引起的高糖状态以及胰岛素抵抗是AD发病的独立危险因素,因此,我们推测长期低剂量服用阿司匹林对糖尿病脑病的发生可能有预防作用。
本实验研究发现,糖尿病脑病组大鼠海马CA1区p-IGF-1R的表达较正常对照组减少,阿司匹林连续给药14周后观察到阿司匹林治疗组大鼠认知功能障碍得到明显改善,海马区神经细胞较糖尿病组增多,表明阿司匹林对糖尿病大鼠有大脑保护作用;同时发现,各组大鼠海马 CA1区总的IGF-1R蛋白表达量未见变化,而阿斯匹林治疗组p-IGF-1R的蛋白表达量高于糖尿病组,表明阿司匹林对大脑的保护作用可能是通过增加IGF-1R磷酸化来调控IGF-1R及其下游信号通路来实现的。
综上所述,本实验中糖尿病脑病大鼠出现认知功能障碍,可能是长期高血糖状态使其p-IGF-1R表达量降低导致了IGF-1R信号通路障碍,继而下调了IGF-1R及其下游信号通路,最终导致神经元凋亡;给予阿司匹林治疗后,大鼠海马p-IGF-1R表达增加,推测阿司匹林可能通过调控IGF-1R及其下游信号通路来改善糖尿病脑病大鼠认知功能障碍,但其具体机制有待于进一步研究证实。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Liu Y W, Zhu X, Zhang L, Lu Q, Zhang F, Guo H, et al. Cerebroprotective effects of ibuprofen on diabetic encephalopathy in rats[J].Pharmacol Biochem Behav, 2014, 117:128-136. |
| [2] | Liu J P, Feng L, Zhang M H, Ma D Y, Wang S Y, Gu J, et al.Neuroprotective effect of Liuwei Dihuang decoction on cognition deficits of diabetic encephalopathy in streptozotocin-induced diabetic rat[J].J Ethnopharmacol, 2013, 150:371-381. |
| [3] | Zhou Y, Luo Y, Dai J.Axonal anound prd dendritic changes are associated with diabetic encephalopathy in rats:an important risk factor for Alzheimer's disease[J].J Alzheimers Dis, 2013, 34:937-947. |
| [4] | Medeiros R, Kitazawa M, Passos G F, Baglietto-Vargas D, Cheng D, Cribbs D H, et al. Aspirin-triggered lipoxin A4 stimulates alternative activation of microglia and reduces Alzheimer disease-like pathology in mice[J].Am J Pathol, 2013, 182:1780-1789. |
| [5] | Ma L, Wei Q, Deng H, Zhang Q, Li G, Tang N, et al. Growth factor receptor-bound protein 10-mediated negative regulation of the insulin-like growth factor-1 receptor-activated signaling pathway results in cognitive disorder in diabetic rats[J].J Neuroendocrinol, 2013, 25:626-634. |
| [6] | Hoffman W H, Andjelkovic A V, Zhang W, Passmore G G, Sima A A.Insulin and IGF-1 receptors, nitrotyrosin and cerebral neuronal deficits in two young patients with diabetic ketoacidosis and fatal brain edema[J].Brain Res, 2010, 1343:168-177. |
| [7] | Isik A T, Celik T, Ulusoy G, Ongoru O, Elibol B, Doruk H, et al. Curcumin ameliorates impaired insulin/IGF signalling and memory deficit in a streptozotocin-treated rat model[J].Age(Dordr), 2009, 31:39-49. |
| [8] | Xue H Y, Lu Y N, Fang X M, Xu Y P, Gao G Z, Jin L J. Neuroprotective properties of aucubin in diabetic rats and diabetic encephalopathy rats[J].Mol Biol Rep, 2012, 39:9311-9318. |
| [9] | Liapi C, Kyriakaki A, Zarros A, Galanopoulou P, Al-Humadi H, Dontas I, et al. Choline-deprivation alters crucial brain enzyme activities in a rat model of diabetic encephalopathy[J].Metab Brain Dis, 2010, 25:269-276. |
| [10] | Westwood A J, Beiser A, Decarli C, Harris T B, Chen T C, He X M, et al. Insulin-like growth factor-1 and risk of Alzheimer dementia and brain atrophy[J].Neurology, 2014, 82:1613-1619. |
| [11] | Serbedzija P, Madl J E, Ishii D N. Insulin and IGF-I prevent brain atrophy and DNA loss in diabetes[J].Brain Res, 2009, 1303:179-194. |
| [12] | Chen C, Xu Y, Song Y. IGF-1 gene-modified muscle-derived stem cells are resistant to oxidative stress via enhanced activation of IGF-1R/PI3K/AKT signaling and secretion of VEGF[J]. Mol Cell Biochem, 2014, 386:167-175. |
| [13] | 刘 杰.阿司匹林药理作用的研究新进展[J].中国中医药现代远程教育, 2009, 7:86-87. |
| [14] | Arvanitakis Z, Grodstein F, Bienias J L, Schneider J A, Wilson R S, Kelly J F, et al.Relation of NSAIDs to incident AD, change in cognitive function, and AD pathology[J].Neurology, 2008, 70:2219-2225. |
 2015, Vol. 36
2015, Vol. 36


