2. 解放军94医院普通外科, 南昌 330002
2. Department of General Surgery, No. 94 Hospital of the PLA, Nanchang 330002, Jiangxi, China
从17世纪学者们就开始研究失血性休克的复苏救治,各种药物和治疗理念的提高使失血性休克的救治得到了长足的进步,但对于一些失血量大、低血压时间长的严重失血性休克,即使采取目前各种抗休克治疗措施,仍有极高的死亡率[1]。现有抗休克手段对重症休克的治疗效果欠佳说明休克病理生理过程中还有许多尚未被阐明的机制。现代科技的进步,尤其是分子生物学的进步,使得研究人员可以通过对基因的了解来探究重症失血性休克的更深层次的背景,也为分子生物治疗重症失血性休克提供了可能。本实验小组前期对重症失血性休克大鼠肝脏中差异基因背景进行分析,发现经历同样条件的重症失血性休克后,存活与死亡的大鼠肝脏中含铜胺氧化酶3[amineoxidase(coppercontaining)-3,AOC3]基因水平差异明显[2],对存活组大鼠失血性休克前后进行比较,发现AOC3基因仍是众多差异基因之一[3]。血管黏附蛋白1(vascularadhesionprotein-1,VAP-1)是AOC3基因的编码蛋白,属于氨基脲敏感性胺氧化酶(semicarbazide-sensitiveamineoxidases,SSAO)[4]。 许多研究已证明,使用抗VAP-1单克隆抗体或小分子VAP-1/SSAO抑制剂均能在炎症条件下抑制白细胞黏附至血管内皮细胞上并减少其滚动、迁移和渗出[5,6,7]。此外众多研究显示VAP-1在糖代谢调节[8]、血管损伤[9]等多方面发挥重要作用,但VAP-1与失血性休克之间的关系尚未见报道。本研究在前期研究的基础上进一步深入探讨,以明确VAP-1与重症失血性休克间的关系。 1 材料和方法 1.1 实验动物
健康6~8周龄Sprague-Dawley(SD)雄性大鼠50只购自第二军医大学实验动物中心,生产许可证号:SCXK(沪)2008-0016,所有大鼠分笼饲养于SPF级动物房的层流架上,室温(25±1)℃,湿度(55±1)%,按自然昼夜节律(12h∶12h)适应性饲养1周以上,待体质量达到300~350g后准备实验。实验前12h禁食,自由饮水。 1.2 动物模型制备
建立重症失血性休克及复苏动物模型(改良Wiggers模型)。50只大鼠随机分为假手术组(Sham)、休克组(HS)、休克复苏组(HSR)、复苏对照组(NS)和复苏实验组(BEA),每组10只。大鼠称量后以3%戊巴比妥钠溶液50mg/kg腹腔注射给药麻醉,使用动物恒温系统(ALC-HTP201型,上海奥尔科特公司)保持整个实验过程大鼠肛温恒定37℃。大鼠右侧颈动脉置管,连接多道生物信号分析系统(MPA2000型,上海奥尔科特公司)监测并记录动脉血压变化。大鼠左侧股动脉置管连接微量注射泵(ALC-IP900型,上海奥尔科特公司)用于匀速放血,左侧股静脉置管用于复苏时微量注射泵匀速补液。
Sham组在插管完成后,直接进行标本采集并处死大鼠。其余4组大鼠通过左侧股动脉以2.0mL/(kg·min)速率匀速放血,监测平均动脉压(meanarterialpressure,MAP)变化并使之维持在35~45mmHg(1mmHg=0.133kPa)以制造定压失血性休克1h。HS组失血性休克1h后进行标本采集、处死大鼠,HSR组通过左侧股静脉以2.0 mL/(kg·min)速率匀速补液(1/2总失血量的全血+ 3/2总失血量的乳酸林格液)复苏,NS组、BEA组在上述液体复苏的基础上分别加入1mL/kg生理盐水或20mg/kg2-溴乙胺(B65705,ALDRICH)。液体复苏1h后HSR组进行标本采集、处死大鼠,NS组和BEA组大鼠复苏完成后,结扎、拔除各血管插管,缝合切口,将大鼠放入观察笼,正常进食进水,监测大鼠术后生存情况,术后24h对存活大鼠进行麻醉及左侧颈动脉插管,监测并记录动脉血压变化,标本采集后处死。 1.3 标本采集
大鼠腹部常规消毒铺单后开腹,距屈氏韧带约5cm处剪取长约8cm空肠,同时通过股动脉快速抽血约3~4mL。用生理盐水清洗干净小肠组织,剪成两半,一半置于4%甲醛溶液中固定,另一半切成约0.8cm长的小块,PBS液漂洗3次后装入冻存管,再置入液氮罐中保存。抽取的血液标本立即离心(100×g,15min),提取上清液后装入冻存管,再置入液氮罐中保存。 1.4 Real-timeRT-PCR检测大鼠小肠组织中AOC3mRNA表达
小肠组织使用TRIzol试剂提取总RNA,-80℃冻存备用。AOC3正向引物(5′-3′):GCTCCGGCGACACCACTCAG,反向引物:CGCCAGCACCGAAGAAGAAAG,PCR产物长度为197bp。β-actin正向引物(5′-3′):CCTAAGGCCAACCGTGAAAAGATG,反向引物:GTCCCGGCCAGCCAGGTCCAG,PCR产物长度为219bp。取2μgRNA反转录合成cDNA。反应体系10μL,反应条件为95℃10s,58℃20s,72℃20s,共40个循环。以β-actin为内参,采用2ΔCt法计算AOC3mRNA相对表达强度。 1.5 蛋白质印迹法检测大鼠小肠组织中VAP-1蛋白表达
取小肠组织样本,加入T-PER试剂(Pierce),匀浆、离心收集上清液进行总蛋白浓度检测。使用BCA蛋白定量试剂盒(Pierce)对总蛋白进行定量。进行SDS-PAGE电泳,PVDF转膜、封闭、冲洗后,加入VAP-1一抗(Abcam),4℃过夜,洗膜后加入二抗,室温中反应1h。暗室中曝光检测化学发光试剂。对电泳胶片进行灰度扫描,各组VAP-1蛋白的相对蛋白浓度为VAP-1蛋白与标准品蛋白GAPDH的灰度扫描比值。 1.6 ELISA法检测大鼠血清VAP-1蛋白含量及VAP-1/SSAO活性
按照ELISA试剂盒(UscnLifeScience,E92298Ra)说明书步骤进行操作,测量各孔在450nm波长处的光密度(D值),用VAP-1蛋白标准品的浓度与D值画出标准曲线,计算得出样品的实际浓度。
反应前20min,血清样本加入终浓度为0.1mmol/L氯吉灵(SantaCruz)以清除干扰酶。按照ELISA试剂盒说明书步骤进行操作,紫外荧光分光光度计检测各样本荧光值,其中激发波长为530nm,吸收波长为590nm。采用标准品活性(mU/mL)和荧光检测值(RFU)制作标准曲线以计算大鼠血清VAP-1/SSAO活性。 1.7 免疫组化检测大鼠小肠组织中VAP-1蛋白的表达
取经4%甲醛固定后石蜡包埋好的小肠标本,用组织切片机连续切片,采用免疫组织化学链菌素-生物素标记(labelledstreptavidin-biotin,LSAB)法进行免疫组化检测。使用通用型SP试剂盒(SP-9000,北京中杉金桥生物技术有限公司),按照说明书进行操作,行常规免疫组化染色、光镜下控制显色,脱水透明,封片。 1.8 TUNEL法检测大鼠小肠组织腺泡细胞凋亡
固 定、包埋、切片等同前,二甲苯脱蜡,依次置入梯度乙醇水化,4%多聚甲醛固定,每片加入20μg/mL蛋白酶K100μL进行通透处理,平衡液湿盒平衡。制备TUNEL反应混合液:处理组用1μLTDT+1μL生物素标记的dUTP+98μL平衡液混匀;阴性对照组不加TDT,而加三蒸水;阳性对照组则加100μLDNA酶1缓冲液孵育5min,甩去液体,再加100μLDNA酶1(10U/mL)酶切10min,去离子水洗涤4次,放入PBS浸洗5min。标本上加100μLTUNEL反应混合液,加盖玻片,在37℃暗湿盒中反应1h。终止反应后封闭过氧化物酶,加100μL抗生物素蛋白链霉素标记的HRP(1∶500PBS稀释)30min行酶标反应。常规DAB显色,苏木精复染,梯度乙醇脱水、二甲苯透明1min×2次、中性树胶封片,显微镜观察。
奥林巴斯数码倒置显微镜(CKX41)观察H-E染色及TUNEL切片并拍照。以Chiu’s评分法[5]评价肠黏膜损伤程度,评分越高表明小肠损伤越严重,每张切片随机选取5个视野进行评分。小肠黏膜上皮细胞凋亡指数的计算:细胞核中有棕黄色颗粒者为阳性细胞,每张切片选取5个阳性细胞数最多的高倍视野(×400)进行拍照,使用Image-ProPlus软件计算视野中腺泡细胞中阳性细胞所占的百分比。各组间Chiu’s评分或凋亡指数的比较均以各组数值与Sham组平均值的比值进行比较。 1.9 统计学处理
采用SPSS17.0软件进行统计分析,数据以x±s表示,组间差异的比较采用单因素方差 分析,两两比较采用LSD检验(方差齐时)或Dunnett’s T3检验(方差不齐时)。检验水准(α)为0.05。 2 结 果 2.1 各组大鼠基线资料的比较
各组大鼠间体质量、术前MAP和总失血量的差异无统计学意义,具体见表 1,说明本研究具有可比性。
|
|
表 1 各组大鼠体质量、术前MAP和失血总量的比较 Tab 1 Comparisonofbodymass,pre-shockMAPandtotallossofbloodinratsofeachgroup |
Real-timeRT-PCR、蛋白质印迹和ELISA结果显示Sham组、HS组和HSR组间小肠组织AOC3mRNA、VAP-1蛋白表达以及血清VAP-1蛋白表达、VAP-1/SSAO酶活性比较差异均有统计学意义(P<0.01),上述4项指标在HS组和HSR组均高于Sham组(P<0.05),HSR组大鼠小肠组织AOC3mRNA表达、血清VAP-1/SSAO酶活性低于HS组(P<0.05)。见图 1、图 2。免疫组化结果显示VAP-1蛋白主要表达于小肠微血管内皮细胞的胞质中,HS组、HSR组中的阳性染色细胞比例明显多于Sham组(图 3)。
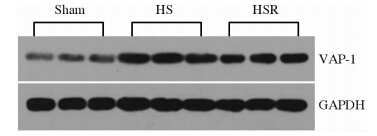 | 图 1 大鼠小肠组织VAP-1蛋白表达(蛋白质印迹结果) Fig 1 Western blotting analysis of VAP-1 protein expression in rat small intestinal tissues HS:Hemorrhagic shock;HSR:Shock resuscitation |
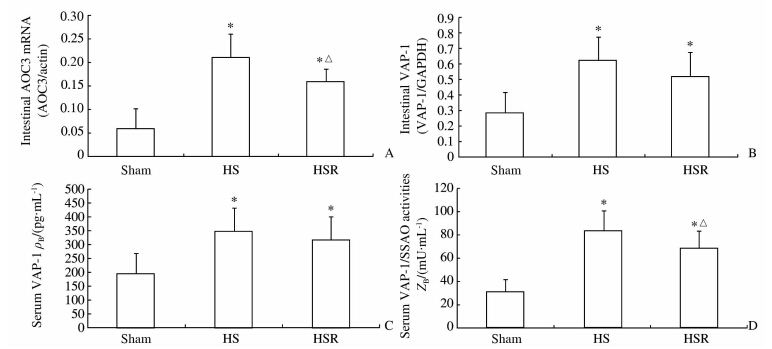 | 图 2 各组大鼠小肠组织AOC3mRNA、VAP-1蛋白表达和血清中VAP-1蛋白表达、活性的比较 Fig 2 Comparison of AOC3 mRNA and VAP-1 protein in small intestine tissues,serum VAP-1 level and activity in rats of different groups HS:Hemorrhagicshock;HSR:Shockresuscitation.*P<0.05vsShamgroup;△P<0.05vsHSgroup.n=10,x±s |
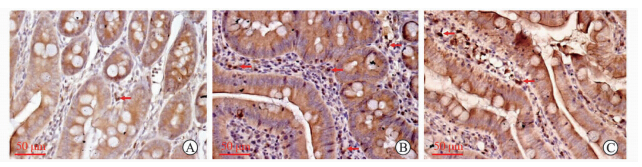 | 图 3 大鼠小肠组织中VAP-1蛋白免疫组化染色结果 Fig 3 Immunohistochemical staining of VAP-1 protein in rats small intestinal tissues A:Sham group; B:Hemorrhagic shock; C:Shock resuscitation. Red arrows show immunohistochemical positive cells. Original magnification:×400 |
BEA组复苏后24h大鼠生存率为90%,高于NS组(24h生存率为60%)。在复苏后1、24hBEA组MAP均高于NS组(P值分别为0.010和0.039,图 4)。
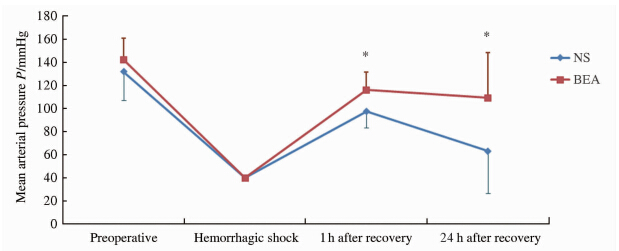 | 图 4 NS组和BEA组大鼠在不同时间点MAP的比较 Fig 4 Comparison of mean arterial pressure between the NS group and BEA group at different time points NS:Controlrecovery;BEA:Experimentalrecovery.*P<0.05vsNSgroup.n=10,x±s |
Sham组、NS组和BEA组大鼠标本病理切片的H-E染色及TUNEL检测见图 5、图 6。图 5显示,sham组基本为正常的小肠黏膜组织;BEA组可见小肠绒毛轻度水肿,有少量肠黏膜上皮细胞脱落,绒毛上皮下间隙扩大,Gruenhagen’s间隙形成,毛细血管充血;NS组则上述损伤更加严重,已有绒毛上皮成块脱落。图 6显示,Sham组小肠黏膜中偶尔可见散在分布的凋亡细胞;BEA组小肠黏膜中凋亡细胞较Sham组增多,但仍以小肠黏膜中散在分布为主;NS组小肠黏膜中凋亡细胞明显增多,肠绒毛各部分都可见凋亡细胞,部分成团出现。三组大鼠Chiu’s评分、小肠黏膜上皮细胞凋亡指数间差异均有统计学意义(均P<0.05,图 7)。
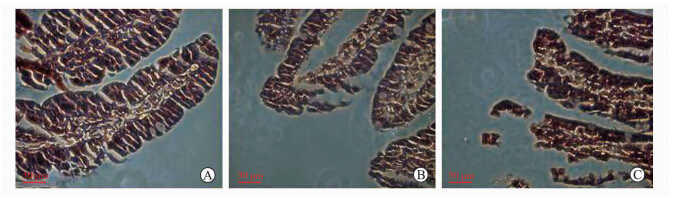 | 图 5 各组大鼠小肠黏膜光镜下形态学的变化 Fig 5 Morphological changes of small intestinal mucosa under light microscope in each group A:Sham group; B:Experimental recovery; C:Control recovery. H-E staining. Original magnification:×400 |
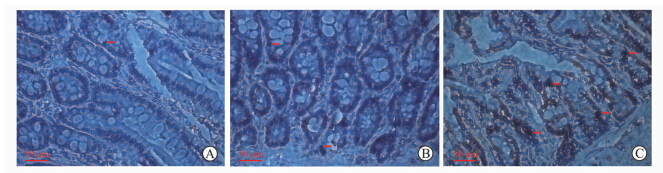 | 图 6 光镜下各组大鼠小肠黏膜上皮细胞凋亡情况 Fig 6 Apoptosis of small intestinal mucosa epithelial cells under light microscope in rats of each group A:Sham group; B:Experimental recovery; C:Control recovery. Red arrows show apoptotic cells (nuclei stained brown) . H-E staining. Original magnification:×400 |
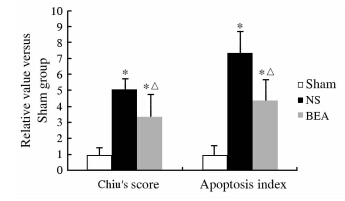 | 图 7 各组大鼠小肠黏膜组织Chiu’s评分及小肠黏膜上皮细胞凋亡指数的比较 Fig 7 Comparison of the Chiu’s score and apoptosis indices of the small intestinal mucosa in rats of each group NS:Control recovery;BEA:Experimental recovery*P<0.05 vs Sham group;△P<0.05 vs Sham group.n=10, x±s |
重症失血性休克又被称为低血容量性循环衰竭,此概念最早由Wiggers等[6]提出并建立了两阶段放血导致不可逆性休克的经典动物模型,如今各种改良Wiggers动物模型仍是研究休克最常用的实验手段[7]。本研究建立了稳定的重症失血性休克及复苏的大鼠模型:采用股动脉间断匀速放血[2.0mL/(kg·min)]维持大鼠休克血压(MAP为35~45mmHg)1h,休克后以同样速度匀速补血补液(1/2总失血量的全血+3/2总失血量的乳酸林格液)复苏。实验中我们观察到,35~45mmHg的休克血压是大多数大鼠能自主维持的最低休克血压,低于此血压时很容易出现血压持续下降状况,导致大鼠等不到液体复苏而迅速死亡,这与Rönn等[8]的研究结果一致。本研究还发现1h的休克时间是该休克血压下大部分大鼠能自主维持的最长时间。Li等[9]发现50~60mmHg的休克血压及90min的低血压时间是大鼠的耐受极限,若要延长休克时间,只能选择提高实验中设定的休克血压。
本研究选择同样体质量范围的大鼠禁食后进行实验,方差分析显示术前各组大鼠体质量间差异无统计学意义,但P值为0.054,NS组大鼠平均体质量最低,HSR组最高,但这两组间并无直接数据比较,进一步进行两两比较显示,NS组与BEA组、Sham组间差异均无统计学意义(P值分别为0.733和0.131),而HSR组与HS组、Sham组间也无差异(P值分别为0.435和0.245),表明各组大鼠体质量间的差异对实验并无影响。
本研究测定了Sham组(正常对照)、HS组(休克1h后)、HSR组(复苏1h后)小肠组织AOC3mRNA含量以及VAP-1蛋白含量,以及血清中sVAP-1的水平及VAP-1/SSAO酶活性,结果显示休克时AOC3基因及其编码蛋白VAP-1的水平和功能均较休克前升高,复苏后该水平有所回落,但不能恢复至正常,表明重症失血性休克能使VAP-1的表达、酶活性增高,而液体复苏能减轻这种增高。这与Sallisalmi等[16]在感染性休克患者中观察到的血清SSAO酶活性较健康对照者升高是一致的。
VAP-1主要表达于心、肺、肝、肾、肠等器官、组织的内皮细胞,脂肪细胞、平滑肌细胞中也有丰富的表达[17]。在人、猪、狗、小鼠等动物的小肠组织中均检测到了VAP-1的表达,其主要分布于小肠高内皮微静脉、固有层血管内皮细胞和平滑肌细胞的细胞表面,但在肠上皮细胞、杯状细胞中未见表达[17],这与本研究中大鼠小肠组织免疫组化检测结果一致。
重症失血性休克的基本病理生理特点是:微循环持续低灌流和顽固性低血压[18]。目前认为微循环低灌流的主要原因是白细胞黏附至微静脉壁、堵塞毛细血管以及白细胞与内皮细胞之间的高黏附力所引起[18],顽固性低血压则与血管功能受损、血管反应性下降有关[19],而VAP-1在白细胞-内皮细胞黏附和血管损伤这两方面均发挥了重要作用。因而通过抑制VAP-1/SSAO活性有可能改善重症失血性休克。2-溴乙胺是SSAO高选择性强效抑制剂,体内外实验均表明低剂量2-溴乙胺能显著抑制SSAO活性[20,21]。本研究结果发现,2-溴乙胺复苏组Chiu’s评分及小肠黏膜上皮细胞凋亡指数都低于生理盐水复苏组,表明抑制VAP-1/SSAO活性能改善重症失血性休克复苏后小肠组织的受损。而肠黏膜屏障障碍对重症休克的发展、转归非常重要[22],这也和本研究中休克复苏后24h大鼠生存率结果一致:相较于生理盐水复苏后24h60%的生存率,使用VAP-1/SSAO抑制剂——2-溴乙胺后,重症失血性休克大鼠的24h生存率为90%。以上结果均提示抑制VAP-1/SSAO活性有可能成为辅助治疗重症失血性休克的一个有效手段。 4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Angele M K, Schneider C P, Chaudry I H. Bench-to-bedside review: latest results in hemorrhagic shock[J]. Crit Care, 2008, 12:218. |
| [2] | Xiaojun Y, Cheng Q, Yuxing Z, Zhiqian H. Microarray analysis of differentially expressed background genes in rats following hemorrhagic shock[J]. Mol Biol Rep, 2012, 39:2045-2053. |
| [3] | Wang Y, Song J, Zhang J, Qian C, Yi W, Chen Q, et al. Microarray analysis of liver gene expression before and after induced hemorrhagic shock in a rat model[J]. J Surg Res, 2013, 185:373-379. |
| [4] | Smith D J, Salmi M, Bono P, Hellman J, Leu T, Jalkanen S. Cloning of vascular adhesion protein 1 reveals a novel multifunctional adhesion molecule[J]. J Exp Med, 1998, 188:17-27. |
| [5] | Chiu C J, McArdle A H, Brown R, Scott H J, Gurd F N. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970, 101:478-483. |
| [6] | Wiggers H C, Ingraham R C. Hemorrhagic shock; definition and criteria for its diagnosis[J]. J Clin Invest, 1946, 25:30-36. |
| [7] | Moochhala S, Wu J, Lu J. Hemorrhagic shock: an overview of animal models[J]. Front Biosci (Landmark Ed), 2009, 14:4631-4639. |
| [8] | Rönn T, Lendemans S, de Groot H, Petrat F. A new model of severe hemorrhagic shock in rats[J]. Comp Med, 2011, 61:419-426. |
| [9] | Li T, Zhu Y, Hu Y, Li L, Diao Y, Tang J, et al. Ideal permissive hypotension to resuscitate uncontrolled hemorrhagic shock and the tolerance time in rats[J]. Anesthesiology, 2011, 114:111-119. |
| [10] | Ochiai Y, Itoh K, Sakurai E, Tanaka Y. Molecular cloning and characterization of rat semicarbazide-sensitive amine oxidase[J]. Biol Pharm Bull, 2005, 28:413-418. |
| [11] | Koskinen K, Vainio P J, Smith D J, Pihlavisto M, Ylä-Herttuala S, Jalkanen S, et al. Granulocyte transmigration through the endothelium is regulated by the oxidase activity of vascular adhesion protein-1 (VAP-1)[J]. Blood, 2004, 103:3388-3395. |
| [12] | Salmi M, Yegutkin G G, Lehvonen R, Koskinen K, Salminen T, Jalkanen S. A cell surface amine oxidase directly controls lymphocyte migration[J]. Immunity, 2001, 14:265-276. |
| [13] | Lalor P F, Edwards S, McNab G, Salmi M, Jalkanen S, Adams D H. Vascular adhesion protein-1 mediates adhesion and transmigration of lymphocytes on human hepatic endothelial cells[J]. J Immunol, 2002, 169:983-992. |
| [14] | Iglesias-Osma M C, Garcia-Barrado M J, Visentin V, Pastor-Mansilla M F, Bour S, Prévot D, et al. Benzylamine exhibits insulin-like effects on glucose disposal, glucose transport, and fat cell lipolysis in rabbits and diabetic mice[J]. J Pharmacol Exp Ther, 2004, 309:1020-1028. |
| [15] | Salmi M, Stolen C, Jousilahti P, Yegutkin G G, Tapanainen P, Janatuinen T, et al. Insulin-regulated increase of soluble vascular adhesion protein-1 in diabetes[J]. Am J Pathol, 2002, 161:2255-2262. |
| [16] | Sallisalmi M, Tenhunen J, Yang R, Oksala N, Pettilä V. Vascular adhesion protein-1 and syndecan-1 in septic shock[J]. Acta Anaesthesiol Scand, 2012, 56:316-322. |
| [17] | Jaakkola K, Nikula T, Holopainen R, Vähäsilta T, Matikainen M T, Laukkanen M L, et al. In vivo detection of vascular adhesion protein-1 in experimental inflammation[J]. Am J Pathol, 2000, 157:463-471. |
| [18] | Zhao K S. Hemorheologic events in severe shock[J]. Biorheology, 2005, 42:463-477. |
| [19] | Zhao K S, Liu J, Yang G Y, Jin C, Huang Q, Huang X. Peroxynitrite leads to arteriolar smooth muscle cell membrane hyperpolarization and low vasoreactivity in severe shock[J]. Clin Hemorheol Microcirc, 2000, 23(2-4):259-267. |
| [20] | Kinemuchi H, Kobayashi N, Takahashi K, Takayanagi K, Arai Y, Tadano T, et al. Inhibition of tissue-bound semicarbazide-sensitive amine oxidase by two haloamines, 2-bromoethylamine and 3-bromopropylamine[J]. Arch Biochem Biophys, 2001, 385:154-161. |
| [21] | Yu P H, Davis B A, Deng Y. 2-Bromoethylamine as a potent selective suicide inhibitor for semicarbazide-sensitive amine oxidase[J]. Biochem Pharmacol, 2001, 61:741-748. |
| [22] | Hierholzer C, Billiar T R. Molecular mechanisms in the early phase of hemorrhagic shock[J]. Langenbecks Arch Surg, 2001, 386:302-308. |
 2015, Vol. 36
2015, Vol. 36


