2. 解放军153中心医院泌尿外科, 郑州 450042;
3. 第二军医大学长征医院泌尿外科, 上海 200003
2. Department of Urology, No. 153 Hospital of Chinese People's Liberation Army, Zhengzhou 450042, Henan, China;
3. Department of Urology, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
Co-first author.
保留肾单位手术已替代根治性肾切除术,成为当前治疗早期肾肿瘤的首选术式[1]。在传统的腹腔镜保留肾单位手术中,为减少术中出血、降低操作难度,通常把暂时性阻断肾动脉主干血流作为该术式的标准步骤[2]。但是,这种粗放的肾脏血流阻断方式在阻断肿瘤供血的同时,也同期切断了肿瘤区外残留肾单位的血液供应,在恢复肾脏血流后势必会导致健康肾组织的缺血/再灌注损伤[3]。因此,如何将缺血区严格限制于肿瘤所在部位,实现术中肿瘤以外区域残留肾组织的“零缺血”,成为腹腔镜下保留肾单位手术中亟待解决的问题。长海医院泌尿外科自2013年6月至2014年5月采用超选择肾动脉分支阻断技术,术中仅阻断向肿瘤特异供血的肾段动脉以下分支血管,顺利完成腹腔镜下肾部分切除术10例,现报告如下。 1 资料和方法 1.1 一般资料
回顾长海医院泌尿外科2013年6月至2014年5月间因肾恶性肿瘤入院并接受经腹腹腔镜肾部分切除术治疗患者的临床资料,选取术中采用超选择肾动脉分支阻断技术者(分支阻断组)和肾动脉主干阻断者(主干阻断组)为研究对象,两组均由同一术者完成。比较不同肾动脉阻断方法对手术时间、术中出血量及术后肾功能等临床参数的影响。排除单侧多发性肾肿瘤、对侧肾脏并存其他病变、有慢性肾病等影响肾功能的基础性疾病、术中采用低温肾脏缺血以及临床资料缺失无法满足研究要求的患者。共有23例患者纳入本研究,其中分支阻断组10例(男性7例,女性3例),主干阻断组13例(男性11例,女性2例)。
患者术前常规行肾脏动脉CT增强造影(图 1A)及三维血管重建(图 1B)了解患肾动脉走行和变异情况,确定向肿瘤特异供血的肾动脉分支及其与上、下级血管的相对位置关系。肾肿瘤解剖特征按照PADUA评分系统进行描述和评估[4]。术前及术后肾功能状态采用肾小球滤过率(eGFR)评价,eGFR数值按照CKD-EPI公式(2009)计算[5]。本研究经第二军医大学长海医院医学伦理委员会批准后实施,所有患者术前均详细告知手术风险并签署手术知情同意书,经患者同意后实施手术。 1.2 手术方法
患者均采取全身麻醉,完全健侧卧位,腰部抬高,头部及下肢放低,取脐上两横指与患肾侧腹直肌外侧缘交点为切口,Hasson法建立气腹并置入12 mm Trocar及30°腹腔镜,气腹压力维持在12~14 mmHg (1 mmHg=0.133 kPa),腹腔镜直视下分别于同侧锁骨中线与肋缘下5 cm及髂前 上棘上4 cm交点切口,置入12 mm(惯用手侧)和5 mm Trocar以及腹腔镜器械,根据手术需要建立辅助孔。沿Toldt线打开结肠旁沟,于肾脂肪囊外将结肠推向内侧直至肾内侧缘完全显露,充分暴露肾蒂,主干阻断组仅游离肾动脉主干,分支阻断组在此基础上向肾动脉远心端游离至向肿瘤区供血的2~3级肾动脉分支(图 1C~图 1F),待阻断的肾动脉主干或分支用丝线圈套标记。剔除肾肿瘤及其周边正常肾组织表面的脂肪,阻断肾动脉主干(主干阻断组)或动脉分支(分支阻断组),距肿瘤边界约0.2~0.5 cm切除肿瘤,3-0微乔线“8”字缝合肾创面血管和集合系统残端,2-0微乔线距创缘0.3 cm以缘对缘连续缝合的方式关闭肾脏创面,肾表面各出针处分别用可吸收hem-o-lok夹加压固定。恢复阻断血管血流,记录阻断时间,确认术区无活动性出血后,将肿瘤标本置入取物袋取出,结肠旁沟置引流管1根,逐层关闭各手术切口。
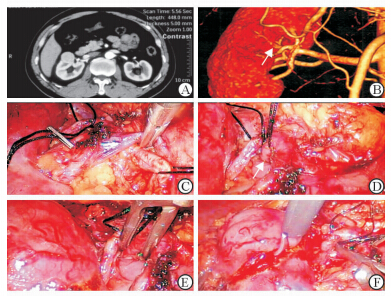 | 图 1 肾动脉的CT重建与超选择阻断 Fig 1 CT imaging reconstruction of renal arteries and selective clamping of the targeted artery supplying tumor A:Enhanced CT of the kidney,the arterial phase;B:Three dimensional CT imaging reconstruction of renal arteries;C:Mobilizing the targeted renal arterial branch from the proximal end to the distal end along the vascular;D:Marking the targeted renal arterial branch with suture loop;E:Clamping the targeted renal arterial branch;F:Removing the hilar tumor by the selective artery clamping method(Note:the arrow shows the renal vascular,which is the grade 3 renal arterial branch supplying the tumor) |
采用SPSS 20.0软件包(Statistical Package for the Social Sciences,IBM公司)进行分析,计量资料均值以 x±s 表示,采用两独立样本t检验比较组间差异,检验水准(α)为0.05。
2 结 果 2.1 基线资料对比
两组患者的年龄、肿瘤直径、肿瘤解剖特征PADUA评分、术前麻醉学ASA评分以及术前eGFR水平差异无统计学意义,分支阻断组体质指数(BMI)略低于主干阻断组(P=0.03,表 1)。 2.2 手术相关参数对比
结果(表 1)表明:与肾动脉主干阻断术相比,采用超选择分支阻断术者手术时间延长[(257.60 ± 22.03) min vs (199.08 ± 36.70) min,P<0.05]、术中出血量明显增多[(220.00 ± 57.01) mL vs (71.54 ± 30.51) mL,P<0.05]、术后3 d术区切口平均引流量增加[(113.33 ± 24.82) mL vs (68.08 ± 28.88) mL,P<0.05],但无患者因此出现血流动力学指标异常,分支阻断组1例患者因术前贫血于术中输血200 mL,两组患者术后均未出现尿漏、严重出血等Ⅱ级以上手术并发症。 2.3 肾功能保护效果对比
结果(表 1)表明:在血管阻断时间相当的条件下[(28.60 ± 8.17)min vs (27.85 ± 6.16) min],动脉分支阻断对肾功能的损害小于传统主干阻断法,分支阻断组术后3 d内平均eGFR下降程度明显低于后者[(3.14 ± 7.22)% vs (15.26 ± 9.53)%,P<0.05],两组术后3个月 eGFR下降程度差异无统计学意义[(4.92 ± 7.48)% vs (9.10 ± 13.68)%,P=0.53]。
|
|
表 1 腹腔镜肾部分切除术中两种肾动脉阻断方式临床参数的比较 Tab 1 Clinical parameter comparison between the two groups with different renal artery clamping methods for laparoscopic partial nephrectomy |
影响肾部分切除术后肾功能恢复的独立因素主要包括患者术前基础肾功能、手术保留健康肾单位的体积以及术中患肾缺血时间,其中缺血时间受医生手术操作的影响最大,也最有可能通过技术手段革新而被缩短。以往观点认为:肾脏对缺血具备一定的耐受能力,只要能在20~30 min的安全时限内恢复肾脏血液灌流,短时的缺血不会对肾脏造成不可逆的缺血/再灌注损伤。因此,在切除肿瘤和重建肾脏过程中短时阻断全肾血流被认为是安全的,且通常是保留肾单位手术的标准步骤[2]。然而,上述观点近年来不断受到质疑。Thompson等[6]对362例术中实施全肾血流阻断的孤立肾肾部分切除术患者的术后肾功能进行回顾分析发现,虽然以热缺血时间25 min为限对患者进行分类能够较好地预测其术后出现肾功能不全的几率,但如果将热缺血时间作为连续性变量考察,则缺血时间每增加1 min患者术后出现急性肾功能不全或最终进展为肾功能不全Ⅳ期的风险分别增加5%和6%。而且,针对具体患者讨论肾缺血安全时限似乎缺乏意义,因为肾脏对缺血的耐受力受患者年龄、基础肾功能以及并存疾病等诸多因素的影响,医生无法明确某个个体的肾缺血安全时限用以指导手术操作。尽管在肾部分切除术中阻断全肾血流有利于保持相对清晰的手术视野、降低操作难度、减少患者术中出血量,但如果单从保护患肾功能的角度考虑,唯有无限制地缩短肾脏缺血时间甚至不使肾脏缺血才是最合理的处理方式。
2003年,Guillonneau等[7]率先报道在无肾动脉血流阻断条件下完成12例腹腔镜肾部分切除术,初步证实了经腹腔镜保留肾单位手术中实现肾脏“零缺血”的可行性。然而,与阻断肾动脉主干的腹腔镜肾部分切除术相比,无阻断的零缺血技术虽然维持了健康肾组织的血流灌注、患者术后肾功能恢复更好,但其手术操作难度、术中出血量、手术切缘阳性率及术后并发症发生率均增加,手术安全性成为多数医生的顾虑[7, 8, 9]。选择性肾动脉分支阻断技术通过阻断特异性肾动脉分支血管,把缺血范围局限在肿瘤及其邻近组织,剩余健康肾组织不受影响,能够较好地解决术野止血和维持残留肾脏灌流之间的矛盾[10, 11, 12]。Desai等[13]对比了机器人肾部分切除术中分别实施肾动脉分支阻断术和肾动脉主干阻断术的患者的围手术期资料,虽然前者平均出血量、并发症发生率略高于后者,但两组间差异无统计学意义,且分支阻断组术后早期肾功能受损明显低于主干阻断组(0% vs 11%,P=0.01),与我们的研究结果类似。为了进一步探讨不同阻断技术对肾功能的中远期影响,本研究还比较了两组患者术后3个月时肾功能的改变情况,结果提示两组患者肾功能的下降程度差异无统计学意义。但是不能据此认为两种血管阻断方式此时对肾功能的影响不存在差别。因为本研究采用的肾功能评估方式不能排除健侧肾脏的代偿作用对总肾功能的影响。同时,我们体会到若分支动脉阻断精确,在肿瘤切除和肾脏重建过程中仅置入吸引器即可保持手术视野清晰,无需“零缺血”技术中的控制性降压等辅助措施,且患者术中出血程度尚不至引起血流动力学的异常。本研究分支阻断组中接受输血治疗1例患者,术前即存在轻度贫血,其术中出血量为300 mL,术中选择输血治疗是主要是为了避免贫血症状进一步加重。
以往研究常把向肿瘤区供血的肾段动脉作为选择性阻断的目标血管。但是,不同的段动脉可能分属不同级别的血管分支,其术中阻断的难易程度存在较大区别,如1~2级的肾动脉分支多位于肾窦外,而3级以上分支多位于肾窦内,其分离难度显著高于前者[14];同时,向肿瘤区特异供血的动脉可能为更低级别的血管分支,以段动脉为目标势必会增加肿瘤以外的缺血区域,损伤健康的肾实质。故本研究中将肾实质或肾窦外的最低一级肾动脉分支作为术中阻断的目标血管,其中6例为2级分支,4例3级分支,仅3例为段动脉,其余均为段动脉下级分支,所有目标血管术中均成功实施阻断。分离肾窦内血管分支的难度较大,这一方面是缘于肾窦狭小的范围限制了手术的操作空间,使术野暴露相对困难,另一方面则是缘于随着动静脉不断背离其主干方向,单位空间内的血管密度增加,尤其是当目标血管位于肾窦中央时,术中误伤其他血管的机会明显增高。因此,医生应根据自身的技术水平选择合适的待阻断动脉分支,最佳的目标血管应当是位于肾窦外的最低一级肾动脉分支。
术中准确、快速地找到并阻断目标分支动脉有赖于高质量的术前影像学检查。Shao等[15]报道采用双源CT重建肾动脉三维图像辅助确定待阻断的目标肾段动脉血管,准确率可高达93%。本研究采用64排螺旋增强CT重建肾动脉三维图像了解肾动脉走行、 分支及其与肿瘤的关系,从而确定待阻断分支动脉,亦可达到满意效果,术中均能顺利找到CT所示目标动脉。在寻找目标血管的过程中,我们采用了循血管走行逐级游离的方法,即仍常规游离肾动脉主干,再依次向肾动脉远心端游离,直至充分暴露目标分支。这样操作的优点是能够充分利用术前影像学检查提供的信息,依据上、下级血管的相对位置关系准确判定待阻断的血管,10例超选择阻断肾部分切除术均未出现阻断错误或阻断无效的情况。
综上所述,超选择性动脉阻断术对肾功能的早期损害低于传统的动脉主干阻断术,有利于腹腔镜下肾部分切除术后肾功能的保护,虽然其术中平均出血量高于后者,但尚不至引起血流动力学的异常,未增加患者出血相关并发症的风险,在技术上是安全、可行的。本研究的局限性在于研究性质为回顾性研究,样本量较小,病例选择上可能存在偏倚,该技术方法对肾部分切除术后肾功能远期影响仍需进一步随访观察。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | 那彦群, 叶章群, 孙颖浩, 孙 光, 黄 健, 孔垂泽, 等. 2014版中国泌尿外科疾病诊断治疗指南[M]. 北京: 人民卫生出版社, 2013:6-7. |
| [2] | Wein A J, Kavoussi L R, Novick A C, Partin A W, Peters C A. Campbell-Walsh Urology[M]. 10th ed. The United States:Saunders, 2011:1657-1658. |
| [3] | Secin F P. Importance and limits of ischemia in renal partial surgery: experimental and clinical research[J]. Adv Urol, 2008: 102461. |
| [4] | Ficarra V, Novara G, Secco S, Macchi V, Porzionato A, De Caro R, et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery[J]. Eur Urol, 2009, 56: 786-793. |
| [5] | Levey A S, Stevens L A, Schmid C H, Zhang Y L, Castro A R, Feldman H I, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150: 604-612. |
| [6] | Thompson R H, Lane B R, Lohse C M, Leibovich B C, Fergany A, Frank I, et al. Every minute counts when the renal hilum is clamped during partial nephrectomy[J]. Eur Urol, 2010, 58: 340-345. |
| [7] | Guillonneau B, Bermudez H, Gholami S, El F H, Gupta R, Adorno R J, et al. Laparoscopic partial nephrectomy for renal tumor: single center experience comparing clamping and no clamping techniques of the renal vasculature[J]. J Urol, 2003, 169: 483-486. |
| [8] | Hotston M R, Keeley F X. Laparoscopic partial nephrectomy without ischemia[J]. Arch Esp Urol, 2013, 66: 146-151. |
| [9] | Nadu A, Kitrey N, Mor Y, Golomb J, Ramon J. Laparoscopic partial nephrectomy: is it advantageous and safe to clamp the renal artery?[J]. Urology, 2005, 66: 279-282. |
| [10] | Shao P, Qin C, Yin C, Meng X, Ju X, Li J, et al. Laparoscopic partial nephrectomy with segmental renal artery clamping: technique and clinical outcomes[J]. Eur Urol, 2011, 59: 849-855. |
| [11] | Martin G L, Warner J N, Nateras R N, Andrews P E, Humphreys M R, Castle E P. Comparison of total, selective, and nonarterial clamping techniques during laparoscopic and robot-assisted partial nephrectomy[J]. J Endourol, 2012, 26: 152-156. |
| [12] | Nohara T, Fujita H, Yamamoto K, Kitagawa Y, Gabata T, Namiki M. Modified anatrophic partial nephrectomy with selective renal segmental artery clamping to preserve renal function: a preliminary report[J]. Int J Urol, 2008, 15: 961-966. |
| [13] | Desai M M, de Castro A A, Leslie S, Cai J, Huang E Y, Lewandowski P M, et al. Robotic partial nephrectomy with superselective versus main artery clamping: a retrospective comparison[J]. Eur Urol, 2014, 66:713-719. |
| [14] | 朱 华, 郑 兵, 茅家慧, 潘晓东, 顾栋华, 陈建刚, 等. 肾段动脉阻断肾部分切除术的相关尸肾解剖研究[J].中华泌尿外科杂志, 2013, 34: 587-590. |
| [15] | Shao P, Tang L, Li P, Xu Y, Qin C, Cao Q, et al. Precise segmental renal artery clamping under the guidance of dual-source computed tomography angiography during laparoscopic partial nephrectomy[J]. Eur Urol, 2012, 62: 1001-1008.. |
 2015, Vol. 36
2015, Vol. 36


