2. 蚌埠医学院第一附属医院肝胆外科, 蚌埠 233004
2. Department of Hepatobiliary Surgery, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, Anhui, China
肝癌是我国常见恶性肿瘤,是指生长于肝脏的恶性肿瘤,根据发病因素可分为原发性肝癌和转移性肝癌,根据病理学特点可分为胆管细胞性肝癌、肝细胞性肝癌和混合型肝癌[1]。国内流行病学及临床研究表明,肝炎病毒感染(以HBV和HCV感染为主)、酒精性肝硬化、摄入黄曲霉毒素污染的食物均与肝癌的发生发展密切相关[2]。手术切除是肝癌治疗的首选方案,但术后5年生存率仅为20%,早期治疗后的5年生存率为50%[3],可见肝癌的临床预后较差,生存率低,肝癌术后的复发和转移正是制约着肝癌患者生存率的主要元凶,也是影响肝癌手术治疗效果的重要瓶颈[4]。因此探索预测肝癌根治术后复发转移因素、发现高危患者并采取个体化治疗具有重要意义。越来越多的学者开始研究肝癌发生、发展及转移的病理生理学的分子机制,旨在寻找有效的治疗靶点,为肝癌的治疗探寻新的临床路径[5]。肝细胞癌病灶内结肠癌转移相关基因1(metastasis-associated in colon cancer 1, MACC1)是近年来新发现的一个与肿瘤密切相关的基因,在结肠癌的侵袭和转移中起了关键性的作用,也有研究发现MACC1是肝细胞生长因子(HGF)/c-Met信号通路的关键调节因子[6]。研究显示MACC1作为一种转录因子可结合到c-Met的启动子上,从而激活HGF/c-Met信号通路来增强癌细胞的增殖、侵袭及转移能力[7]。然而MACC1在肝癌的发生、发展及其与临床病理因素相关性的研究报道甚少。因此,本研究采用实时荧光定量PCR和免疫组化方法检测MACC1在肝癌中的表达,初步探讨其在肝癌中的表达及其临床意义。 1 材料和方法 1.1 一般资料
选择2003年1月至2006年12月在蚌埠医学院第一附属医院肝胆外科行手术切除的108例病理确诊肝细胞肝癌患者的肝癌组织和匹配的癌旁无瘤肝组织。该组患者中男性95例,女性13例,年龄27~79(48.6±11.1)岁,其中乙型肝炎表面抗原(HBsAg)阳性96例(88.9%),合并肝硬化99例(91.7%)。术前肝功能Child-Pugh A级93例,Child-Pugh B级15例,无Child-Pugh C级患者。71例患者为肝内单发肿瘤,另外37例患者为肝内多发肿瘤(2~3个),主瘤直径1.6~19.0 (8.0±4.6) cm。全部患者中位随访时间为38个月。所有患者术前均未接受放射治疗或化学治疗,临床病理资料和随访资料完整,所有组织标本经石蜡包埋后用于免疫组化检测。另取2012年1月至2012年12月 间行手术切除的30例肝癌组织以及20例正常肝组织[正常肝组织是手术切除的无肝炎、肝硬化的肝血管瘤或肝局灶性结节性增生(FNH)瘤旁肝组织],经液氮处理后保存于-80℃环境,用于定量PCR检测。 1.2 免疫组织化学法检测MACC1蛋白表达
兔抗人MACC1多克隆抗体购自美国Abcam公司(稀释浓度1∶1000),山羊抗兔IgG(稀释浓度1∶100),免疫组化试剂盒购自北京中杉金桥生物技术有限公司。手术切除组织经10%多聚甲醛固定后,乙醇梯度脱水,常规石蜡包埋切片,厚度为5 μm,二甲苯脱蜡复水,微波抗原修复,3%H2O2室温孵育10 min,消除内源性过氧化物酶活性,PBS清洗3次,每次5 min,0.3%的Triton-100破膜,羊血清封闭,PBS清洗3次,每次5 min,滴加抗MACC1多克隆抗体,用PBS液代替一抗作为阴性对照,4℃冰箱过夜,PBS清洗3次,每次5 min,按照北京中杉金桥生物技术有限公司提供的DAB试剂盒,二甲苯透明,封片,随机选择10个高倍视野(×400)进行计数,根据染色强度和染色细胞百分率进行评分:0分为未染色;1分为弱染色;2分为中等强度染色;3分为强染色。以阳性细胞百分比评价染色面积:0分为阴性;1分为阳性细胞<25%;2分为阳性细胞25%~50%;3分为阳性细胞51%~75%;4分为阳性细胞>75%;以两项评分的乘积作为每个标本的免疫染色评分。0~4分为阴性(-),5~12分为阳性(+)[8]。 1.3 实时荧光定量PCR检测MACC1 mRNA表达
由Invitrogen公司设计MACC1和GAPDH引物序列,MACC1引物序列(Forward:5′-TTC TTT TGA TTC CTC CGG TGA-3′;Reverse:5′-ACT CTG ATG GGC ATG TGC TG-3′);GAPDH引物序列(Forward:5′-ATC AGC AAT GCC TCC TGC AC-3′;Reverse:5′-CGT CAA AGG TGG AGG AGT GG-3′)。并选用Invitrogen公司Platinum SYBR Green Qpcr SuperMix-UDG试剂盒,TRIzol试剂提取肝脏组织中的总RNA,反转录为cDNA,配置20 μL实时荧光定量PCR反应体系,每个基因重复3次,混匀离心10 s,避免溶液黏附在管壁上,实时定量PCR反应在ABI7900HT实时定量PCR仪上进行,反应结束后,记录每个标本的Ct值和对应的GAPDH Ct值,以ΔCt值进行实验组与对照组的倍数变化[9]。 1.4 统计学处理
采用 SPSS19.0统计软件对实验数据进行处理分析,计量资料用 x±s 形式表示,计量资料两组间进行t检验,组间计数资料的比较采用χ2 检验或Fisher 精确概率法,生存率按Kaplan-Meier 法计算,生存率比较采用log-rank检验。检验水准(α)为0.05。
2 结 果 2.1 MACC1在肝癌中的表达情况
免疫组化结果显示,MACC1蛋白阳性信号定位于细胞质和细胞核(图 1),在108例肝癌组织中MACC1蛋白表达的阳性率为49.1%(53/108),高于癌旁肝组织34.2%(37/108,P=0.011)及正常肝组织0%(0/20,P<0.001)。同样,实时荧光定量PCR结果显示,MACC1 mRNA在30例肝癌组织中的表达水平约是正常肝组织的6倍,是癌旁组织的3倍,癌旁组织MACC1 mRNA的表达是正常肝组织的2倍,差异均有统计学意义(P<0.05)。
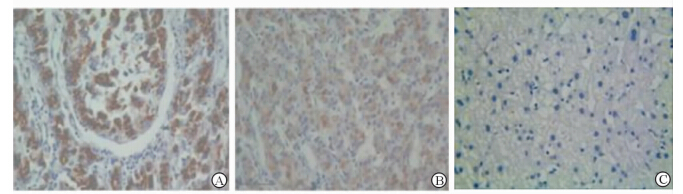 | 图 1 肝癌组织(A)、癌旁组织(B)及正常肝组织(C)中MACC1蛋白免疫组化染色结果 Fig 1 MACC1 expression in HCC tissues (A),adjacent non-tumor tissues (B) and normal liver tissues (C) as shown by immunohistochemistry staining MACC1: Metastasis-associated in colon cancer 1; HCC: Hepatocellular carcinoma. Original magnification:×400 |
单因素分析表明,肝癌组织中MACC1的表达与肿瘤大小、有无包膜及病理分型密切相关(P<0.05),而与肿瘤数目、血管侵犯及TNM分期之间关系无统计学意义(表1)。
|
|
表1 肝癌组织中MACC1蛋白表达与临床病理因素的关系 Tab 1 Association of MACC1 protein expression with clinical pathological factors in hepatocellular carcinoma patients |
生存分析表明MACC1阳性患者的1年、3年和5年的总体生存率分别为0.650、0.492和0.280,而MACC1阴性患者1年、3年和5年总体生存率分别为0.799、0.684和0.566,差异有统计学意义(P=0.006)。见图 2。
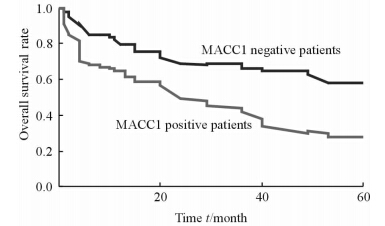 | 图 2 不同MACC1表达肝癌患者的生存曲线 Figure 2 Survival curves of hepatocellular carcinoma patients with different MACC1 expression statuses MACC1: Metastasis-associated in colon cancer |
2014年世界卫生组织发表的《全球癌症报告2014》显示,中国新增癌症病例高居世界第一位,其中肝癌的新增病例和死亡人数均居世界首位。目前,我国肝癌的发病率约为25.7/10万,成为死亡率仅次于胃癌、肺癌的第三大恶性肿瘤[10]。我国也是肝癌高发的国家之一,我国肝癌的发生多与乙型肝炎病毒感染有关,肝癌的发生是一个极其复杂的病理生理过程,大多数肝癌是在慢性肝损害的基础上发展而来[11]。肝移植是根治肝癌的最理想方法,也是终末期肝癌唯一可供选择的治愈方法,值得注意的是,不同病理类型的肝癌其癌细胞生物活性及免疫抑制剂的使用是决定肝脏移植术后复发转移的重要因素,然而供体的匹配困难及昂贵的费用限制了肝脏移植手术在临床上的应用[12]。手术治疗仍是治疗肝癌的首选措施[13],但肝癌术后复发和转移大大降低了肝癌患者的术后生存率。因此寻找更加实用、灵敏、特异的分子标志物,为肝癌患者的早期诊断、监测、预测肝癌术后复发转移及治疗提供理论参考依据,这也是当前肝癌研究的热点问题。
MACC1是2009年从结肠癌细胞cDNA 文库中 克隆出来的,定位于人染色体7p21.1上,其cDNA 由2 559个核苷酸组成,包含7个外显子和6个内含子,编码由852个氨基酸组成的蛋白质[14]。研究表明MACC1是判断结肠癌转移和复发的重要分子,并且与胃癌、卵巢癌、宫颈癌、膀胱癌、非小细胞肺癌、肾盂癌等多种恶性肿瘤的发生、发展密切相关[15]。HGF/c-Met信号通路是指HGF作用于靶细胞的c-Met受体,发挥相应的生物学效应,近年来研究发现HGF/c-Met信号通路在很多恶性肿瘤中异常激活,在肿瘤细胞增殖、抗凋亡、侵袭、迁移及血管生成等过程中发挥重要作用[16]。MACC1在HGF/c-Met信号通路的调控中也发挥了一定的作用[16],MACC1可通过结合c-Met启动子中的特异性位点,进而激活并促进c-Met的转录,参与肿瘤的生物学效应的发生,提示MACC1可作为一种转录因子在很多恶性肿瘤的发生、发展中起关键作用。有研究表明该基因在结肠癌中表达升高,并且是判断结肠癌患者术后预后的独立因子[17]。也有研究表明,MACC1在胃癌[18]、胰腺癌[19]等消化道肿瘤中存在异常高表达,分析发现肝癌与结肠癌同是内胚层来源的恶性肿瘤,而Met靶蛋白的激活与肝癌的发生发展密切相关,由此推论MACC1可能也通过下游Met实现对肝癌细胞增殖、侵袭和转移的调控。周琳等[20]通过siRNA干扰和质粒转染后检测了肝癌细胞中局部粘着斑激酶(FAK)和phospho-FAK的表达水平,结果发现MACC1在受到抑制的情况下可以下调FAK和phospho-FAK的表达,而上调MACC1可引起两者表达上升,同时在组织标本中MACC1 mRNA的表达与Met mRNA的表达呈明显的正相关。他们认为MACC1可能通过HGF/Met通路和FAK通路共同调控肝癌的恶性生物学行为,从而影响肝癌的复发转移,但其具体的分子调控机制仍不明确。而笔者通过实时荧光定量PCR和免疫组化发现,MACC1在肝癌组织中的表达较癌旁组织及正常肝组织升高,提示MACC1的高表达可能参与了肝癌的发生过程。本研究结果显示MACC1的表达水平与肿瘤的大小、分化及包膜情况密切相关,肿瘤直径越大分级越高,肝癌组织内MACC1的表达水平也越高,说明MACC1可能参与了肝癌的恶性演变过程,但关于MACC1在肝癌中异常高表达的上游原因及其激活下游的有关靶向分子及信号通路仍不明确。进一步生存分析发现,MACC1高表达患者术后长期生存率较MACC1低表达或阴性患者低,进一步证实MACC1在肝癌的侵袭和转移中发挥重要作用, 也提示MACC1可能成为预测肝癌术后预后的一个重要分子标志物。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Hai H, Tamori A, Kawada N.Role of hepatitis B virus DNA integration in human hepatocarcinogenesis [J].World J Gastroenterol, 2014, 20:6236-6243. |
| [2] | Chen G, Block J M, Evans A A, Huang P, Cohen C.Gateway to care campaign:a public health initiative to reduce the burden of hepatitis B in Haimen City, China [J].BMC Public Health, 2014, 14:754. |
| [3] | Hatzaras I, Bischof D A, Fahy B, Cosgrove D, Pawlik T M.Treatment options and surveillance strategies after therapy for hepatocellular carcinoma[J].Ann Surg Oncol, 2014, 21:758-766. |
| [4] | Zhao Y J, Ju Q, Li G C.Tumor markers for hepatocellular carcinoma [J].Mol Clin Oncol, 2013, 1:593-598. |
| [5] | Frau M, Biasi F, Feo F, Pascale R M.Prognostic markers and putative therapeutic targets for hepatocellular carcinoma[J].Mol Aspects Med, 2010, 31:179-193. |
| [6] | Sheng X J, Li Z, Sun M, Wang Z H, Zhou D M, Li J Q, et al.MACC1 induces metastasis in ovarian carcinoma by upregulating hepatocyte growth factor receptor c-MET [J].Oncol Lett, 2014, 8:891-897. |
| [7] | Isella C, Mellano A, Galimi F, Petti C, Capussotti L, De Simone M, et al.MACC1 mRNA levels predict cancer recurrence after resection of colorectal cancer liver metastases [J].Ann Surg, 2013, 257:1089-1095. |
| [8] | Ren B, Zakharov V, Yang Q, McMahon L, Yu J, Cao W.MACC1 is related to colorectal cancer initiation and early-stage invasive growth [J].Am J Clin Pathol, 2013, 140:701-707. |
| [9] | Qu J H, Chang X J, Lu Y Y, Bai W L, Chen Y, Zhou L, et al.Overexpression of metastasis-associated in colon cancer 1 predicts a poor outcome of hepatitis B virus-related hepatocellular carcinoma [J].World J Gastroenterol, 2012, 18:2995-3003. |
| [10] | 彭承宏, 李松岗, 刘颖斌, 彭淑牖. 肝癌研究现状[J]. 肝胆外科杂志, 2001, 9:386-388. |
| [11] | Llovet J M, Burroughs A, Bruix J.Hepatocellular carcinoma [J].Lancet, 2003, 362:1907-1917. |
| [12] | Laurent-Puig P, Zucman-Rossi J.Genetics of hepatocellular tumors [J].Oncogene, 2006, 25:3778-3786. |
| [13] | Guglielmi A, Ruzzenente A, Conci S, Valdegamberi A, Vitali M, Bertuzzo F, et al.Hepatocellular carcinoma:surgical perspectives beyond the barcelona clinic liver cancer recommendations [J].World J Gastroenterol, 2014, 20:7525-7533. |
| [14] | Stein U, Walther W, Arlt F, Schwabe H, Smith J, Fichtner I, et al.MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis [J].Nat Med, 2009, 15:59-67. |
| [15] | Stein U.MACC1-a novel target for solid cancers [J].Expert Opin Ther Targets, 2013, 17:1039-1052. |
| [16] | Kawamura M, Saigusa S, Toiyama Y, Tanaka K, Okugawa Y, Hiro S, et al.Correlation of MACC1 and MET expression in rectal cancer after neoadjuvant chemoradiotherapy [J].Anticancer Res, 2012, 32:1527-1531. |
| [17] | Yamamoto H, Miyoshi N, Mimori K, Hitora T, Tokuoka M, Fujino S, et al.MACC1 expression levels as a novel prognostic marker for colorectal cancer[J].Oncol Lett, 2014, 8:2305-2309. |
| [18] | Guo T, Yang J, Yao J, Zhang Y, Da M, Duan Y.Expression of MACC1 and c-Met in human gastric cancer and its clinical significance [J].Cancer Cell Int, 2013, 13:121. |
| [19] | Wang G, Kang M X, Lu W J, Chen Y, Zhang B, Wu Y L.MACC1:a potential molecule associated with pancreatic cancer metastasis and chemoresistance [J].Oncol Lett, 2012, 4:783-791. |
 2015, Vol. 36
2015, Vol. 36


