2. 上海交通大学附属第一人民医院临床药学科, 上海 200080;
3. 上海中医药大学附属岳阳医院药剂科, 上海 200437
2. Department of Pharmaceutics, First People's Hospital of Shanghai, Shanghai Jiaotong University, Shanghai 200080, China;
3. Department of Pharmacy, Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China
基因治疗的关键在于寻找合适的载体来实现高效递送基因进入体内并稳定表达。常用的载体可以分成病毒载体和非病毒载体。病毒载体虽然具有较强的靶向作用但同时具有免疫原性,目前研究中多用非病毒载体,其具有稳定性好、无免疫原性、末端具有活性基团便于进一步修饰等优点。在非病毒载体中具有代表性的是阳离子聚合物,此类聚合物除了具有非病毒载体共有的优点外,其表面往往带有较多氨基,在生理pH的条件可以质子化带正电荷,从而压缩DNA或者RNA以达到包裹基因的目的。此外阳离子聚合物与DNA或RNA会形成一种核-壳结构,外壳是亲水的阳离子片段,内部疏水的核则是部分被中和的DNA或RNA。这一结构可以提高其稳定性,从而避免被DNA酶降解。本研究拟选用阳离子聚合物中3种具有代表性的载体,支化的聚乙烯亚胺(branched-polyethylenimine,BPEI)、线型的聚乙烯亚胺(linear-polyethylenimine,LPEI)和树枝状聚合物聚酰胺-胺(polyamidoamine,PAMAM)来包载具有抑制前列腺癌细胞PC3增殖的miRNA-15a和miRNA-16-1,从而构建microRNA基因递送系统。考察形成的3种复合物粒径、zeta电位、细胞摄取,以及对PC3细胞的抑制作用。 1 材料和方法 1.1 主要仪器及试剂
激光粒度测定仪Z90(Malvern公司,英国);莱卡倒置荧光显微镜(Leica公司,德国);FACSCalibur流式细胞仪(BD公司,美国);miRNA-15a质粒(Pre-miRNA-15a;pre-5′-UAG CAG CAC AUA AUG GUU UGU G-3′)、miRNA-16-1质粒(Pre-miRNA-16-1;pre-5′-UAG CAG CAC GUA AAU AUU GGC G-3′);NC-miRNA质粒(Pre-NC-miRNA;pre-5′-UUC UCC GAA CGU GUC ACG UUT T-3′);NC-miRNA质粒(Pre-NC-miRNA-FAM;5′-UUC UCC GAA CGU GUC ACG UUT T-3′-FAM) (英为信公司,上海); BPEI(MW) = 25 000,Sigma公司,美国); LPEI(MW) = 25 000),PAMAM (G5.0,MW = 28 826);BCA Protein Assay kit(Thermo,美国);TRIzol,M-MLV 反转录酶、荧光定量PCR 试剂盒 (Platinum SYBR Green qPCR SuperMix-UDG,Invitrogen,美国); 所有引物由生工生物工程(上海)股份有限公司合成。 1.2 细胞培养
原代培养前列腺癌细胞PC3方法参照文献进行[3]。使用含有10%胎牛血清(FBS)的RPMI 1640培养基,在37℃、5% CO2孵箱中培养,48~72 h更换培养基,用显微镜观察细胞生长至80%融合状态时用于实验。 1.3 复合物制备及粒径、zeta电位测定
BPEI、PAMAM和LPEI分别与含有1 μg 的NC-miRNA溶液按照载体与NC-miRNA的N/P比为1∶1、5∶1和10∶1旋涡混合15 s,制备BPEI/NC-miRNA、LPEI/NC-miRNA和PAMAM/NC-miRNA 复合物。通过激光粒度测定仪Z90(Malvern,英国)测定制备的不同N/P的复合物粒径和zeta电位。
1.4 复合物凝胶阻滞电泳分析
采用1%(W/V)琼脂糖凝胶(含0.5%EB)、TAE缓冲液(1×),在电压为100 V,时间为60 min的条件下通过琼脂糖凝胶电泳考察上述制备的不同N/P的复合物中BPEI、PAMAM和LPEI与miRNA的结合情况。用紫外投射仪(上海复日科技有限公司)观察并拍照。 1.5 定性观察前列腺癌细胞PC3对不同复合物摄取情况
前列腺癌细胞PC3按照5×104/孔的密度接种于24孔培养板中培养48 h,然后更换培养基为无血清培养液。以1 μg NC-miRNA-FAM/孔,制备各复合物(方法同1.3),将各复合物加入后在37℃、5%CO2的孵箱中培养2 h,采用倒置荧光显微镜观察绿色荧光(激发波长为492 nm,发射波长为518 nm)并拍照。 1.6 定量观察前列腺癌细胞PC3对不同复合物摄取情况
前列腺癌细胞PC3同1.2中培养,按照1×105/孔的密度接种于12孔培养板中培养24 h。以1.3 μg NC-miRNA-FAM/孔,制备各复合物(方法同1.3),将各复合物加入培养板后在37℃、5%CO2条件下孵育3 h,弃去原有培养基,PBS洗2次,收集细胞,并以空白细胞为阴性对照,使用流式细胞仪定量检测FAM的阳性率。 1.7 复合物抗前列腺癌细胞PC3增殖效果
前列腺癌细胞PC3同1.2中培养,以1×104/孔接种于96孔培养板中,培养24 h。使用无血清RPMI 1640培养基新鲜配制4种纳米复合物BPEI/miRNA、LPEI/miRNA、 PAMAM/miRNA、BPEI/NC-miRNA (miRNA为miR-15-a∶miR-16-1=1∶1混合)。按照15、20、30、 50、80、100、170、300、550、700 nmol/L稀释备用。取稀释好的复合物按照100 μL/孔加至96孔板,37℃、5% CO2的孵箱中培养3 h后,弃去含纳米复合物的培养基。按照100 μL/孔更换为含有10% FBS的RPMI 1640培养基并继续培养至48 h。取出培养板,以10 μL/孔加入CCK-8试剂并继续培养3 h。取出培养板,震荡并用酶标仪测定各孔在450 nm处的光密度(D)值。每组重复3孔,以未接种细胞的孔为空白孔、未加入纳米复合物的孔为对照孔,其细胞存活率设定为100%。细胞存活率=[1-(实验组-空白组)/(对照组-空白组)]×100%。 1.8 不同复合物对PC3细胞中Bcl-2、Cylin D1和Wnt3a抑制效果考察
前列腺癌细胞PC3同1.2中培养,将新鲜配制的6种纳米复合物(BPEI/miRNA,LPEI/miRNA,PAMAM/miRNA、BPEI/NC-miRNA,PAMAM/NC-miRNA和LPEI/NC-miRNA)稀释到100 nmol/L浓度备用。将稀释好的纳米复合物材料按照1 mL/孔加至备用的6孔培养板,37℃、5% CO2培养3 h,吸去纳米复合物,按照100 μL/孔更换含10% FBS的RPMI 1640培养液,继续培养48 h。小心吸去培养液,用PBS清洗细胞3次,TRIzol抽提总RNA,取2 μg总RNA,并依据试剂盒(M-MLV First Strand Kit,Invitorgen)说明书进行反转录。使用试剂盒Platinum SYBR Green qPCRSuperMix-UDG kit (Invitorgen)进行相应的荧光定量PCR实验。反应体系为12.5 μL的2×Platinum SYBR Green qPCR SuperMix-UDG,2.5 μL的上游引物(2 μmol/L),2.5 μL的下游引物(2 μmol/L),2 μL的cDNA,6.5 μL的ddH2O。Cyclin D1的引物序列为Forward: 5′-CCGTCCATGCGGAAGATC-3′,Reverse: 5′-GTCACACTTGATCTGG-3′[4]; Bcl-2的引物序列为Forward: 5′-CATGTGTGTGGAGAGCGTCAA-3′,Reverse: 5′-GCCGGTTCAGGTACTCAGTCA-3′[5]; Wnt3a的引物序列为Forward: 5′-CAGGGTGAAGACATGCTGGTG-3′,Reverse: 5′-CGAGGCGCTGTCGTACTTGT-3′[6]; β-actin的引物序列为Forward: 5′-GATGACCCAGATCATGTTTGA-3′,Reverse: 5′-ATGAGGTAGTCAGTCAGGTCC-3′[7]。反应条件:95℃ 1 min,95℃ 30 s,50℃ 30 s,70℃延伸2 min,读板,共30个循环熔解曲线分析:温度50~95℃,升温速率1℃/s,读板1次/s。以依次稀释10倍的cDNA为模板,使用相应的引物进行基因标准曲线的制定。选择管家基因β-actin作为内参,以纯水代替模板序列为阴性对照。利用荧光定量PCR仪自带软件Opticon Monitor-3.1分析各目的基因的Ct值,相对定量靶基因。结果用实验待测基因与其内参基因β-actin的比值除以对照组待测基因与其内参基因β-actin的比值,表示各种基因相对于对照组的转录水平。 1.9 统计学处理
采用SPSS 18.0软件进行统计学分析。数据以 x±s 表示,组间比较采用ANOVA方差分析,检验水准(α)为0.05。 2 结 果 2.1 不同N/P时复合物粒径和zeta电位
从图 1中可以看出,3种复合物粒径均随着N/P比的增大而降低,当N/P比为10时3种复合物的粒径最好,在100~150 nm。而zeta电位则随着N/P比的增大而增加(图 2)。这说明随着N/P比的增加,载体所携带电荷增加,其结合miRNA的能力也就越强。当N/P比为5时,PAMAM/miRNA粒径与BPEI/miRNA和LPEI/miRNA差异有统计学意义(P<0.05)。这可能是由于PAMAM自身所携带的电荷少于BPEI和LPEI,造成其结合miRNA的能力相对较弱,导致最终形成的复合物粒径也较大。
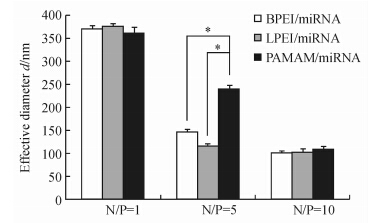 | 图 1 不同N/P时3种复合物的粒径 Fig 1 Sizes of BPEI/miRNA,LPEI/miRNA and PAMAM/miRNA nano-complexes at various N/P ratios BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA:MicroRNA;N/P:Nitrogen/phosphorus. n=3,x±s . *P<0.05 |
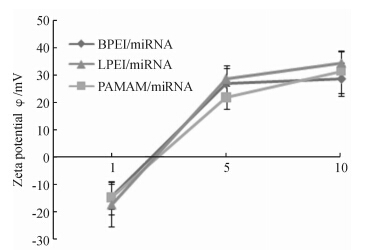 | 图 2 不同N/P时3种复合物的电位 Fig 2 Zeta potentials of BPEI/miRNA,LPEI/miRNA and PAMAM/miRNA nano-complexes at various N/P ratios BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA: MicroRNA; N/P:Nitrogen/phosphorus. n=3,x±s |
从图 3中可以看出,当N/P=1时,miRNA不能与3种载体材料完全结合,可在电场的作用下发生迁移,与荧光染料溴化乙锭结合后在紫外灯的照射下可以看到清晰的条带。当N/P=5时,未见条带显出,说明此时miRNA完全与载体结合,不能在电场中发生迁移。
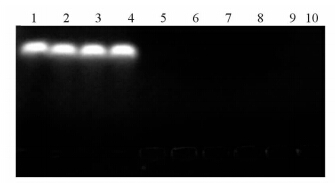 | 图 3 不同N/P时3种复合物的琼脂糖凝胶阻滞电泳分析结果 Fig 3 Results of agarose gel electrophoresis retardation assay of nano-complexes at various N/P ratios 1:Naked miRNA; 2,5,8: BPEI/miRNA; 3,6,9: LPEI/miRNA; 4,7,10: PAMAM/miRNA.2,3,4: N/P=1; 5,6,7: N/P=5; 8,9,10: N/P=10. N/P:Nitrogen/Phosphorus; miRNA: MicroRNA; BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine |
荧光显微镜和流式细胞仪(图 4、图 5)的检测结果均显示,前列腺癌细胞PC3对3种复合物的摄取随着N/P的增加而增加。从图 4的荧光图片以及图 5可以看出,当N/P=5时,细胞对BPEI/NC-miRNA-FAM的摄取明显高于LPEI/NC-miRNA-FAM和PAMAM/NC-miRNA-FAM(P<0.05)。这可能是因为BPEI呈分支状,带有电荷的程度较高,更容易与NC-miRNA-FAM形成紧密的复合物。同时由于形成的纳米复合物正电性较强,也更容易同带有负电荷的PC3细胞结合并形成内吞,故PC3细胞对BPEI/NC-miRNA-FAM的摄取较强。但是当N/P为10时,细胞对BPEI/miRNA-FAM的摄取反而降低,与LPEI/miRNA-FAM和PAMAM/miRNA-FAM 相比差异无统计学意义(P>0.05)。这可能是由于随着BPEI的量增加,形成的纳米复合物的毒性增强,细胞部分死亡脱落,最终造成摄取能力的降低。
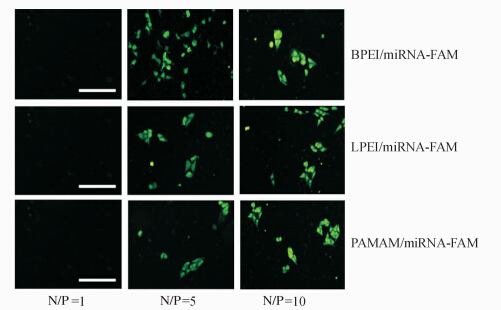 | 图 4 荧光显微镜观察不同N/P时前列腺癌细胞PC3对3种不同纳米复合物的摄取情况 Fig 4 Uptake of three kinds of nano-complexes by PC3 cells at various N/P ratios as observed under fluorescence microscope (scale bar 50 μm) BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA: MicroRNA;N/P:Nitrogen/Phosphorus |
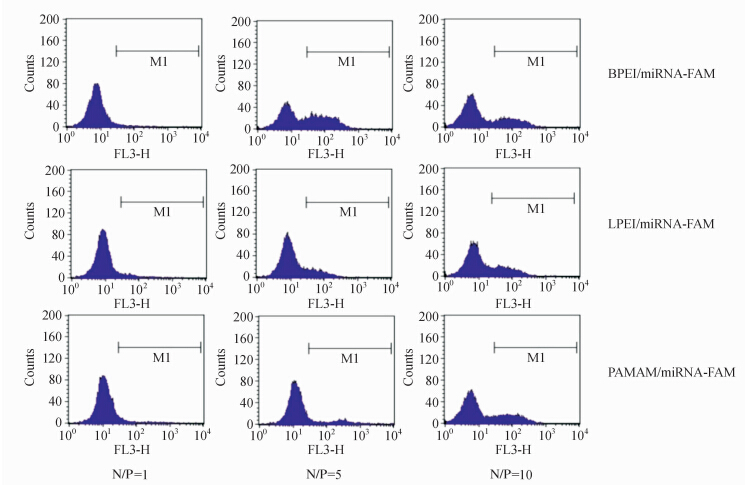 | 图 5 流式细胞仪观察不同N/P比时前列腺癌细胞PC3对3种纳米复合物的摄取情况 Fig 5 Uptake of three kinds of nano-complexes by PC3 cells at various N/P ratios as observed by flow cytometry BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA: MicroRNA; N/P:Nitrogen/Phosphorus. |
3种纳米复合物抗PC3细胞增殖作用的结果经GraphPad 5.0软件处理后,得出3条细胞增殖抑制曲线(图 6),BPEI/miRNA、 LPEI/miRNA和PAMMA/miRNA的IC50值分别为135、158、141 nmol/L,BPEI/NC-miRNA为610 nmol/L,3组纳米复合物的IC50值都低于阴性对照组,说明PAMAM、BPEI和LPEI都可以携带miRNA-15a和miRNA-16-1进入细胞并有效抑制前列腺癌细胞PC3的增殖。
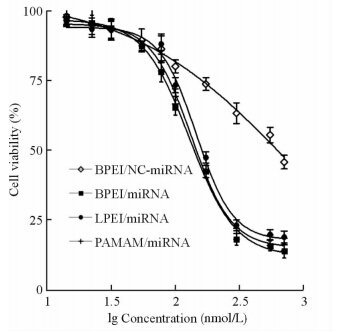 | 图 6 3种复合物抑制前列腺癌细胞PC3增殖作用考察 Fig 6 Effect of three kinds of nano-complexes on the proliferation of PC3 cells BPEI:BranchedBPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA: MicroRNA; NC-miRNA: Negative control miRNA. n=3,x±s |
本研究中,3组纳米复合物分别与PC3细胞作用后,如图 7,分析数据后可以发现用实验组待测基因与内参基因(β-actin)的比值除以对照组待测基因与内参基因(β-actin)的比值后结果均小于1,说明3组纳米复合物中包载的基因药物miR-15-a和miR-16-1起到了抑制前列腺癌细胞PC3中Bcl-2,Cylin D1和Wnt3a表达的作用,从图 7中可以看出BPEI对Cylin D1和Wnt3a的抑制作用强于LPEI和PAMAM(P<0.05),而LPEI对Bcl-2的抑制作用强于BPEI和PMAMA(P<0.05)。因此,3种纳米复合物可以起到抑制PC3细胞增殖的作用。
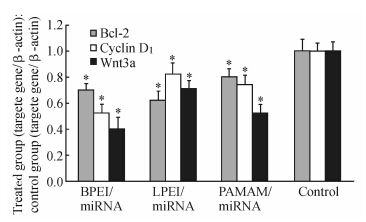 | 图 7 3种复合物对PC3细胞中Bcl-2、Cylin D1和Wnt3a表达的影响 Fig 7 Effect of three kinds of nano-complexes on Bcl-2,Cyclin D1,and Wnt3a expression in PC3 cells BPEI:Branched-polyethylenimine;LPEI:Linear-polyethylenimine;PAMAM:Polyamidoamine;miRNA:MicroRNA. *P<0.05 vs control group. n=3,x±s |
阳离子聚合物所带的正电荷使其具有很强的压缩DNA或RNA的能力。在众多阳离子聚合物中,相对分子质量为25 000的PEI是非病毒载体中进行基因转染的推荐选择[8]。线型PEI和支化PEI除了制备方法不同外,Wightman 等[9]的研究指出,二者与DNA形成的复合物在不同浓度的盐溶液中的稳定性也不同。但无论是线型PEI还是支化PEI,都具有强大的缓冲能力,能够在不同的pH环境中发挥质子海绵效应抑制晚期内吞小泡的酸化,导致其肿胀并引起内吞小泡膜的破裂,从而将内吞的DNA或者RNA释放到细胞质或细胞核中表达[10]。然而PEI的缺点是随着其相对分子质量的升高,细胞中的线粒体易遭到破坏[11],从而造成细胞的死亡,以及PEI在体内无法被生物降解等,这些都阻碍了其进一步应用。PAMAM是球形呈树枝状的化合物,低毒、带正电荷、具有特定的三维结构、分子尺寸和构型可控等使其具备了作为载体的条件。更为特殊的是,4~6代的PAMAM具有口袋状的结构,该结构在不同pH环境下大小会发生变化,从而产生类似于PEI的质子海绵效应。利用这一特性,Shcharbin等[12]实现了将PAMAM作为化疗药物的载体并达到了药物缓释的目的。但是PAMAM的缺点是在不加任何基团修饰的情况下基因转染效率并不高,这可能与PAMAM和基因形成的复合物的形状、进入细胞的方式等有关[13]。
本研究发现,BPEI、LPEI、PAMAM在氮磷比大于5时可以与miRNA形成较为稳定的复合物。该复合物可有效进入前列腺癌细胞PC3。氮磷比为5时,PC3细胞对3种纳米复合物的摄取差异有统计学意义,其中对BPEI/NC-miRNA-FAM的摄取最高,而当氮磷比增至10时,PC3细胞对3种纳米复合物的摄取差异无统计学意义。这可能是由于支化的BPEI更容易与miRNA形成复合物,但是,随着氮磷比增加到10时,BPEI的量增多,毒性增强,表现为细胞对BPEI/NC-miRNA-FAM的摄取降低。细胞毒性试验CCK-8的结果显示,3种载体材料都可以有效携带miRNA进入PC3细胞并抑制其增殖。
Bcl-2蛋白是bcl-2原癌基因的编码产物,其能阻止细胞色素c从线粒体释放到细胞质,从而抑制了细胞凋亡[14]。Cyclin D1是细胞周期调节因子,其过度表达可使细胞G1期缩短,加快细胞增殖,许多肿瘤中均可以检测到Cyclin D1的过度表达[15]。而Wnt3a是一种信号传导的启动因子,可以激活Wnt/β-catenin信号通路,从而影响肿瘤细胞的增殖、侵袭和转移[16]。PCR的结果显示,miRNA-15a和miRNA-16-1的表达对PC3细胞中的Cyclin D1、Bcl-2和Wnt3a具有抑制作用。因此,可以通过阻滞这3种蛋白的表达来实现抑制PC3细胞的增殖、侵袭和转移。
良好的基因给药系统除了大幅提高基因进入细胞的效率外,还应具备提高基因表达的性质。但是有研究显示,可以携带DNA进入细胞并较好表达的载体虽然也能携带siRNA进入细胞,但是却不一定能产生干扰作用[17]。本研究证明,BPEI、LPEI和PAMAM可以包裹miRNA-15a和miRNA-16-1进入PC3细胞并表达,通过降低调控其增殖的Cyclin D1、Bcl-2 和Wnt3a的表达,实现抑制PC3细胞增殖的目的。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Jemal A, Siegel R, Xu J, Ward E.Cancer statistics, 2010[J].CA Cancer J Clin, 2010, 60:277-300. |
| [2] | Siegel R, Naishadham D, Jemal A.Cancer statistics, 2012[J].CA Cancer J Clin, 2012, 62:10-29. |
| [3] | Milowsky M I, Nanus D M, Kostakoglu L, Sheehan C E, Vallabhajosula S, Goldsmith S J, et al.Vascular targeted therapy with anti-prostate-specific membrane antigen monoclonal antibody J591 in advanced solid tumors[J].J Clin Oncol, 2007, 25:540-547. |
| [4] | Jones C D, Darnell K H, Warnke R A, Zehnder J L.CyclinD1/CyclinD3 ratio by real-time PCR improves specificity for the diagnosis of mantlecell lymphoma[J].J Mol Diagn, 2004, 6:84-89. |
| [5] | Yamanaka K, Rocchi P, Miyake H, Fazli L, Vessella B, Zangemeister-Wittke U, et al.A novel antisense oligonucleotide inhibiting several antiapoptotic Bcl-2 family members induces apoptosis and enhances chemosensitivity in androgen-independent human prostate cancer PC3 cells[J].Mol Cancer Ther, 2005, 4:1689-1698. |
| [6] | 官文华, 杨 堃, 赵文君, 刘希双, 王秀娟.Wnt3、Wnt3a在胃癌组织中的表达及意义[J].世界华人消化杂志, 2013, 21:624-628. |
| [7] | Sawyer R T, Fontenot A P, Barnes T A, Parsons C E, Tooker B C, Maier L A, et al.Beryllium-induced TNF-α production is transcription-dependent in chronic beryllium disease[J].Am J Respir Cell Mol Biol, 2007, 36:191-200. |
| [8] | Lungwitz U, Breunig M, Blunk T, Göpferich A.Polyethylenimine-based non-viral gene delivery systems[J].Eur J Pharm Biopharm, 2005, 60:247-266. |
| [9] | Wightman L, Kircheis R, Rössler V, Carotta S, Ruzicka R, Kursa M, et al.Different behavior of branched and linear polyethylenimine for gene delivery in vitro and in vivo [J].J Gene Med, 2001, 3:362-372. |
| [10] | Wang X, Wu X, Fan W, Ding B, Wang X, Zhang W, et al.Surface modification with pluronic P123 enhances transfection efficiency of PAMAM dendrimer[J].Macromol Res, 2012, 20:162-167. |
| [11] | Hunter A C, Moghimi S M.Cationic carriers of genetic material and cell death:a mitochondrial tale[J].Biochim Biophys Acta, 2010, 1797:1203-1209. |
| [12] | Shcharbin D, Pedziwiatr E, Bryszewska M.How to study dendriplexes Ⅰ:Characterization[J].J Control Release, 2009, 135:186-197. |
| [13] | Xiang S, Tong H, Shi Q, Fernandes J C, Jin T, Dai K, et al.Uptake mechanisms of non-viral gene delivery[J].J Contr Rel, 2012, 158:371-378. |
| [14] | Czabotar P E, Lessene G, Strasser A, Adams J M.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol, 2014, 15:49-63. |
| [15] | Ahmed R A, Shawky Ael-A, Hamed R H.Prognostic significance of cyclin D1 and E-cadherin expression in laryngeal squamous cell carcinoma[J].Pathol Oncol Res, 2014, 20:625-633. |
| [16] | Lee M A, Park J H, Rhyu S Y, Oh S T, Kang W K, Kim H N.Wnt3a expression is associated with MMP-9 expression in primary tumor and metastatic site in recurrent or stage Ⅳ colorectal cancer[J].BMC cancer, 2014, 14:125. |
| [17] | Medina S H, El-Sayed M E.Dendrimers as carriers for delivery of chemotherapeutic agents[J].Chem Rev, 2009, 109:3141-3157. |
 2015, Vol. 36
2015, Vol. 36


