胃癌综合治疗效果差的重要原因之一是胃癌细胞具有较强的多药耐药性(multidrug resistance,MDR)[1,2]。研究发现凋亡抑制途径在胃癌MDR中发挥重要作用[3,4];胃癌化疗常用的铂类及氟尿嘧啶类药物的MDR形成与凋亡相关蛋白有关[5,6],但具体调控机制尚不明确。Vav3基因属于Dbl (diffuse B lymphoma)癌基因家族成员之一,在肿瘤的发展、转移等过程中扮演重要角色[7],Vav3可通过调节Bcl-2、Bax、Bad、Bak等凋亡相关基因而参与肿瘤细胞凋亡过程,抑制Vav3 表达可增强紫杉醇诱导肿瘤细胞凋亡的能力[8,9],但Vav3能否通过调控凋亡相关蛋白表达影响胃癌MDR目前尚不清楚。本研究采用RNA干扰技术抑制胃癌细胞株Vav3的表达,检测胃癌细胞对化疗药的敏感性及凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)、凋亡核心半胱氨酸蛋白酶(Caspases)家族Caspase-3、Caspase-8表达变化,探讨Vav3能否通过凋亡抑制途径参与胃癌MDR。 1 材料和方法 1.1 主要试剂及药物
MTT(美国Sigma公司);RPMI 1640培养液、胰蛋白酶(Gibco公司);荧光定量RT-PCR试剂盒(美国Promega公司);LipofectamineTM 2000转染试剂盒(Invitrogen公司);兔抗人Vav3、xIAP、Survivin、Livin、Caspase-3、Caspase-8及β-actin多克隆抗体(美国Santa Cruz公司);相关PCR引物、小干扰RNA由上海生工生物工程有限公司合成。氟尿嘧啶(5-FU,天津金耀制药公司);奥沙利铂(L-OHP,江苏恒瑞医药公司)。胃腺癌细胞株SGC7901、胃上皮细胞株GES-1购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。细胞置于含10%新生牛血清及双抗的RPMI 1640培养液中培养,2~3 d传代1次。实验时将处于对数生长期的细胞经消化分散后计数,制成细胞悬液备用。 1.2 临床样本来源
2013年1月至2013年8月于我科手术切除经病理确诊的胃腺癌25例,其中男18例,女7例,年龄(61.6±10.3)岁,患者术前均未接受放化疗。每例均取癌及癌旁组织(距癌组织边缘>2 cm,病理证实无癌细胞)各1块(约1.0 cm×0.5 cm×0.5 cm),—80℃保存。所有患者均知情同意并签署知情同意书。本研究获河北医科大学第四医院医学伦理委员会审批通过并备案。 1.3 Vav3-siRNA合成及转染
Vav3特异性小干扰RNA序列参考文献[10]设计,序列5′-CCC AGU UUC UCU GUU UGA AGA ACA U-3′,无关对照siRNA(non-specific control siRNA,NS-siRNA)序列5′-CCC UUC UCU GUU UGU AAA GAG ACA U-3′。采用脂质体介导法,使用LipofectamineTM 2000试剂盒,按照说明书将Vav3-siRNA或NS-siRNA转染SGC7901细胞株,转染48 h进行后续实验。 1.4 MTT法检测胃癌细胞体外药敏性
接种104个胃癌细胞200 μL/孔至96孔板,生长至50%融合后,按照使用说明书,将LipofectamineTM 2000与Vav3-siRNA或对照NS-siRNA制备的转染复合物每孔200 μL按分组分别加入各孔,每组各设6个复孔。6 h后更换含牛血清和双抗的RPMI 1640培养液200 μL。另设加入生理盐水的空白对照组。于24 h后每孔分别加入5-FU(25 μg/mL)、L-OHP (8 μg/mL)。继续培养8 h,每孔MTT 20 μL,培养4 h,倒去培养液,加入二甲亚砜(DMSO)150 μL,酶标仪波长490 nm处检测光密度(D)值。抑制率(IR)=(1-给药孔平均D值/对照孔平均D值)×100%。 1.5 荧光定量PCR检测各目的基因 mRNA表达
一步法提取组织或细胞总RNA,以1.5%琼脂糖凝胶(含EB)电泳鉴定RNA完整性,紫外分光光度法测定RNA的纯度及含量。取2 μg RNA用于反转录合成cDNA。按试剂盒说明建立40 μL PCR反应体系。以GAPDH作为内参照基因。PCR反应参数如下:95℃ 5 min,然后94℃变性30 s,58℃退火30 s,72℃延伸30 s,进行40个循环,每个循环的延伸阶段收集荧光信号。Vav 3 (81 bp)引物: F为5′-TGT GTG CCC AAA CCA GTA G-3′, R为5′-AAG TTC GGT CTC TGC TTG C-3′; xIAP (292 bp) 引物: F为5′-CCG TGC GGT GCT TTA GTT GT-3′, R为 5′-TTC CTC GGG TAT ATG GTG TCT GAT-3′; Survivin (185 bp)引物: F为5′-GCC AGA TTT GAA TCG CGG GA-3′, R为5′-GCA GTG GAT GAA GCC AGC CT-3′; Livin (312 bp)引物: F为5′-TCC ACA GTG TGC AGG AGA CT-3′, R为5′- ACG GCA CAA AGA CGA TGG AC-3′; Caspase-3 (148 bp)引物: F为5′-AGA GCT GGA CTG CGG TAT TGA G-3′, R为5′-GAA CCA TGA CCC GTC CCT TG-3′; Caspase-8 (163 bp)引物: F为5′-GAT GAG GCA GAC TTT CTG CT-3′, R为5′-CAT AGT TCA CGC CAG TCA GGA T-3′; GAPDH (138 bp)引物: F为5′- GAC CCC TTC ATT GAC CTC AAC-3′, R为5′-CGC TCC TGG AAG ATG GTG AT-3′。 PCR产物扩增结束后进入结果分析界面,计算各基因mRNA表达的相对数值(RQ值)。 1.6 蛋白质印迹法检测各目的蛋白表达
收取每组107个对数生长期的肿瘤细胞,分别加入细胞裂解液100 μL,冰浴20 min。4℃、7 104×g离心10 min,收集上清,Bradford法测定蛋白浓度。每组取40 μg蛋白样品,10%SDS聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜。5%脱脂奶粉室温封闭90 min,分别加入400倍稀释的一抗,4℃过夜。加入二抗,漂洗后暗室曝光,常规显影、定影。用BioRad图像分析系统分析,以蛋白条带的平均D值表示蛋白表达的相对强度。 1.7 分光光度法检测细胞Caspase-3和Caspase-8活性
收集细胞,用50 μL冷裂解液裂解20 min,12 500×g离心10 min,转移上清并测定蛋白浓度。按照分光光度法检测试剂盒说明书的要求进行操作。酶标仪于波长405 nm处测出各孔D值。用单位蛋白中所含的Caspase酶活力单位表示Caspase活化程度。 1.8 统计学处理
采用SPSS13.0统计软件,计量数据以 x±s 表示,组间比较采用t检验,检验水准(α)为0.05。 2 结 果 2.1 胃癌组织及细胞株Vav3蛋白的表达
结果显示,胃癌组织Vav3蛋白表达高于癌旁组织(P<0.05,图 1A);胃癌细胞Vav3蛋白表达高于胃上皮细胞株(P<0.05,图 1B)。
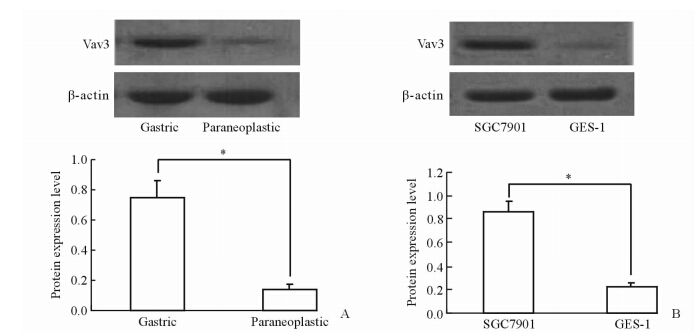 | 图 1 胃癌组织(A)及胃癌细胞株(B)Vav3蛋白的表达 Fig 1 Expression of Vav3 protein in gastric cancer tissues (A) and gastric cancer cell lines (B) *P<0.05. n=8(A),n=3(B),x±s |
结果(图 2)表明:Vav3-siRNA转染SGC7901细胞48 h后,细胞Vav3表达受到明显抑制,Vav3-siRNA在80 nmol/L时对Vav3抑制率达90%左右(P<0.05)。
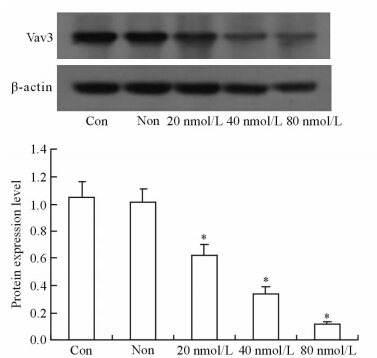 | 图 2 Vav3-siRNA转染后SGC7901细胞株中Vav3的表达 Fig 2 Expression of Vav3 in SGC7901 cells before and 48 h after Vav3-siRNA transfection Con: Blank control group;Non: Negative control group. *P<0.05 vs negative control group. n=3,x±s |
结果显示,5-FU、L-OHP对空白对照组细胞抑制率分别为(40.22±4.24)%、(37.58±4.48)%;阴性对照组(转染NS-siRNA组)分别为(43.64±5.88)%、(39.86±4.79)%。转染Vav3-siRNA组2种药物对肿瘤细胞的抑制率分别为(80.06±11.60)%和(73.34±8.90)%,与对照组比较药物对转染组细胞的抑制率明显增高(P<0.01)。 2.4 Vav3-siRNA转染对SGC7901细胞中xIAP、Survivin、Livin表达的影响
与对照组相比,Vav3-siRNA转染后SGC7901细胞xIAP、Survivin mRNA表达强度均降低(P<0.05),而Livin mRNA表达则无明显变化(图 3A)。蛋白质印迹检测结果与荧光定量PCR结果一致(图 3B)。
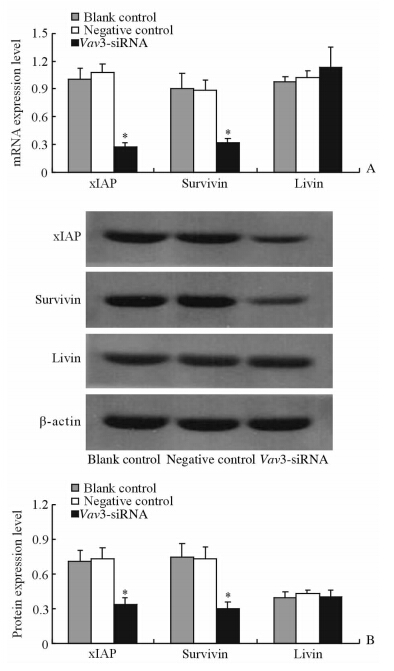 | 图 3 Vav3-siRNA作用后SGC7901中xIAP、Survivin、Livin mRNA (A)和蛋白(B)的表达 Fig 3 Expression of xIAP,Survivin,Livin mRNA(A) and protein(B) in SGC7901 cells after Vav3-siRNA transfection *P<0.05 vs negative control group. n=3,x±s |
结果(图 4、表 1)显示:与对照组相比,Vav3-siRNA转染后SGC7901细胞Caspase-3、Caspase-8表达及活性均明显升高(P<0.05)。
|
|
表 1 Vav3-siRNA作用后SGC7901细胞Caspase-3、Caspase-8活性的变化 Tab 1 Activity of Caspase-3 and Caspase-8 in SGC7901 cells after Vav3-siRNA tansfection |
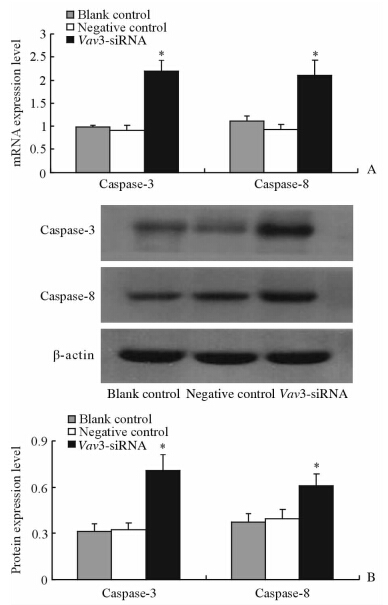 | 图 4 Vav3-siRNA作用后SGC7901细胞Caspase-3、Caspase-8的基因(A)及蛋白(B)表达 Fig 4 ExpressionExpression of Caspase-3 and Caspase-8 mRNA (A) and protein (B) in SGC7901 cells after Vav3-siRNA transfection *P<0.05 vs negative control group. n=3,x±s |
近年来已发现多种途径及基因参与胃癌MDR中,但具体机制尚不完全明确。目前研究最多的是经典MDR途径[11,12],但该途径中的MDR1、MRP1等基因的相关化疗药物多为植物碱类及抗生素类。而胃癌常用的化疗药物多为氟尿嘧啶类及铂类药物,胃癌细胞对此类药物的MDR形成与凋亡抑制途径关系更为密切[5,6]。凋亡抑制蛋白(IAPs)家族是参与肿瘤凋亡抵抗的重要成员,与肿瘤细胞凋亡耐受的形成密切相关,但有关对IAPs上游调控则研究很少。故本研究以具有广泛基因调控功能的Vav3基因为研究对象,对该基因与IAPs及胃癌MDR的关系进行了探讨。
本研究中的Vav3对多种基因、多条信号转导通路都有调控作用,参与膀胱癌、淋巴瘤、乳腺癌等多种恶性肿瘤的发生进展[10,13,14],但Vav3对IAPs的调控作用研究很少。故本研究探讨了Vav3与胃癌MDR的关系及对IAPs成员的调节作用。结果发现胃癌组织及细胞株SGC7901的Vav3表达明显增强,提示Vav3与胃癌有关。进一步采用RNA干扰技术有效抑制了胃癌细胞株SGC7901中Vav3表达,结果发现Vav3被抑制后肿瘤细胞化疗药敏性明显增强,说明Vav3可能具有逆转胃癌细胞MDR的特性。本研究还从分子水平对Vav3影响的凋亡抑制蛋白家族成员xIAP、Survivin、Livin[15]进行了检测,结果发现Vav3受抑制时具有导致肿瘤细胞凋亡抑制形成的基因xIAP、Survivin表达水平下调;而Livin表达变化不明显。Caspase-3、Caspase-8作为细胞凋亡的核心基因,受IAPs调控,可直接 促进细胞凋亡[16,17]。本研究发现,Vav3受到抑制后,Caspase-3、Caspase-8的表达及活性均明显上升。
综上所述,Vav3可能通过调节凋亡抑制途径部分成员表达而抑制Caspases表达活性,最终参与胃癌MDR调节。Vav3作为候选基因有可能在胃癌MDR逆转的研究中发挥重要作用,但确切调节机制仍有待深入研究。
4 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Zhu C Y, Lv Y P, Yan D F, Gao F L.Knockdown of MDR1 increases the sensitivity to adriamycin in drug resistant gastric cancer cells[J].Asian Pac J Cancer Prev, 2013, 14:6757-6760. |
| [2] | Yan L H, Wang X T, Yang J, Kong F B, Lian C, Wei W Y, et al.Reversal of multidrug resistance in gastric cancer cells by E2F-1 downregulation in vitro and in vivo[J].J Cell Biochem, 2014, 115:34-41. |
| [3] | Xie X, Tang B, Zhou J, Gao Q, Zhang P.Inhibition of the PI3K/Akt pathway increases the chemosensitivity of gastric cancer to vincristine[J].Oncol Rep, 2013, 30:773-782. |
| [4] | 檀碧波, 李 勇, 范立侨, 赵 群, 刘 羽, 赵雪峰.胃癌凋亡相关蛋白Survivin、B淋巴细胞/白血病-2、bax表达与肿瘤细胞体外化疗药敏性的关系[J].中华实验外科杂志, 2012, 29:1315-1317. |
| [5] | Li Y, Tan B B, Zhao Q, Fan L Q, Liu Y, Hao Y J, et al.Tumor chemosensitivity is correlated with expression of multidrug resistance associated factors in variously differentiated gastric carcinoma tissues[J].Hepatogastroenterology, 2013, 60:213-216. |
| [6] | Gazzaniga P, Gradilone A, Petracca A, Nicolazzo C, Raimondi C, Iacovelli R, et al.Molecular markers in circulating tumour cells from metastatic colorectal cancer patients[J].J Cell Mol Med, 2010, 14:2073-2077. |
| [7] | Fernandez-Salguero P M.A remarkable new target gene for the dioxin receptor: the Vav3 proto-oncogene links AhR to adhesion and migration[J].Cell Adh Migr, 2010, 4:172-175. |
| [8] | Chang K H, Sanchez-Aguilera A, Shen S, Sengupta A, Madhu M N, Ficker A M, et al.Vav3 collaborates with p190-BCR-ABL in lymphoid progenitor leukemogenesis, proliferation, and survival[J].Blood, 2012, 120:800-811. |
| [9] | Nomura T, Yamasaki M, Hirai K, Inoue T, Sato R, Matsuura K, et al.Targeting the Vav3 oncogene enhances docetaxel-induced apoptosis through the inhibition of androgen receptor phosphorylation in LNCaP prostate cancer cells under chronic hypoxia[J].Mol Cancer, 2013, 12:27. |
| [10] | Lee K, Liu Y, Mo J Q, Zhang J, Dong Z, Lu S.Vav3 oncogene activates estrogen receptor and its overexpression may be involved in human breast cancer[J].BMC Cancer, 2008, 8:158. |
| [11] | Kang J, Zhao G, Lin T, Tang S, Xu G, Hu S, et al.A peptide derived from phage display library exhibits anti-tumor activity by targeting GRP78 in gastric cancer multidrug resistance cells[J].Cancer Lett, 2013, 339:247-259. |
| [12] | Wang Y, Liu L, Liu X, Zhang H, Liu J, Feng B, et al.Shugoshin1 enhances multidrug resistance of gastric cancer cells by regulating MRP1, Bcl-2, and Bax genes[J].Tumour Biol, 2013, 34:2205-2214. |
| [13] | Liu Y, Wu X, Dong Z, Lu S.The molecular mechanism of Vav3 oncogene on upregulation of androgen receptor activity in prostate cancer cells[J].Int J Oncol, 2010, 36:623-633. |
| [14] | Travert M, Huang Y, de Leval L, Martin-Garcia N, Delfau-Larue M H, Berger F, et al.Molecular features of hepatosplenic T-cell lymphoma unravels potential novel therapeutic targets[J].Blood, 2012, 119:5795-5806. |
| [15] | Chen X, Wang T, Yang D, Wang J, Li X, He Z, et al.Expression of the IAP protein family acts cooperatively to predict prognosis in human bladder cancer patients[J].Oncol Lett, 2013, 5:1278-1284. |
| [16] | Wittkopf N, Günther C, Martini E, He G, Amann K, He Y W, et al.Cellular FLICE-like inhibitory protein secures intestinal epithelial cell survival and immune homeostasis by regulating caspase-8[J].Gastroenterology, 2013, 145:1369-1379. |
| [17] | Sikdar S, Mukherjee A, Ghosh S, Khuda-Bukhsh A R.Condurango glycoside-rich components stimulate DNA damage-induced cell cycle arrest and ROS-mediated caspase-3 dependent apoptosis through inhibition of cell-proliferation in lung cancer, in vitro and in vivo[J].Environ Toxicol Pharmacol, 2013, 37:300-314. |
 2015, Vol. 36
2015, Vol. 36


