硫化氢(hydrogen sulfide,H2S)是众所周知的有毒气体,具有臭鸡蛋气味。以往的研究主要集中于其毒性,但自从发现体内存在内源性H2S,其生理浓度是50~160 μmol/L[1, 2]之后,H2S的生理作用逐渐得到了广泛关注和研究。近年研究提示,H2S是哺乳动物中继一氧化氮(nitric oxide,NO)和一氧化碳(carbon monoxide,CO)之后的第3个气体信号分子,并在全身众多器官和系统中发挥着重要的生物学效应[2, 3]。尽管对H2S发挥生理作用的机制尚未完全阐明,但越来越多的证据显示,H2S不仅参与维持正常生理功能的调控,而且与一些疾病的病理过程的发生发展密切相关,对其深入研究具有重要的理论和临床意义。 1 H2S的合成代谢 1.1 内源性H2S
生理浓度的H2S主要来源包括2个方面 (图 1):一是酶促反应生成;二是应激性的从胞质或线粒体中释放(即非酶促反应)。
胱硫醚β合酶(cystathionine beta-synthase,CBS)和胱硫醚γ裂解酶(cystathionine γ-lyase,CSE)已经被证明是哺乳动物体内利用左旋半胱氨酸和高半胱氨酸产生H2S的主要限速酶。其中,CSE存在于肝、肾、胸主动脉、回肠、 胃肠道、肝门静脉和子宫等一些外周组织中,而CBS主要集中在中枢神经系统[5, 6],并广泛分布于前脑和脑干[7]。一直以来都认为中枢的H2S只由CBS产生,但对CBS基因敲除动物模型检测发现大脑组织也存在H2S,并且3-巯基丙酮酸转硫酶(3-mercaptopyruvate,3-MST)诱导产生的中枢H2S比CBS催化生成的更多,并且证实3-MST同时也存在于大脑和外周组织细胞内的线粒体[8, 9]。这3种酶的活性可受到多方面的调节。首先,3种酶是吡哆磷酸盐和钙-钙调蛋白复合体依赖性的酶,其活性受到吡哆磷酸盐和钙-钙调蛋白复合体的调节[10, 11]。此外,低氧状态也能显著抑制酶的活性[12],并降低H2S生理效应的发挥[13]。有趣的是,在自发性高血压大鼠(spontaneously hypertensive rat,SHR),NO合酶(NOS)的特异性抑制剂L-硝基-精氨酸甲酯(L-NAME)具有通过H2S/CSE途径抑制H2S生成的功能,表明NO也对H2S的产生和效应具有影响[14, 15]。体外实验进一步表明,离体心肌细胞中的NOS 抑制剂能通过抑制环氧化酶2(COX2)消除H2S,从而抑制其心脏保护作用[16]。
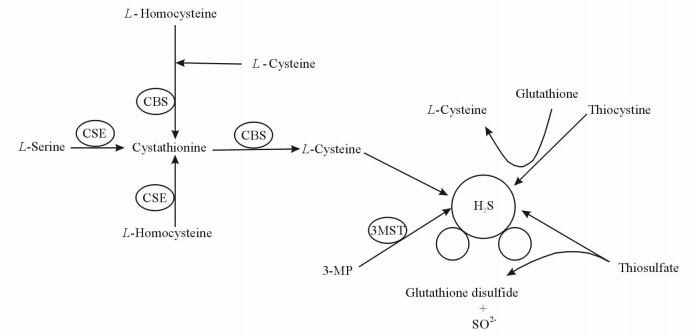 | 图 1 H2S的合成代谢途径 Fig 1 Enzymatic and non-enzymatic synthesis of H2S Modified from reference [4]. CBS: Cystathioninebsynthase; CSE: Cystathionine C-lyase; 3-MST: 3-Mercaptopyruvate sulfurtransferase; 3-MP: 3-Mercaptopyruvate |
H2S的非酶促来源主要是无机多硫化物[17],并且这种产生途径使得H2S可以通过饮食途径传递[18]。
虽然认为H2S能够在体内合成,但由于H2S具有毒性,所以很久以来都认为H2S在动物组织的浓度很低。然而,自从H2S被报道以来,越来越多的文 献报道H2S的生理浓度可达50~160 μmol/L[1, 2],远远超出了预期值。近年来,随着对H2S研究的深入,所测得H2S浓度均值也越来越高,甚至在哮喘患者中高达600 μmol/L[19]。H2S的生理浓度已成为学术界的一个争论焦点,究其原因,除了H2S本身的分布差异外,很大程度上取决于各个研究所用的测量方法不同。 1.2 外源性H2S
目前,对H2S生物学效应的研究主要采用2种H2S供体:硫氢化钠(NaHS)和GYY4317。多种硫化物都可以作为H2S的供体,以NaHS运用最为广泛,对其化学性质也最为了解。由于NaHS能迅速溶解于生理性缓冲液,并不能算一个真正的H2S “供体”,仅依靠化学平衡来释放H2S。其优点是能迅速地释放H2S,增加H2S浓度,缺点是半衰期短、消耗快,很容易经呼吸扩散到体外,导致体内有效浓度的维持时间不长[20],这些缺点也一定程度上限制了NaHS的实际运用。GYY4317是近年来人工合成的H2S供体,它较NaHS能更缓慢和持久地释放H2S,研究发现其对平滑肌细胞没有高浓度所致的细胞毒性作用[21],具有广泛的运用前景。
2 H2S的生理作用 2.1 H2S生理作用的多样性
H2S广泛分布于全身各处,发挥着复杂的生物学作用,参与血管张力、炎症、胰岛素分泌、伤害感受和长寿的调节,在细胞的存活和死亡中发挥着复杂多样的作用[22]。近年来,H2S的中枢神经系统作用也得到重视,有研究表明中枢内源性H2S含量降低可能与阿尔茨海默病的病理过程有关,也在长时程增强和谷氨酸受体调节、学习和记忆、神经递质传递和增强海马功能等多方面发挥着重要作用[5, 23]。 2.2 H2S的心血管效应 2.2.1 H2S外周效应
研究表明H2S具有多种心血管效应,包括血压调节、血管的生长重塑和舒张、炎症与白细胞黏附的抑制以及抗心肌纤维化、抗血栓形成、抗氧化应激和缺血再灌注损伤等[24, 25, 26]。目前认为,H2S的外周降压作用主要依靠舒张血管平滑肌和抑制血管重塑:一方面,通过对基因敲除CSE小鼠的研究发现,敲除CSE的小鼠会逐步发展成为高血压小鼠,内皮依赖性的血管舒张功能也会降低,提示内源性的H2S对血压调节发挥着重要的作用,进一步研究表明血管平滑肌的舒张与H2S诱导的腺苷三磷酸(adenosine triphosphate,ATP)敏感性钾通道的开放和钾离子的外流有关[27, 28];另一方面,H2S通过抗炎抑制平滑肌增殖,诱导平滑肌细胞凋亡[29],也是其发挥外周降压效应的重要机制。对肺动脉高压的研究表明,H2S能减少Ⅰ和Ⅲ型胶原沉积,并通过Fas信号途径诱导平滑肌细胞凋亡,进而减轻肺动脉的重塑,最终发挥抗肺动脉高压的效应[30, 31]。然而,也有学者怀疑H2S的外周降压效应:第一,外源性H2S对血管平滑肌的调节表现出复杂性,低浓度时能舒张血管,而高浓度时却表现为收缩血管[32];第二,H2S能通过血管内皮生长因子具有激活磷脂酰肌醇-3-激酶(PI3K)的作用和促分裂原活化蛋白激酶(MAPK)来促进血管生成,这似乎与其抑制血管重塑的自效应相悖[33]。 2.2.2 H2S中枢效应
对H2S中枢效应的关注始于对颈动脉窦的研究,H2S通过开放ATP敏感钾通道和关闭L 型钙通道参与颈动脉窦的压力感受性反射调节[34],显示H2S影响心血管活动信号的中枢传入。进一步研究显示,清醒大鼠侧脑室注射NaHS之后,大鼠血压出现了明显上升,提示H2S能作用于中枢神经系统,影响心血管功能和参与压力感受性反射调节[35],但对下丘脑后部显微注射NaHS却使血压发生下降,与前面的结果相反,提示下丘脑后部可能存在多个H2S的作用位点[36]。
因此,中枢内H2S在心血管活动调节中的作用扑朔迷离,本篇综述主要通过介绍不同心血管中枢核团内H2S对血压的调节特点及其生理学和病理学意义。
3 心血管活动调节的相关核团
调节心血管活动的最基本中枢位于延髓,如图 2所示,它至少包括缩血管区——延髓头端腹外侧区(rostral ventrolateral medulla,RVLM)、舒血管区——延髓尾端腹外侧区(caudal ventrolateral medulla,CVLM)和传入神经接替站——孤束核(nucleus of solitary tract,NTS) 3个核团[37]。位于丘脑的室旁核(paraventricular nucleus,PVN)因发出纤维与RVLM联系,进而也参与到血压的中枢调节。
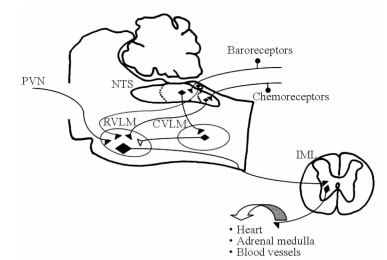 | 图 2 延髓心血管中枢调节的联系示意图 Fig 2 Scheme of neural control of cardiovascular activity in medulla oblongata Modified from reference [37]. PVN:Paraventricular nucleus;NTS:Nucleus of solitary tract;RVLM:Rostral ventrolateral medulla;CVLM: Caudal ventrolateral medulla; IML:Intermedial lateral nucleus |
NTS是压力感受性反射和化学感受反射神经纤维传入中枢后的第一个中继站和综合核团。利用电解质损伤或干扰NTS的神经元,会使大鼠神经节前的交感放电增加,进而导致血压剧烈地上升[38],表明NTS在心血管调节中起着重要作用,这一区域神经元的损伤会引发血压的上升并发展成为急性或慢性的高血压。研究发现,对NTS给予NaHS (2 ~ 200 pmol)能使血压降低,并产生心动过缓的效应,但是在NTS区提前给予格列本脲(10 nmol,ATP敏感钾通道阻断剂)却可以阻断NaHS的心血管效应[39],说明ATP敏感钾通道同样在中枢参与了H2S的中枢降压效应。这也从一个方面解释了在下丘脑微量注射NaHS能够降低大鼠的血压和心率,但注射格列本脲预处理后NaHS的心血管效应却被阻断[36]。此外,若提前给予非选择性谷氨酸受体阻断剂也可以明显减弱NaHS的降血压效应,表明谷氨酸的各种离子型受体和代谢型受体参与了NTS中H2S的心血管压力反射性调节[39],而且N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体在介导H2S对血压调节中具有重要的作用,与H2S能增强NMDA受体作用的结论一致[23]。
研究显示,CBS在NTS的神经元和神经胶质细胞中均有表达[40]。在NTS显微注射S-腺苷蛋氨酸(S-ademetionine,SAM,CBS激动剂)产生了同样的降低血压和心率效应,但运用CBS抑制剂羟胺(hydroxylamine,HA)却未能阻断NaHS的作用[39]。鉴于HA具有调节NO和抑制NOS活性的特点,认为H2S对血压调节作用很可能与NO机制有关。
尽管已经明确了ATP敏感钾通道和谷氨酸受体在H2S降压机制发挥作用,但其具体的信号通路目前并不十分清楚。Austgen等[41]发现H2S (10~50 μmol/L)能增强NTS神经元的兴奋性突触后电流,证明H2S能加强NTS神经元之间的突触传递,这也与H2S的长时程增强作用一致。此前有不少资料表明,H2S诱导的兴奋性突触后电流与突触前机制有关,Austgen等[41]研究还发现H2S提高两个连续兴奋性突触后电流的成对脉冲率时,并没有改变兴奋性突触后电流的出现和衰退时间,证明H2S增强传入神经的谷氨酸的量子释放而不是改变突触后膜受体的敏感性和兴奋性。同时,CBS抑制剂氨基氧乙酸(AOA)也不能改变兴奋性突触后电流的衰退时间和膜的性质,提示内源性H2S也能通过突触前膜调节突触传递。进一步研究显示,H2S还通过增强辣椒素受体1(transient receptor potential vanilloid-1,TRPV1)、L型钙通道和T型钙通道以及调节胞内内质网的钙释放来提高突触前膜内钙离子含量,进而促进该神经递质的释放[41]。
此外,NTS的不同亚核对血压呈现相反方向的调节:对NTS不同区域注射左旋谷氨酸会产生不同的升或降压的效果[42]。值得一提的是,在NTS中间连接亚核区显微注射谷氨酸能升高血压,而NTS中间连接亚核区的破坏也能降低由于主动脉压力感受器去神经化所致的高血压,表明该区组织对高血压起着重要的促进作用,并参与对交感中枢RVLM的兴奋作用[43]。有研究表明,SHR的NTS的中间连接亚核区功能发生了改变,此区域显微注射γ-氨基丁酸(gamma-aminobutyric acid,GABA)产生了降血压效应,而WKY和SD等正常血压大鼠却没有这个变化[44]。这可能是WKY大鼠的脑室内注射NaHS产生升压效应的一个重要原因[35]。 3.2 RVLM
药理学研究证明,RVLM是中枢降压药物莫索尼定和可乐定的作用位点。NTS或CVLM损伤所致的高血压最终都体现到对RVLM的去抑制化作用[45]。RVLM是交感传出的最后一个中枢核团,通过综合内脏和机体的刺激对交感紧张性和压力感受性反射发挥着主要的调节作用[46]。RVLM接受室旁核(PVN)神经元的投射并发出下行神经元到脊髓中间外侧柱的前交感神经元,发挥着对NTS传入信号的应答与调节[47]。研究显示,RVLM显微注射谷氨酸受体拮抗剂犬尿烯酸(kynurenic acid)能降低SHR的动脉血压,但对正常血压大鼠WKY无影响[48],表明SHR的RVLM受到增强的谷氨酸能紧张性传入的驱动。RVLM内谷氨酸能传入的来源并不十分清楚,但上述NTS的中间连接亚核区很有可能参与其中,因为电生理研究显示RVLM区的组织有NTS中间连接亚核区的直接投射。除了谷氨酸,L-NAME也能通过激活RVLM的活动导致血压的升高,但是L-NAME并未改变血压对谷氨酸和犬尿烯酸的反应性,表明L-NAME对RVLM的激活并不是通过增强谷氨酸能的作用而实现的,必然存在着另外的调节方式[49]。此外,RVLM的缺血、炎症和氧化应激也能导致交感兴奋和血压上升。有研究者通过在RVLM显微注射NaHS( 4、8和16 mmol/L,50 nL),发现其剂量依赖性地降低心率、血压和肾交感活动[50],表明外源性的H2S能抑制RVLM的神经元电活动进而降低血压。与NTS类似,格列本脲(40 μmol/L,50 nL)同样也能够在RVLM阻断H2S(8 mmol/L,50 nL)的交感抑制作用,而钙通道激动剂(1 μmol/L,50 nL)却没有明显的效果[50]。H2S与钾通道之间具体通路尚未明确,但有研究发现,H2S同ATP敏感钾通道复合体的rvSUR1亚基的6和26位半胱氨酸残基的胞外N末端有相互作用,H2S对rvSUR1亚基的化学修饰可能参与了H2S激动ATP敏感钾通道的分子机制[51]。因此,调节交感活动RVLM神经元的H2S作用于ATP敏感钾通道的信号通路很可能与rvSUR1亚基有关。对于钙通道,虽然有研究表明H2S能够通过关闭L型钙通道来增强颈动脉窦压力感受性反射,而且钙通道同样表达在RVLM区[34],但RVLM的实验并未发现钙通道激动剂对心血管的影响,表明L型钙通道对H2S的中枢降压效应作用可能不大。
研究还发现L-NAME抑制NO释放具有减轻H2S的交感抑制效应,表明NO参与H2S对RVLM的交感抑制作用,而NO能够通过对亚单位的半胱氨酸残基的S-亚硝基化作用激活背侧神经节神经元的ATP敏感钾通道,也支持这个结论[52]。在RVLM显微注射HA能升高血压、心率和交感活动,提示内源性的H2S也能抑制交感紧张性。由于HA可以降低NO和抑制性神经递质GABA的含量,H2S的降压效应可能与二者有关。对RVLM注射硝普钠和GABA时,心率、血压和交感活动呈现下降[53],而直接注射H2S却升高了血压、心率和交感活动,提示H2S的交感调节活动需要NO或GABA等机制的共同参与。尽管如此,也有研究报道了H2S(NaHS,0.2~2 000 pmol)在RVLM不能发挥对心血管活动的调节作用[54],并质疑钾通道在H2S血压调节中的作用。 尽管以上2项研究都采用了对RVLM进行H2S显微注射,却得出了完全不同的结论,原因除了实验技术手段不同以外,更重要的可能与H2S供体NaHS有关,NaHS释放H2S的过程与生理状态还有较大不同,加上H2S组织内的扩散和氧化,很可能掩盖了中枢H2S真正的血压调节效应。 3.3 PVN
PVN位于双侧的第三脑室旁,分为大细胞群和小细胞群,被认为表达30多种神经递质或神经激素。有关心血管PVN背部、腹部和侧部的小细胞性的神经元向胸腰段脊髓的中间外侧柱和RVLM投射,并参与心血管活动的调节。大约有30%的向脊髓投射的神经元有侧支通向RVLM,因此,PVN的神经元通过3种方式影响交感神经活动:PVN-脊髓中间外侧柱途径、PVN-RVLM的间接途径以及直接和间接混合侧支途径[55, 56]。PVN的激动和抑制受到谷氨酸能和GABA能神经元的调节。静息状态下,GABA能占优势,控制PVN处于静息状态。PVN区也有NOS的表达,NO参与调节谷氨酸能和GABA能平衡,PVN很可能也是H2S的作用位点。微阵列分析表明,产生H2S的3种必需的酶都表达在PVN神经元内,在PVN进行H2S显微注射可导致心血管功能的改变,但其中的机制尚不明确。最近研究表明,0.1~1 nmol的H2S缓释剂GYY4317能升高大鼠血压,并表现出剂量依赖性,而较大剂量(4 nmol)则能加强大鼠的基础肾交感活动、血压、心率和心交感传入反射,尤其在慢性心力衰竭大鼠,提示PVN区的外源性H2S能够增强肾交感活动、心率、血压和心交感传入反射[34]。由于PVN区的NOS抑制剂上调了交感活动和血压,而NO供体却反转了这一效应的现象,外源性H2S可能抑制了PVN内NO的产生,进而产生了升血压的效应。同时也有研究显示,NaHS来源的H2S能够使PVN内各种类型的神经元去极化,这个结果也从电生理学方面阐述了H2S升血压效应的机制[57]。但HA并未对上述指标产生明显的影响,表明内源性H2S对心力衰竭大鼠和正常大鼠的交感兴奋和心交感传入反射没有明显的调节作用。与RVLM情况类似,也有研究在PVN注射NaHS和CBS抑制药,但并未产生明显的血压、心率和交感活动变化[54]。 3.4 CVLM
CVLM是脑干心血管调控的一个主要的降压区域,具有显著的交感抑制作用。CVLM的神经元能抑制RVLM的交感兴奋神经元,在心血管活动调控中具有重要的作用。但目前对CVLM的研究并不是很清楚,主要原因是CVLM的降压神经元分布于从RVLM边缘到髓质与脊髓的连接部的一大片区域,该区域功能具有多样性,至少含有以2种神经元构成的多个心血管调节复合体。目前尚未开展H2S在CVLM的心血管调节作用的相关研究。
H2S的血压中枢调节机制复杂,既能降血压又能升血压,主要决定于起作用的核团及部位。H2S在NTS和RVLM主要发挥降低血压的调节作用,其主要与开放ATP敏感钾通道有关,同时抑制内源性的H2S在上述2个核团都能使血压上升。有趣的是,H2S在上述2个核团也能提高NO的含量,说明NO很有可能完全或部分参与到H2S的减压环节中,或者存在着“H2S—ATP敏感钾通道—NO”这一途径来调节血压。此外,钙通道和NMDA受体也参与到NTS的H2S降压效应中,但在RVLM却没有效应或未见报道,说明H2S的作用效应与核团的位置有关。H2S在PVN主要发挥升高血压的效应,可能与其下调NO的含量有关,但未见其对ATP敏感钾通道影响的相关报道。最后尚有一些研究报道了H2S对电生理的影响[41],其中机制复杂,需要进一步的研究确认。综合来说,H2S的降压机制主要与ATP敏感钾通道和谷氨酸受体有关,而升压环节则很可能有NO的参与,具体情况见表 1。
|
|
表 1 硫化氢对心血管活动的中枢调节作用 Tab 1 Effects of hydrogen sulfide on central cardiovascular regulation |
现阶段研究虽然显示了中枢H2S对血压的调节作用,但具体的机制环节尚未得到充分的解释,甚至出现了矛盾的效应。究其原因,除了H2S本身作用复杂和核团功能多样以外,很可能还与供体的特性有关。对H2S的血压调节机制尚需进一步研究,明确其机制对探索和发现新的心血管疾病防治策略具有重要的作用和意义。 5 利益冲突
所有作者声明本文不涉及任何利益冲突。
| [1] | Wang R. Two's company, three's a crowd: can H2S be the third endogenous gaseous transmitter?[J]. FASEB J, 2002, 16:1792-1798. |
| [2] | Wang R.Physiological implications of hydrogen sulfide: a whiff exploration that blossomed[J].Physiol Rev, 2012, 92:791-896. |
| [3] | Chan M V, Wallace J L.Hydrogen sulfide-based therapeutics and gastrointestinal diseases: translating physiology to treatments[J].Am J Physiol Gastrointest Liver Physiol, 2013, 305:G467-G473. |
| [4] | Kolluru G K, Shen X, Bir S C, Kevil C G. Hydrogen sulfide chemical biology: pathophysiological roles and detection[J]. Nitric Oxide, 2013, 35:5-20. |
| [5] | Mustafa A K, Gadalla M M, Snyder S H.Signaling by gasotransmitters[J].Sci Signal, 2009, 2:re2. |
| [6] | Renga B.Hydrogen sulfide generation in mammals: the molecular biology of cystathionine-β-synthase(CBS) and cystathionine-γ-lyase (CSE)[J].Inflamm Allergy Drug Targets, 2011, 10:85-91. |
| [7] | Bantikyan A, Song G, Feinberg-Zadek P, Poon C S.Intrinsic and synaptic long-term depression of NTS relay of nociceptin- and capsaicin-sensitive cardiopulmonary afferents hyperactivity[J].Pflugers Arch, 2009, 457:1147-1159. |
| [8] | Shibuya N, Mikami Y, Kimura Y, Nagahara N, Kimura H.Vascular endothelium expresses 3-mercaptopyruvate sulfurtransferase and produces hydrogen sulfide[J].J Biochem, 2009, 146:623-626. |
| [9] | Shibuya N, Tanaka M, Yoshida M, Ogasawara Y, Togawa T, Ishii K, et al.3-Mercaptopyruvate sulfurtransferase produces hydrogen sulfide and bound sulfane sulfur in the brain[J].Antioxid Redox Signal, 2009, 11:703-714. |
| [10] | 孙 燕, 张素清, 金红芳, 唐朝枢, 杜军保. 线粒体膜钾通道阻断剂在硫化氢对大鼠心功能调节的意义[J].中华心血管病杂志, 2009, 37:161-164. |
| [11] | Yang G, Wu L, Jiang B, Yang W, Qi J, Cao K, et al.H2S as a physiologic vasorelaxant: hypertension in mice with deletion of cystathionine gamma-lyase[J].Science, 2008, 322:587-590. |
| [12] | Koenitzer J R, Isbell T S, Patel H D, Benavides G A, Dickinson D A, Patel R P, et al.Hydrogen sulfide mediates vasoactivity in an O2-dependent manner[J].Am J Physiol Heart Circ Physiol, 2007, 292:H1953-H1960. |
| [13] | Kiss L, Deitch E A, Szabó C.Hydrogen sulfide decreases adenosine triphosphate levels in aortic rings and leads to vasorelaxation via metabolic inhibition[J].Life Sci, 2008, 83(17-18):589-594. |
| [14] | Zhong G, Chen F, Cheng Y, Tang C, Du J.The role of hydrogen sulfide generation in the pathogenesis of hypertension in rats induced by inhibition of nitric oxide synthase[J].J Hypertens, 2003, 21:1879-1885. |
| [15] | Yanfei W, Lin S, Junbao D, Chaoshu T.Impact of L-arginine on hydrogen sulfide/cystathionine-gamma-lyase pathway in rats with high blood flow-induced pulmonary hypertension[J].Biochem Biophys Res Commun, 2006, 345:851-857. |
| [16] | Hu L F, Pan T T, Neo K L, Yong Q C, Bian J S.Cyclooxygenase-2 mediates the delayed cardioprotection induced by hydrogen sulfide preconditioning in isolated rat cardiomyocytes[J].Pflugers Arch, 2008, 455:971-978. |
| [17] | Peers C.Modulation of ion channels and transporters by carbon monoxide: causes for concern?[J].Front Physiol, 2012, 3:477. |
| [18] | Benavides G A, Squadrito G L, Mills R W, Patel H D, Isbell T S, Patel R P, et al.Hydrogen sulfide mediates the vasoactivity of garlic[J].Proc Natl Acad Sci USA, 2007, 104:17977-17982. |
| [19] | Saito J, Zhang Q, Hui C, Macedo P, Gibeon D, Menzies-Gow A, et al.Sputum hydrogen sulfide as a novel biomarker of obstructive neutrophilic asthma[J].J Allergy Clin Immunol, 2013, 131:232-234. |
| [20] | Insko M A, Deckwerth T L, Hill P, Toombs C F, Szabo C.Detection of exhaled hydrogen sulphide gas in rats exposed to intravenous sodium sulphide[J].Br J Pharmacol, 2009, 157:944-951. |
| [21] | Li L, Whiteman M, Guan Y Y, Neo K L, Cheng Y, Lee S W, et al. Characterization of a novel, water-soluble hydrogen sulfide-releasing molecule (GYY4137): new insights into the biology of hydrogen sulfide[J]. Circulation, 2008, 117:2351-2360. |
| [22] | Wang R.The gasotransmitter role of hydrogen sulfide [J].Antioxid Redox Signal, 2003, 5:493-501. |
| [23] | Giuliani D, Ottani A, Zaffe D, Galantucci M, Strinati F, Lodi R, et al.Hydrogen sulfide slows down progression of experimental Alzheimer's disease by targeting multiple pathophysiological mechanisms[J].Neurobiol Learn Mem, 2013, 104:82-91. |
| [24] | Wang X, Wang Q, Guo W, Zhu Y Z.Hydrogen sulfide attenuates cardiac dysfunction in a rat model of heart failure: a mechanism through cardiac mitochondrial protection[J].Biosci Rep, 2011, 31:87-98. |
| [25] | Polhemus D J, Kondo K, Bhushan S, Bir S C, Kevil C G, Murohara T, et al.Hydrogen sulfide attenuates cardiac dysfunction after heart failure via induction of angiogenesis[J].Circ Heart Fail, 2013, 6:1077-1086. |
| [26] | King A L, Polhemus D J, Bhushan S, Otsuka H, Kondo K, Nicholson C K, et al.Hydrogen sulfide cytoprotective signaling is endothelial nitric oxide synthase-nitric oxide dependent[J].Proc Natl Acad Sci U S A, 2014, 111:3182-3187. |
| [27] | Fitzgerald R, DeSantiago B, Lee D Y, Yang G, Kim J Y, Foster D B, et al.H2S relaxes isolated human airway smooth muscle cells via the sarcolemmal K(ATP) channel[J].Biochem Biophys Res Commun, 2014, 446:393-398. |
| [28] | Chen Y, Zhao J, Du J, Xu G, Tang C, Geng B.Hydrogen sulfide regulates cardiac sarcoplasmic reticulum Ca(2+) uptake via K(ATP) channel and PI3K/Akt pathway[J].Life Sci, 2012, 91(7-8):271-278. |
| [29] | Du J, Hui Y, Cheung Y, Bin G, Jiang H, Chen X, et al.The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J].Heart Vessels, 2004, 19:75-80. |
| [30] | Li X, Du J, Jin H, Geng B, Tang C.Sodium hydrosulfide alleviates pulmonary artery collagen remodeling in rats with high pulmonary blood flow[J].Heart Vessels, 2008, 23:409-419. |
| [31] | Li W, Jin H F, Liu D, Sun J H, Jian P J, Li X H, et al.Hydrogen sulfide induces apoptosis of pulmonary artery smooth muscle cell in rats with pulmonary hypertension induced by high pulmonary blood flow[J].Chin Med J (Engl), 2009, 122:3032-3038. |
| [32] | d'Emmanuele di Villa Bianca R, Sorrentino R, Coletta C, Mitidieri E, Rossi A, Vellecco V, et al.Hydrogen sulfide-induced dual vascular effect involves arachidonic acid cascade in rat mesenteric arterial bed[J].J Pharmacol Exp Ther, 2011, 337:59-64. |
| [33] | Papapetropoulos A, Pyriochou A, Altaany Z, Yang G, Marazioti A, Zhou Z, et al.Hydrogen sulfide is an endogenous stimulator of angiogenesis[J].Proc Natl Acad Sci U S A, 2009, 106:21972-21977. |
| [34] | Xiao L, Wu Y M, Wang R, Liu Y X, Wang F W, He R R.Hydrogen sulfide facilitates carotid sinus baroreceptor activity in anesthetized male rats[J].Chin Med J (Engl), 2007, 120:1343-1347. |
| [35] | Ufnal M, Sikora M, Dudek M.Exogenous hydrogen sulfide produces hemodynamic effects by triggering central neuroregulatory mechanisms[J].Acta Neurobiol Exp (Wars), 2008, 68:382-388. |
| [36] | Dawe G S, Han S P, Bian J S, Moore P K.Hydrogen sulphide in the hypothalamus causes an ATP-sensitive K+ channel-dependent decrease in blood pressure in freely moving rats[J].Neuroscience, 2008, 152:169-177. |
| [37] | Colombari E, Sato M A, Cravo S L, Bergamaschi C T, Campos R R Jr, Lopes O U. Role of the medulla oblongata in hypertension[J]. Hypertension, 2001, 38(3 Pt 2):549-554. |
| [38] | Doba N, Reis D J.Acute fulminating neurogenic hypertension produced by brainstem lesions in the rat[J].Circ Res, 1973, 32:584-593. |
| [39] | Qiao W, Yang L, Li X Y, Cao N, Wang W Z, Chai C, et al.The cardiovascular inhibition functions of hydrogen sulfide within the nucleus tractus solitarii are mediated by the activation of KATP channels and glutamate receptors mechanisms[J].Pharmazie, 2011, 66:287-292. |
| [40] | Li M, Nie L, Hu Y, Yan X, Xue L, Chen L, et al.Chronic intermittent hypoxia promotes expression of 3-mercaptopyruvate sulfurtransferase in adult rat medulla oblongata[J].Auton Neurosci, 2013, 179(1-2):84-89. |
| [41] | Austgen J R, Hermann G E, Dantzler H A, Rogers R C, Kline D D.Hydrogen sulfide augments synaptic neurotransmission in the nucleus of the solitary tract[J].J Neurophysiol, 2011, 106:1822-1832. |
| [42] | Dhruva A, Bhatnagar T, Sapru H N.Cardiovascular responses to microinjections of glutamate into the nucleus tractus solitarii of unanesthetized supracollicular decerebrate rats[J].Brain Res, 1998, 801(1-2):88-100. |
| [43] | Akemi Sato M, Vanderlei Menani J, Ubríaco Lopes O, Colombari E.Lesions of the commissural nucleus of the solitary tract reduce arterial pressure in spontaneously hypertensive rats[J].Hypertension, 2001, 38(3 Pt 2):560-564. |
| [44] | Sato M A, Colombari E, Morrison S F.Inhibition of neurons in commissural nucleus of solitary tract reduces sympathetic nerve activity in SHR[J].Am J Physiol Heart Circ Physiol, 2002, 282:H1679-H1684. |
| [45] | Ernsberger P, Meeley M P, Mann J J, Reis D J.Clonidine binds to imidazole binding sites as well as alpha 2-adrenoceptors in the ventrolateral medulla[J].Eur J Pharmacol, 1987, 134:1-13. |
| [46] | Guyenet P G.The sympathetic control of blood pressure[J].Nat Rev Neurosci, 2006, 7:335-346. |
| [47] | Dampney R A, Fontes M, Hirooka Y, Horiuchi J, Potts P D, Tagawa T.Role of angiotensin Ⅱ receptors in the regulation of vasomotor neurons in the ventrolateral medulla[J].Clin Exp Pharmacol Physiol, 2002, 29(5-6):467-472. |
| [48] | Yamada K, Moriguchi A, Mikami H, Okuda N, Higaki J, Ogihara T.The effect of central amino acid neurotransmitters on the antihypertensive response to angiotensin blockade in spontaneous hypertension[J].J Hypertens, 1995, 13(12 Pt 2):1624-1630. |
| [49] | Bergamaschi C T, Campos R R, Lopes O U.Rostral ventrolateral medulla: a source of sympathetic activation in rats subjected to long-term treatment with L-NAME[J].Hypertension, 1999, 34(4 Pt 2):744-747. |
| [50] | Guo Q, Jin S, Wang X L, Wang R, Xiao L, He R R, et al.Hydrogen sulfide in the rostral ventrolateral medulla inhibits sympathetic vasomotor tone through ATP-sensitive K+ channels[J].J Pharmacol Exp Ther, 2011, 338:458-465. |
| [51] | Jiang B, Tang G, Cao K, Wu L, Wang R.Molecular mechanism for H2S-induced activation of KATP channels[J].Antioxid Redox Signal, 2010, 12:1167-1178. |
| [52] | Kawano T, Zoga V, Kimura M, Liang M Y, Wu H E, Gemes G, et al.Nitric oxide activates ATP-sensitive potassium channels in mammalian sensory neurons: action by direct S-nitrosylation[J].Mol Pain, 2009, 5:12. |
| [53] | 杨丽明, 何瑞荣.延髓腹外侧区微量注射L-NNA和SNP对大鼠血压、心率和肾交感神经活动的影响[J].生理学报, 1996, 48:368-376. |
| [54] | Streeter E, Al-Magableh M, Hart J L, Badoer E.Hydrogen sulfide in the RVLM and PVN has no effect on cardiovascular regulation[J].Front Physiol, 2011, 2:55. |
| [55] | Cruz J C, Bonagamba L G, Machado B H, Biancardi V C, Stern J E.Intermittent activation of peripheral chemoreceptors in awake rats induces Fos expression in rostral ventrolateral medulla-projecting neurons in the paraventricular nucleus of the hypothalamus[J].Neuroscience, 2008, 157:463-472. |
| [56] | Card J P, Sved J C, Craig B, Raizada M, Vazquez J, Sved A F.Efferent projections of rat rostroventrolateral medulla C1 catecholamine neurons: implications for the central control of cardiovascular regulation[J].J Comp Neurol, 2006, 499:840-859. |
| [57] | Khademullah C S, Ferguson A V.Depolarizing actions of hydrogen sulfide on hypothalamic paraventricular nucleus neurons[J].PLoS One, 2013, 8:e64495. |
 2015, Vol. 36
2015, Vol. 36


