2. 宁波市第一医院神经内科, 宁波 315000
2. Department of Neurology, The First Hospital of Ningbo, Ningbo 315000, Zhejiang, China
随着全球人口老龄化和生活方式的改变,脑卒中的发病率逐年升高且呈现年轻化趋势。脑卒中不仅会造成患者肢体活动障碍、语言障碍等躯体残疾,还可严重损害患者的认知功能。一项meta分析表明,我国脑卒中后早期(3个月内)卒中后认知障碍(post stroke cognitive impairment,PSCI)和卒中后痴呆(post stroke dementia,PSD)的发病率分别为56.6%和23.2%[1]。PSCI影响脑卒中患者的预后[2],降低患者的生活质量[3],还会给家人带来较重的心理和经济负担。目前关于PSCI的研究多以横断面队列研究为主,由于诊断标准、研究对象、脑卒中的相关特征(脑卒中后时间、类型、发病次数等)的差异,不同研究所得出的PSCI患病率并不一致[4]。确定卒中早期认知功能变化规律及其危险因素,对于PSCI的防治极其重要。本研究以急性缺血性卒中患者为研究对象,前瞻性观察其认知功能的变化情况,探索卒中后3个月内认知功能恶化的发生率及其危险因素,以利于临床早期干预和判断预后。
1 资料和方法 1.1 研究对象前瞻性连续入组2013年11月至2014年9月在浙江大学医学院附属第一医院、宁波市第一医院及嘉兴市第二医院神经内科住院治疗的急性缺血性卒中的患者。纳入标准: (1)急性卒中符合WHO定义的诊断标准,即突发的局灶性或全面性神经功能缺损的临床征象,并且持续时间超过24 h,排除其他非血管性原因(如原发性脑肿瘤、脑转移瘤、硬膜下血肿、癫癎发作后麻痹、脑外伤等)造成的脑功能障碍,包括脑梗死、脑实质内出血和蛛网膜下腔出血[5];(2)发病14 d以内的缺血性卒中患者;(3)患者年龄>18岁;(4)获得患者本人或者合法监护人知情同意。排除标准:(1) 因各种交流沟通问题无法完成认知功能的检查(例如意识水平下降,严重的听力或视力障碍、失语,严重的构音障碍,严重的认知功能障碍);(2)既往有认知障碍病史;(3)失访或死亡。该项研究获得浙江大学附属第一医院伦理委员会的批准同意,参与研究的对象均签署知情同意书。
1.2 一般资料采集急性缺血性卒中患者入院时完成下列基线数据的采集。(1)人口学特征:性别、年龄及受教育程度; (2)既往史: 高血压病、糖尿病、既往卒中史及吸烟(吸烟6个月以上,每天吸烟>10支者为吸烟人群[6])、酗酒(饮酒超过6个月,摄入酒精量至少每天30 g或每周210 g者为酗酒人群[6])史; (3)入院后各项检查指标:体质指数(body mass index,BMI)、血压、血糖化血红蛋白、血总胆固醇、血三酰甘油、血低密度脂蛋白胆固醇、血高密度脂蛋白胆固醇。(4)住院期间治疗情况,包括静脉溶栓药、抗血小板药、降脂药、降糖药、降压药。(5)经专业培训后的医师行美国国立卫生研究院卒中量表(NIH Stroke Scale,NIHSS)评分。
1.3 认知功能评估经专业训练的神经心理评估师应用认知量表对所有患者进行认知功能评估,包括简易精神状态量表(mini-mental state examination,MMSE)和临床痴呆量表(clinical dementia rating scale,CDR)。基线评估为在发病14 d内完成。3个月后由同一位神经心理评估师再次对研究对象进行上述量表的评估。
1.4 PSCI诊断标准本研究根据AHA/ASA诊断标准定义PSCI,简述如下:(1)有认知功能损害及脑血管影像学证据,并且在脑血管时间(临床卒中)和认知功能缺陷发生之间存在明确的短暂性联系;(2)在卒中之前或之后,没有提示非血管性神经退行性疾病导致的逐步进展的认知功能缺陷的病史[4]。
1.5 分组依据患者卒中急性期(发病 < 14 d)和卒中后3个月MMSE总分的变化,以减少或增加2分以上定义认知功能的恶化或好转[7, 8]。将所有患者分为恶化组(MMSE总分减少2分以上的患者)和未恶化组(包括MMSE总分增加、不变或减少不多于2分的患者)。
1.6 统计学处理所有统计学分析采用SPSS 18.0完成。计量资料以
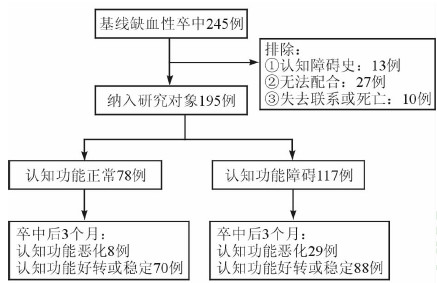
本研究最终纳入研究对象195例(图 1)。平均年龄(60.5±11.3)岁;男性113例(57.9%),女性82例(42.1%);卒中急性期认知功能障碍及认知功能正常的患者分别有117(60.0%)例和78(40.0%)例。
|
图 1 245例缺血性卒中病例入组、随访、分组流程图 |
缺血性卒中3个月后认知功能障碍及认知功能正常的患者分别有113(57.9%)和82(42.1%)例。共有37例患者发生了认知功能的恶化,其中急性期认知功能障碍和认知功能正常的患者中,分别有29(24.8%)和8(10.3%)例发生认知功能恶化(图 1)。故最终认知功能恶化组37例(19.0%),未恶化组158例(81.0%)。组间比较见表 1。相比较于认知功能未恶化组,认知功能恶化组中年龄>70岁、女性、文盲患者比例更高(
|
|
表 1 缺血性卒中3个月后认知功能恶化组与未恶化组相关因素比较 |
将以上所有因素纳入单因素logistic回归模型,分析结果显示:缺血性卒中后3个月内认知功能恶化与年龄、性别、受教育年限、急性期MMSE评分、急性期CDR整体评分、入院时糖化血红蛋白水平有关(
|
|
表 2 缺血性卒中3个月后患者认知功能恶化的危险因素 |
由于诊断标准、研究对象、脑卒中的相关特征的差异,不同研究所得出的卒中后3个月PSCI患病率并不一致。Jacquin 等[9]应用MMSE和MOCA量表对280例卒中患者住院期间和卒中后3个月的认知情况做了评估,结果得出卒中后3个月PSCI的患病率为47.3%,PSD的患病率为7.7%。Douir等[10]对1995—2010年伦敦南部社区4 212份卒中登记表进行了分析,得出卒中后3个月患者PSCI患病率为24%;且在长期随访后发现PSCI患病率相对稳定在22%(3个月后24%,5年后22%,14年后21%)。本研究基于美国心脏协会和美国卒中协会(AHA/ASA)的诊断标准,得出卒中急性期和3个月后PSCI的患病率均较高,分别为40.0%和42.1%。分析可能的原因如下:首先有可能是因为本研究基于医院神经内科病房的脑卒中患者,研究对象的神经功能损伤相对较严重;其次本研究根据AHA/ASA的诊断标准定义PSCI,更多症状较轻的PSCI患者被早期诊断。
有研究表明,7.8%的PSCI患者在脑卒中急性期过后认知功能改善,这种改善大部分发生在脑卒中后6~12个月之内[11]。67%~78%的PSCI患者,在卒中后1年甚至更长的时间内,能够保持认知功能的稳定或好转[11, 12]。约有14%的PSCI患者在卒中2年后的认知功能会较卒中后3个月时有所衰退[11]。本研究发现卒中3个月后共有37例(19.0%)患者发生了认知功能的恶化,其中急性期认知功能障碍和认知功能正常的患者中,分别有29例(24.8%)和8例(10.3%)发生认知功能恶化。表明PSCI虽然有着较高的患病率,但是随着病程的发展,本病的转归有恶化、稳定,甚至是好转等各种可能[11, 12]。
Desmond等[13]通过随访研究证实,80岁以上的缺血性卒中患者发生痴呆的比例更高,约是60~69岁年龄组的6倍。有研究表明,卒中后认知功能改善患者的年龄明显小于认知功能稳定者和认知功能衰退者[11]。本研究发现年龄>70岁的患者卒中后早期发生认知功能恶化的相对危险度是年龄≤70岁患者的2.509倍,高龄患者卒中后更容易合并PSCI,并发生认知功能的进一步恶化。可见,PSCI的发生及病情变化与年龄有密切的关系[14]。
本研究发现缺血性卒中后早期认知功能恶化组文盲比例更高,受教育程度低是认知功能恶化的危险因素,与既往研究结论一致[13, 15]。曾有学者认为受教育的时间越长,神经系统对损伤的自我保护能力越强[16],故接受教育可能对认知功能具有保护作用。
越来越多的证据表明,高糖血症以氧化应激反应为基本机制,导致血管和神经元的损害,从而引起认知功能障碍[17]。Desmond等[18]研究证明,高糖血症对PSCI患者认知功能的恢复有不利影响,合并高糖血症的PSCI患者认知功能改善的比例明显小于其他卒中患者。本结果亦支持这种观点。
曾有研究表明,长期稳定或逐步好转的PSCI患者,无论在卒中前还是在卒中后,认知功能都相对正常[19]。 我们发现,恶化组患者在卒中急性期各项认知功能评分中的表现均差于非恶化组患者,其中卒中急性期MMSE评分高是缺血性卒中后3个月内认知功能恶化的保护因素(RR=0.852),提示卒中急性期严重的认知障碍预示着认知功能的进一步恶化。
综上所述,一部分急性缺血性卒中患者早期会发生认知功能的恶化。年龄>70岁、文盲、糖化血红蛋白高、卒中急性期存在严重的认知功能障碍是缺血性卒中后早期认知功能恶化的危险因素。临床医师应该对具备以上危险因素的卒中患者加强认知功能的随访,积极控制血糖,尽早对存在认知功能障碍的患者进行干预治疗。
| [1] | 曲艳吉, 卓 琳, 詹思延. 中国脑卒中后认知障碍流行病学特征的系统评价 [J] .中华老年心脑血管病杂志, 2013, 15:1294-1301. |
| [2] | Oksala N K, Jokinen H, Melkas S, Oksala A, Pohjasvaara T, Hietanen M, et al. Cognitive impairment predicts poststroke death in long-term follow-up[J].J Neurol Neurosurg Psychiatry, 2009, 80:1230-1235. |
| [3] | Baumann M, Le Bihan E, Chau K, Chau N. Associations between quality of life and socioeconomic factors, functional impairments and dissatisfaction with received information and home-care services among survivors living at home two years after stroke onset[J]. BMC Neurol, 2014, 14:92. |
| [4] | Gorelick P B, Scuteri A, Black S E, Decarli C, Greenberg S M, Iadecola C, et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association [J] . Stroke, 2011, 42:2672-2713. |
| [5] | Kunitz S C, Gross C R, Heyman A, Kase C S, Mohr J P, Price T R, et al. The pilot stroke data bank: definition, design, and data[J]. Stroke, 1984, 15:740-746. |
| [6] | 王 韵, 郝永刚, 董 谦, 李淑娟, 胡文立.青年缺血性卒中的中国缺血性卒中亚型及危险因素分析[J].中国卒中杂志, 2014, 9:376-382. |
| [7] | Ballard C, Rowan E, Stephens S, Kalaria R, Kenny R A. Prospective follow-up study between 3 and 15 months after stroke: improvements and decline in cognitive function among dementia-free stroke survivors >75 years of age[J]. Stroke, 2003, 34:2440-2444. |
| [8] | Bowie P, Branton T, Holmes J. Should the mini mental state examination be used to monitor dementia treatments?[J].Lancet, 1999, 354:1527-1528. |
| [9] | Jacquin A, Binquet C, Rouaud O, Graule-Petot A, Daubail B, Osseby G V, et al. Post-stroke cognitive impairment: high prevalence and determining factors in a cohort of mild stroke[J]. J Alzheimers Dis, 2014, 40:1029-1038. |
| [10] | Douiri A, Rudd A G, Wolfe C D. Prevalence of poststroke cognitive impairment: South London Stroke Register 1995-2010[J]. Stroke, 2013, 44: 138-145. |
| [11] | del Ser T, Barba R, Morin M M, Domingo J, Cemillan C, Pondal M, et al.Evolution of cognitive impairment after stroke and risk factors for delayed progression[J]. Stroke, 2005, 36:2670-2675. |
| [12] | Tham W, Auchus A P, Thong M, Goh M L, Chang H M, Wong M C, et al. Progression of cognitive impairment after stroke: one year results from a longitudinal study of Singaporean stroke patients[J]. J Neurol Sci, 2002, 203-204:49-52. |
| [13] | Desmond D W, Moroney J T, Sano M, Stern Y. Incidence of dementia after ischemic stroke: results of a longitudinal study[J]. Stroke, 2002, 33:2254-2260. |
| [14] | Jellinger K A. Morphologic diagnosis of "vascular dementia" - a critical update[J]. J Neurol Sci, 2008, 270(1-2):1-12. |
| [15] | 杨 洁, 区腾飞, 解龙昌, 殷建瑞, 蒲蜀香, 杨新光, 等.短暂性脑缺血发作及轻型卒中患者认知功能下降的随访研究[J].中国神经精神疾病杂志, 2015, 41:98-101. |
| [16] | Stern Y, Zarahn E, Hilton H J, Flynn J, DeLaPaz R, Rakitin B. Exploring the neural basis of cognitive reserve[J]. J Clin Exp Neuropsychol, 2003, 25:691-701. |
| [17] | Currais A, Prior M, Lo D, Jolivalt C, Schubert D, Maher P. Diabetes exacerbates amyloid and neurovascular pathology in aging-accelerated mice[J].Aging Cell, 2012, 11:1017-1026. |
| [18] | Desmond D W, Moroney J T, Sano M, Stern Y. Recovery of cognitive function after stroke[J].Stroke, 1996, 27:1798-1803. |
| [19] | Rasquin S M, Lodder J, Verhey F R. Predictors of reversible mild cognitive impairment after stroke: a 2-year follow-up study[J]. J Neurol Sci, 2005, 229-230:21-25. |
 2015, Vol. 36
2015, Vol. 36


