2. 第二军医大学长海医院泌尿外科, 上海 200433
2. Department of Urology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
自2005年美国FDA批准索拉非尼(sorafenib)作为首个治疗转移性肾细胞癌分子靶向药物上市以来,随着多种分子靶向药物的研发上市与临床应用,转移性肾细胞癌的治疗已经全面进入分子靶向治疗的新时代。已经上市的各类靶向药物主要以作用于血管内皮生长因子(vascular endothelial growth factor,VEGF)通路的口服多靶点酪氨酸激酶抑制剂(tyrosinekinase inhibitor,TKI)与哺乳动物雷帕霉素靶蛋白(mTOR)为主,基本取代细胞因子治疗,使转移性肾细胞癌患者取得更大的生存获益。苹果酸法米替尼是在舒尼替尼(sunitinib)的基础上由我国研发的新型TKI类药物,旨在通过对舒尼替尼的结构进行修饰,得到一种更高疗效、低毒性的多靶点TKI。苹果酸法米替尼的Ⅰ期临床试验显示出良好的抗肿瘤谱,对晚期肾癌疗效突出,同时对胃肠间质瘤、肝癌也具有抗肿瘤活性[1]。目前该药物正处于Ⅱ期临床试验中,第二军医大学长海医院2011年10月至2015年6月对9例转移性肾细胞癌患者应用法米替尼治疗,现将疗效观察结果报告如下。
1 资料和方法 1.1 病例资料收集2011年10月至2015年6月在第二军医大学长海医院接受法米替尼治疗的转移性肾细胞癌患者9例,所有患者均经手术,通过病理证实为肾透明细胞癌,影像学检查明确存在无法通过手术治疗的转移病灶。其中男性7例,女性2例,年龄40~68岁,中位年龄61岁。双肺转移4例,腰大肌转移1例,腹膜后软组织并胸椎转移1例,双肺并淋巴结转移共3例(1例为腹膜后并肺门淋巴结转移,1例主动脉弓旁淋巴结转移,1例锁骨上淋巴结并纵隔淋巴结及肋骨转移)。所有患者开始治疗前均未接受过其他一线治疗,如细胞因子治疗、中药治疗或放化疗,美国东部肿瘤协作组(ECOG)评分均为0分。所有患者均签署知情同意书。
1.2 治疗方法苹果酸法米替尼(SDFA批件号2009L03465),由江苏恒瑞医药股份有限公司提供。所有患者起始剂量为25 mg/d,每日早餐前口服,注意观察、记录不良反应,连续给药42 d(6周)为1个治疗周期,根据不良反应的严重程度可调整剂量为22 mg/d、20 mg/d,或者暂停药物使用直至不良反应缓解后恢复药物使用,暂停给药时间纳入治疗周期。治疗过程直至患者出现疾病进展或患者无法耐受毒性终止治疗,或患者要求退出治疗。
1.3 疗效评价以世界卫生组织(WHO)实体肿瘤疗效评估RECIST1.0标准对肿瘤进行评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。无进展生存时间(progression free survival,PFS)指肿瘤患者从开始接受治疗到疾病进展或者发生死亡之间的时间。客观缓解率(objective response rate,ORR),指肿瘤缩小到一定程度并保持一定时间的患者的比例,包括CR和PR的病例。应用美国国家癌症研究院(NCI)制定的毒性评价标准CTCAE3.0对不良反应进行评价和分级。
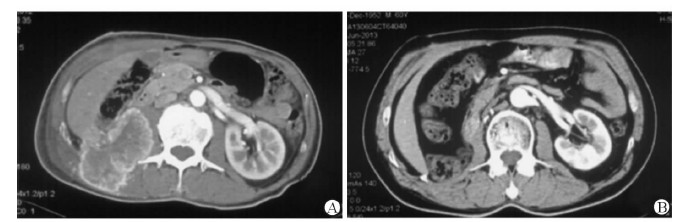
2 结 果 2.1 肿瘤疗效评价随访截至2015年6月,中位随访时间29个月(15~40个月)。9例患者服药期间,第3周期(C3)末肿瘤疗效评估获PR 6例,SD 2例,PD 1例,C3 ORR 66.7%(6/9)。中位PFS 16.5个月(4.5~38.0个月)。患者一般资料及治疗情况见表 1。1例患者服药14个月后复查腰大肌示8.8 cm病灶已完全消失,疗效评估为CR(图 1),21个月时因蛋白尿不可耐受停药,停药后每3个月复查CT,至今共17个月未见明显复发病灶;1例PD患者二线服用索拉非尼至随访结束共28个月,疗效评估为SD;1例患者用药38个月后因PD出组,目前已进入二线治疗;1例患者用药3个周期后获PR,第30个月时要求出组后未接受其他靶向药物治疗,共随访37个月,疗效评估为SD。
|
图 1 1例患者服用法米替尼治疗前后右侧腹膜后转移病灶CT影像 A:服用法米替尼前,右腹膜后转移灶侵犯腰大肌,最长径8.8 cm; B:服用法米替尼治疗第14个月,右侧腹膜后转移灶消失,疗效达完全缓解 |
|
|
表 1 患者一般资料及治疗情况 |
所有患者均出现不同程度的不良反应,不良反应按发生率高低依次为:蛋白尿、白细胞降低、血小板降低、手足综合征、高血压、贫血、高三酰甘油血症、食欲减退、腹泻、高胆固醇血症、转氨酶升高、血尿、高钾血症、总胆红素升高、口腔黏膜炎、脂肪酶升高、水肿、高尿酸血症、γ谷氨酰转移酶(GGT)升高、皮疹、呕吐、心律失常(表 2)。6例患者通过适当减量或暂停服药,将不良反应控制在可控范围内,维持治疗至终点;2例因反复出现不可耐受的Ⅲ~Ⅳ级蛋白尿而停止治疗;1例不良反应轻,疗程中未发生需要减量或停药的不良反应。
|
|
表 2 不良反应统计 |
肾癌是泌尿系统三大恶性肿瘤之一,其发病率约占人类恶性肿瘤的3%[2],约有1/3的患者在发病时已经存在远处转移,40%~50%的局限性肾癌术后会出现转移[3]。随着人们对肾癌信号转导通路及调节机制的不断了解,新的分子靶向药物不断涌现,美国FDA已经批准多种分子靶向药物上市,其中索拉非尼、舒尼替尼、依维莫司(everolimus)、阿西替尼(axitinib)已经通过SFDA批准于我国上市。
索拉非尼、舒尼替尼是我国转移性肾细胞癌应用最广泛的一线药物。法米替尼与索拉非尼、舒尼替尼等分子靶向药物一样具有抑制血管生成以及抗肿瘤细胞增殖的作用,其靶点包括VEGFR2、VEGFR3、PDGFR、c-Kit、Flt3 和Ret。据报道舒尼替尼治疗转移性肾癌的中位PSF及总生存期(OS)分别为7.8~12.2个月、22.6~33.2个月[4, 5, 6, 7, 8],ORR为12%~17%[4, 5, 9]。本研究中使用苹果酸法米替尼作为9例转移性肾细胞癌的一线治疗方案,PFS超过12个月(包括12个月)者为7例 (77.8%)。其中1例疗效显著,用药至14个月,复查腰大肌示8.8 cm病灶已完全消失,疗效评估为CR。靶向治疗转移性肾细胞癌获CR疗效的极少,据文献报道仅占所有靶向治疗患者的2%[4, 5, 6, 7, 8, 10],一项关于舒尼替尼的Ⅲ期临床试验报道的CR率也仅为3%[11]。本例患者治疗效果显著,说明法米替尼在转移性肾细胞癌的治疗上具有突出的疗效。
法米替尼的不良反应主要表现为药物相关的蛋白尿。本研究中蛋白尿发生率为88.9%,以Ⅱ~Ⅲ级为主,出现Ⅲ级蛋白尿时需要减量或停药观察,多数情况下停药后蛋白尿均能好转,本研究中2例患者因反复出现Ⅲ~Ⅳ级蛋白尿导致多次停药和剂量调整出组。其余不良反应与索拉非尼、舒尼替尼相似,主要表现为Ⅰ~Ⅲ级的血液学毒性如白细胞减少、血小板减少、贫血,以及Ⅰ~Ⅱ级的手足综合征和Ⅰ~Ⅲ级的高血压。通过对症处理、及时减量或停药,不良反应均处于可控范围内,说明该药具有较好的安全性。
本研究探讨了法米替尼作为一种新的分子靶向药物治疗转移性肾细胞癌的可能,遗憾的是病例数较少,更加客观的疗效结果需要更大样本量和更长期的随访分析才能给出更可靠的结论。
| [1] | 周爱萍, 张 雯, 常春晓, 迟·依荷巴丽, 王金万.苹果酸法米替尼Ⅰ期临床人体耐受性研究初步总结[J].中国新药杂志, 2011, 20:1678-1682, 1690. |
| [2] | Moeh H. Cystic renal tumors:new entities and novel concepts[J]. Adv Anat Pathol, 2010, 17:209-214. |
| [3] | 张洪秀, 聂明秀, 李 伟. 晚期肾癌靶向治疗现状[J].现代泌尿生殖肿瘤杂志, 2014, 6:375-377. |
| [4] | Sternberg C N, Calabrò F, Bracarda S, Cartenì G, Lo Re G, Ruggeri E M, et al. Safety and efficacy of sunitinib in patients from Italy with metastatic renal cell carcinoma: final results from an expanded-access trial[J].Oncology, 2015, 88:273-280. |
| [5] | Gore M E, Szczylik C, Porta C, Bracarda S, Bjarnason G A, Oudard S, et al. Final results from the large sunitinib global expanded-access trial in metastatic renal cell carcinoma[J]. Br J Cancer, 2015, 113:12-19. |
| [6] | Kim K H, Kim H Y, Kim H R, Sun J M, Lim H Y, Lee H J, et al. Efficacy and toxicity of sunitinib in patients with metastatic renal cell carcinoma with renal insufficiency[J]. Eur J Cancer, 2014, 50:746-752. |
| [7] | Park S J, Lee J L, Park I, Park K, Ahn Y, Ahn J H, et al. Comparative efficacy of sunitinib versus sorafenib as first-line treatment for patients with metastatic renal cell carcinoma[J]. Chemotherapy, 2012, 58:468-474. |
| [8] | Miyake H, Miyazaki A, Harada K, Fujisawa M. Assessment of efficacy, safety and quality of life of 110 patients treated with sunitinib as first-line therapy for metastatic renal cell carcinoma: experience in real-world clinical practice in Japan[J]. Med Oncol, 2014, 31:978. |
| [9] | Gore M E, Szczylik C, Porta C, Bracarda S, Bjarnason G A, Oudard S, et al. Safety and efficacy of sunitinib for metastatic renal-cell carcinoma: an expanded-access trial[J]. Lancet Oncol, 2009, 10:757-763. |
| [10] | Lacovelli R, Alesini D, Palazzo A, Trenta P, Santoni M, de Marchis L, et al.Targeted therapies and complete responses in first line treatment of metastatic renal cell carcinoma. A meta-analysis of published trials[J]. Cancer Treat Rev, 2014, 40:271-275. |
| [11] | Motzer R J, Hutson T E, Tomczak P, Michaelson M D, Bukowski R M, Oudard S, et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma[J]. J Clin Oncol, 2009, 27:3584-3590. |
 2015, Vol. 36
2015, Vol. 36


