非酮症糖尿病性偏侧舞蹈病(hemichorea associated with nonketotic hyperglycemia,HC-NH)是一种少见的非酮症高血糖并发症,目前发病机制不明。该病多见于老年女性,尤其是亚洲人,临床上以急性起病的偏侧肢体的大幅度、不规则的不自主运动为主要症状,MRI检查显示病灶局限于壳核和尾状核,尸检和脑组织活检发现胶质细胞增生和空泡形成或肥大星形细胞增生[1]。我们曾报道3例患者病灶存在明显的强化效应,提示血脑屏障(BBB)破坏;患者发病前均有感染病史,脑脊液检查显示非特异性炎性反应,提示炎性反应参与高血糖导致的基底节损害[2]。研究系统性炎性反应和高血糖两者对中枢神经系统损害及其机制,对防治糖尿病并发症具有重要意义。因此,本研究利用脂多糖(LPS)建立系统性炎症反应模型,研究系统性炎症对糖尿病小鼠基底节神经元的损害作用,并探讨其可能的机制。
1 材料和方法 1.1 动物模型及分组选用4~5个月龄C57BL/6雄性小鼠,体质量30~40 g,均购自浙江省医学科学研究院实验动物中心[许可证号SCXK(浙)2013-0033]。动物模型实验设计符合动物管理委员会和NIH指南。48只小鼠按照完全随机化方式分为3组:空白对照组、糖尿病组和糖尿病+LPS组,每组16只。糖尿病模型制作:小鼠腹腔注射链脲佐菌素(streptozotocin,STZ,Sigma公司)150 mg/kg,注射后检测血糖证实出现糖尿病,即空腹血糖>20 mmol/L入选实验动物,空腹血糖未达标者予以剔除并补充。糖尿病+LPS组以100 μg/kg剂量腹腔注射LPS(Sigma公司)。实验过程中糖尿病组死亡1只,糖尿病+LPS组死亡2只,及时补充。空白对照组腹腔注射同等剂量的0.9%生理盐水。动物常规饮食饲养,72 h后灌注、取脑。
1.2 免疫荧光染色及甲苯胺蓝染色脑组织复合甲醛固定4℃过夜,20%、30%和40%蔗糖依次脱水,冰冻切片机冰冻切片(30 μm),置于-20℃保存。取出脑组织切片,PBS洗涤2次;加羊血清,封闭60 min;然后加一抗,4℃过夜,PBS洗涤3次,加荧光结合Cy3抗鼠或488抗羊抗体,避光室温孵育60 min;避光,PBS洗涤3次,贴片封片,荧光显微镜下观察、摄片。抗体血脑屏障紧密连接蛋白Occludin(1∶500,Sigma),检测Occludin在小鼠基底节区的表达;Iba-1(1∶500,Wako Chemicals)标记小胶质细胞,GFAP(1∶500,Sigma)标记星形胶质细胞。镜下观察细胞形态,计数每个视野阳性细胞。
另取脑组织切片在1%甲苯胺蓝溶液中浸泡5 min,蒸馏水轻轻冲洗3~5 min,分别以75%、95%、100%的乙醇逐级脱水后,二甲苯透明,中性树胶封固后甲苯胺蓝染色神经元。
1.3 明胶凝胶酶谱法测定基质金属蛋白酶(MMP)-2和MMP-9活性脑组织加裂解缓冲液,超声匀浆,4℃离心20 min(10 000 rpm),提取上清液总蛋白,应用Gelatine-Sepharose 4B (Amersham,GE healthcare,Munchen,Germany) 吸附纯化MMPs;明胶酶谱法凝胶电泳。凝胶在含2.5% Triton X-100洗涤缓冲液下孵育,然后在孵育缓冲液中37℃孵育24 h,用Coomassie蓝R-250染色30 min后,凝胶用5%醋酸和25%甲醇脱色至清晰条带显现,在蓝色背景上显示明胶分解。混合鼠MMP-2和MMP-9标准品作为阳性对照。用Image J灰度半定量测定MMP-2和MMP-9活性。
1.4 统计学处理采用SPSS 17.0统计软件进行统计学处理,计量资料数据采用
对照组小鼠基底节神经元数量为71.05±2.06,糖尿病组为58.07±4.67,较对照组减少(P=0.000 97);而糖尿病+LPS组小鼠基底节神经元数量为41.30±1.99,较糖尿病组减少,两组差异具有统计学意义(
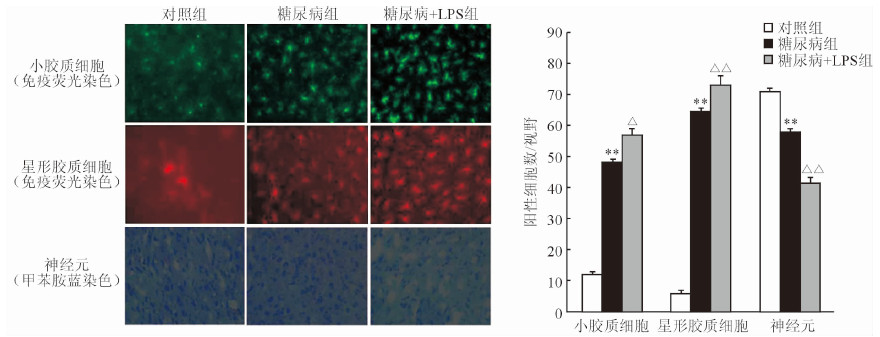
|
图 1 各组小鼠小胶质细胞、星形胶质细胞及神经元形态学和定量比较 免疫荧光染色(Original magnification: ×300)和甲苯胺蓝染色(Original magnification: ×200). LPS: 脂多糖. **x± s 与对照组比较; △P < 0.05, △△x± s 与糖尿病组比较. 小胶质细胞: n=5; 星形胶质细胞: n=5; 神经元: n=6. x± s |
明胶底物凝胶酶谱法检测小鼠脑组织MMP-2和MMP-9活性,结果显示糖尿病组和糖尿病+LPS组小鼠MMP-9较对照组明显活化,糖尿病组小鼠MMP-9活性为8.52±1.85,糖尿病+LPS组为14.69±1.02,两组差异有统计学意义(P=0.025 6)。 而糖尿病与糖尿病+LPS组两组MMP-2活性差异没有统计学意义(P=0.945,图 2)。
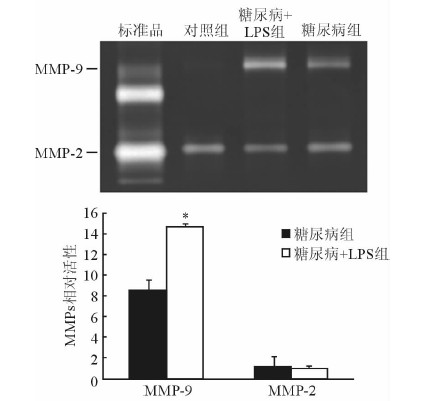
|
图 2 明胶底物凝胶酶谱法检测MMP-2、MMP-9活性 LPS: 脂多糖; MMP: 基质金属蛋白酶. *P < 0.05与糖尿病组比较. n=4, x± s |
免疫荧光染色结果显示对照组小鼠脑组织Occludin在基底节沿微血管处表达(图 3A),糖尿病组小鼠Occludin表达减少(图 3B),而糖尿病+LPS组小鼠基底节Occludin表达减少更加明显(图 3C)。
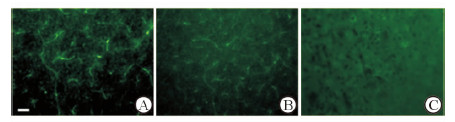
|
图 3 免疫荧光检测BBB紧密连接蛋白Occludin在小鼠基底节区表达情况 A: 对照组; B: 糖尿病组; C: 糖尿病+LPS组. LPS: 脂多糖; BBB:血脑屏障. Bar=30 μm |
BBB是维持脑内环境稳定的重要结构,近年来研究发现BBB是一个动态的过程,维持和调节脑部平衡和代偿系统循环波动,并增加脑内代谢功能。一些中枢神经系统疾病,如阿尔茨海默病、帕金森病、癫癎 、卒中等多种疾病,能破坏BBB结构完整性,导致神经变性[3, 4]。钆增强MRI和CT灌注扫描显示糖尿病患者BBB通透性增加[5],提示高血糖可以导致BBB破坏。高血糖导致BBB损害各个部位并不一致,中脑最先受累,而后是海马、皮质和基底节[6]。这种区域变化表明BBB不是完全统一的屏障,而是通过复杂的全脑和局部因素来调节的。Occludin主要表达于中枢神经系统内皮细胞[7],本研究显示高血糖时Occludin表达明显减少,糖尿病小鼠基底节神经元变性,数量减少,提示糖尿病时存在BBB损害,可能参与继发性基底节神经元变性。MMPs能够降解毛细管基膜和紧密连接蛋白,导致BBB损害,以往研究证实MMPs激活是BBB破坏的关键因素[8]。本研究显示高血糖通过活化MMP-9参与BBB损伤;此外,高血糖还可以激活小胶质细胞和星形胶质细胞,这些激活的炎性细胞形态发生改变,并可分泌多种细胞因子如肿瘤坏死因子(TNF)-α、白介素1(IL-1)等;这些细胞因子又可激活小胶质细胞,形成“病理级联”,使其释放大量炎症因子致使神经元变性[9]。
系统性炎症反应可以加剧中枢神经变性。临床观察发现系统性感染和应激,如急性败血症和手术可能导致老年患者持久性认知功能和运动功能的减退[10]。Huh等[11]研究发现,中脑黑质区域对炎性介导的神经变性过程较为敏感,小胶质细胞的激活发生在帕金森病发生、发展的各个阶段中,较其他神经变性疾病有更为重要的作用。基底节小胶质细胞对炎症反应非常敏感,立体定向注射LPS至黑质或纹状体内,可以导致小胶质细胞活化和多巴胺神经元变性,促炎性细胞因子如IL-1β、 TNF-α和IL-6等表达增高,并表现类似帕金森病的症状[12]。最近研究也证实LPS诱导的系统性炎症可以导致小胶质细胞活化和多巴胺能神经元变性[13]。本实验结果显示,LPS诱导系统性炎症时,糖尿病小鼠基底节小胶质细胞活化数量明显增加,MMP-9活性也显著增加,而Occludin表达进一步减少,表明系统性炎症可能通过激活MMP-9、破坏BBB、加重高血糖导致基底节病理损伤过程。
综上所述,本研究证实高血糖可以激活基底节小胶质细胞和星形胶质细胞,活化MMP-9,引起BBB破坏,导致基底节神经元变性。而系统性炎症可以加重这一病理过程,提示一些可治的炎症因素参与基底节神经元变性,抑制过度的神经炎症反应可能有助于保护BBB和防止中枢神经系统损害,为糖尿病患者中枢神经系统并发症和神经变性疾病的防治提供新的方法。
| [1] | Oh S H, Lee K Y, Im J H, Lee M S. Chorea associated with non-ketotic hyperglycemia and hyperintensity basal ganglia lesion on T1-weighted brain MRI study: a meta analysis of 53 cases including four present cases[J]. J Neurol Sci, 2002, 200(1-2): 57-62. |
| [2] | Wang J H, Wu T, Deng B Q, Zhang Y W, Zhang P, Wang Z K. Hemichorea-hemiballismus associated with nonketotic hyperglycemia: a possible role of inflammation[J]. J Neurol Sci, 2009, 284(1-2): 198-202. |
| [3] | Tajes M, Ramos-Fernández E, Weng-Jiang X, Bosch-Morató M, Guivernau B, Eraso-Pichot A, et al. The blood-brain barrier: structure, function and therapeutic approaches to cross it[J]. Mol Membr Biol, 2014, 31: 152-167. |
| [4] | Montagne A, Barnes S R, Sweeney M D, Halliday M R, Sagare A P, Zhao Z, et al. Blood-brain barrier breakdown in the aging human hippocampus[J]. Neuron, 2015, 85: 296-302. |
| [5] | Iwata A, Koike F, Arasaki K, Tamaki M. Blood brain barrier destruction in hyperglycemic chorea in a patient with poorly controlled diabetes[J]. J Neurol Sci, 1999, 163: 90-93. |
| [6] | Bartels A L, Kortekaas R, Bart J, Willemsen A T, de Klerk O L, de Vries J J, et al. Blood-brain barrier P-glycoprotein function decreases in specific brain regions with aging: a possible role in progressive neurodegeneration[J]. Neurobiol Aging, 2009, 30: 1818-1824. |
| [7] | Richard D. The blood-brain barrier in health and disease[J]. Ann Neurol, 2012, 72: 648-672. |
| [8] | Birgit O, Daneman R, Ransohoff R M. Development, maintenance and disruption of the blood-brain barrier[J]. Nat Med, 2013, 19: 1584-1596. |
| [9] | Levesque S, Wilson B, Gregoria V, Thorpe L B, Dallas S, Polikov V S, et al. Reactive microgliosis: extracellular micro-calpain and microglia-mediated dopaminergic neurotoxicity[J]. Brain, 2010, 133(Pt 3): 808-821. |
| [10] | Iwashyna T J, Ely E W, Smith D M, Langa K M. Long-term cognitive impairment and functional disability among survivors of severe sepsis[J]. JAMA, 2010, 304: 1787-1794. |
| [11] | Huh S H, Chung Y C, Piao Y, Jin M Y, Son H J, Yoon N S, et al. Ethyl pyruvate rescues nigrostriatal dopaminergic neurons by regulating glial activation in a mouse model of Parkinson's disease[J]. J Immunol, 2011, 187: 960-969. |
| [12] | Liu M, Bing G. Lipopolysaccharide animal models for Parkinson's disease[J]. Parkinsons Dis, 2011, 2011: 327089. |
| [13] | Bodea L G, Wang Y, Linnartz-Gerlach B, Kopatz J, Sinkkonen L, Musgrove R, et al. Neurodegeneration by activation of the microglial complement-phagosome pathway[J]. J Neurosci, 2014, 34: 8546-8556. |
 2015, Vol. 36
2015, Vol. 36


