2. 第二军医大学长海医院核医学科, 上海 200433
2. Department of Nuclear Medicine, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
淀粉样变性是细胞外纤维蛋白异常沉积的一种疾病。局限性淀粉样变性可发生于全身任何器官,但最常见的部位为膀胱、气管支气管树、喉部、皮肤[1]。国内外关于局限性气管支气管淀粉样变性的CT表现及鉴别诊断报道较少,极易误诊。因此,本研究回顾性分析7例经病理证实的局限性气管支气管淀粉样变性的CT表现资料,以提高对该病的诊断水平。
1 资料和方法 1.1 一般资料本组患者7例,男5例,女2例,年龄32~69岁,中位年龄46岁。临床表现为呼吸困难、活动后气急、反复发热、咳嗽、咯血等症状。7例均经病理组织学检查证实为淀粉样变性,且经蛋白电泳、 自身免疫指标等临床检查后均未发现系统性淀粉样变性证据。1例就诊于耳鼻喉科,行气管切开+气管淀粉样变切除术+气管狭窄整复+T管植入术,6例就诊于呼吸内科,行环磷酰胺冲击治疗。患者基本临床资料见表 1。
|
|
表 1 7例患者基本临床资料 |
所有患者均取仰卧位、双臂上举,16层及以上机型完成扫描,范围包括肺尖至肺底全部区域,两侧包括胸壁、腋窝。扫描参数:120 kV,150 mA,扫描层厚5 mm,重建间隔5 mm。均行CT平扫并曲面重建后处理。评价内容:由两位资深医师共同回顾性观察CT图像上病灶部位、特点,分布方式及优势壁,管腔内有无软组织结节,管壁是否钙化及其他伴随征像。
2 结 果 2.1 病灶的CT表现气管支气管黏膜下斑块7例(气管支气管型),其中2例气管腔内见软组织结节(气管支气管型混合管腔内结节型,图 1A)。7例均表现为气管壁弥漫增厚伴不同程度管腔狭窄;7例气管均无软化,3例气管黏膜下斑块呈环形(图 1B),4例气管黏膜下斑块呈不均匀分布,其中2例以气管前壁分布为著(图 1C),1例以右侧壁分布为著(图 1D),1例以前壁及两侧壁分布为著。7例患者中1例未累及支气管,4例累及两侧主支气管伴管腔不同程度狭窄(图 1E),1例仅累及左上叶支气管伴管腔狭窄,1例累及两侧主支气管及广泛分支并管腔不同程度扩张、狭窄(图 1F)。6例黏膜下斑块伴不均匀钙化,1例未见钙化;2例软组织结节未见明显钙化。5例未见肺部伴随征像,2例有肺部伴随征像,其中1例伴左下肺不张,另1例伴两肺弥漫支气管扩张(图 1F)。5例冠状位曲面重建可见“波浪轨道”征像,2例未见。
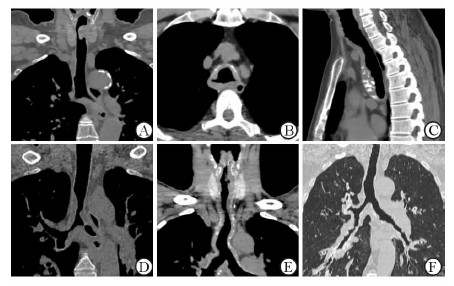
|
图 1 患者病灶的CT影像学特点 A:例1患者曲面重建示气管上段左侧壁密度尚均匀,软组织结节突向腔内;B:例2患者轴位示气管壁环形增厚伴钙化、管腔狭窄;C:例3患者矢状位示气管前壁显著黏膜下斑块伴钙化,前后气管壁呈明显波浪改变;D:例5患者曲面重建示气管右侧壁显著黏膜下斑块,两侧气管壁呈轻度波浪改变;E:例2患者曲面重建示气管、两侧主支气管壁弥漫增厚伴多发钙化及管腔狭窄,两侧管壁呈轻度波浪改变;F:例4患者曲面重建示两肺弥漫支气管狭窄、扩张,两侧气管壁呈波浪改变 |
1例未行支气管镜检查,6例行支气管镜检查。6例均可见气管壁弥漫不规则隆起,管腔不规则狭窄,表面充血,黏膜肿胀(图 2A)。5例可见病变累及两侧各叶段支气管,1例两侧各叶段支气管黏膜正常,管腔通畅,未见狭窄、出血及新生物。
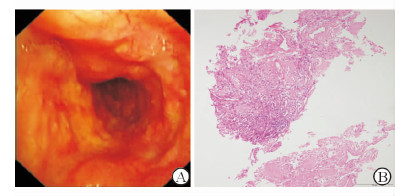
|
图 2 病灶支气管镜下(A)及H-E染色(B)所见 A:气管壁多发不规则隆起,管腔不规则狭窄,表面血管丰富;B:淀粉样物质片块状分布,以血管周围明显,并见少数鳞化的上皮细胞. Original magnification:×200 |
7例均行组织病理学检查,6例经支气管镜活检,1例经手术切除活检。7例镜下均可见破碎或片状分布的红染均匀组织,其间可见血管(图 2B)。6例刚果红染色(+),1例刚果红染色(-);2例PAS(+)。1例可见少数鳞化上皮细胞。
3 讨 论淀粉样变性是一种细胞外纤维蛋白异常沉积性疾病,异常蛋白可沉积于任何组织、器官并导致相应功能失调[1],可原发也可继发于多发性骨髓瘤、慢性感染性疾病等。本病相关CT研究较少,国外学者于1995年描述了2例气管支气管树淀粉样变性的CT表现,1例单发结节和1例弥漫病变[2]。2013年,Li等[3]总结了3例气管支气管树淀粉样变性的CT表现,发现冠状位CT相对于横断位更有早期诊断意义。该病多见于男性[4],本研究男女比例5∶2。从临床的角度,可以把淀粉样变性分为局限性和系统性。本研究患者仅累及呼吸系统,并且没有多发性骨髓瘤等基础疾病,所以均归类于局限性淀粉样变性。根据蛋白纤维亚单位的生化成分可把它分为AL、AA等多个类型,目前发现的淀粉样变性的前体蛋白已经有27种[5],临床上大多数局限性淀粉样变性为AL型[6],其生化分型对系统性淀粉样变性患者的治疗方法的选择有重要意义[1]。 淀粉样变性患者的临床表现完全依赖于病变累及的部位,累及气管支气管的患者一般表现为咳嗽、咯血、喘息、呼吸困难等,与本研究患者的临床表现基本一致;累及喉部可表现为声嘶;累及鼻咽部可表现为鼻塞、嗅觉丧失、听力下降等[7]。
根据不同的CT表现,呼吸系统淀粉样变性表现为4种模式:肺实质结节,间质阴影,气管支气管黏膜下斑块或管腔内结节[8]。呼吸系统淀粉样变性中最常见的就是气管支气管型[4],本组研究病例7例均表现为气管支气管型,其中2例同时可见管腔内结节。在支气管镜下几乎均能见到气管内壁的大小不等结节,其表面光滑及黏膜充血,与牟向东等[7]报道的病例相一致。这些结节是由于不均匀分布于黏膜下层的淀粉样斑块将黏膜层不同程度掀起,即形成了气管腔内多发结节,有些部位斑块沉积特别明显就成了管腔内结节型,但是其表面均较光滑。
气管支气管型淀粉样变性CT平扫表现主要有软组织样密度的淀粉样物质沉积于黏膜下层,气管支气管由于管壁增厚导致狭窄,气管支气管壁钙化,有时伴有支气管扩张、肺不张等并发症,这主要是由于支气管壁增厚、管腔狭窄所致[3, 4],这些表现与本研究结果基本一致。Li等[3]发现淀粉样变性的冠状位CT有特征性“波浪轨道”征像,表现为弥漫息肉样结节突向气管腔及主支气管腔内,本组5例有类似表现。同时Li等[3]认为冠状位CT比横断位CT更能发现早期淀粉样病变,而本研究所运用的冠状位曲面重建技术与冠状位CT相比,能提供更丰富的管壁、管腔情况以帮助诊断,同时为临床医生阅片提供了更直观更生动的方法,值得进一步推广。虽然国内外也有一些病例报道或病例数较少的相关影像学研究[3, 4, 9, 10, 11],但均未见报道黏膜下斑块的分布特征,其可呈环形、前壁为著、侧壁为著、前壁及两侧壁为著的增厚4种类型,可能是淀粉样变性较为特征性的征像,有待扩大病例数进一步对照研究。对于管腔内结节型,有文献归类于气管支气管型的局灶性病变[10],其CT平扫表现为软组织结节向腔内突起,软组织密度尚均匀,与气管壁分界不清,管腔局限性狭窄,不易与气管肿瘤性病变相鉴别,只能通过活检证实。
影像学上气管支气管型淀粉样变性尚需与其他疾病相鉴别。(1)复发性多软骨炎:复发性多软骨炎是由于气管软骨反复的炎症所致,因为气管后壁缺乏软骨结构,所以复发性多软骨炎只累及气管前壁及两侧壁,表现为前壁及两侧壁的增厚,而后壁不增厚,但气管壁黏膜下层各壁均存在,所以本组3例病例可表现为环形增厚。这是与复发性多软骨炎的鉴别要点之一,复发性多软骨炎的病变气管一般伴随气管软化,因此管腔狭窄程度会较淀粉样变性明显一些。这是与淀粉样变性另外1个较重要的鉴别点[11]。临床上此病还可伴发耳郭软骨炎、鼻软骨炎等。(2)骨化性气管支气管病:Kwong等[10]认为骨化性气管支气管病还不确定是否是弥漫淀粉样变性后期后遗症,其CT表现为不规则钙化结节从前壁及两侧壁突向管腔,并被认为是其特征性的表现。(3)溃疡性结肠炎相关的严重慢性气管支气管炎:表现为气管支气管壁的环形增厚,需结合病史加以鉴别[4]。
淀粉样变性只能由组织活检确诊。刚果红染色是诊断淀粉样变性高特异性的技术,特异性几乎达到100%,但是灵敏度偏低,也不能进行蛋白分类。因此,可以联合免疫组化、刚果红荧光来提高灵敏度。刚果红荧光可以探测到少量的淀粉样物质[12]。完整检查以排除系统性淀粉样变性对患者很重要,相对于系统性淀粉样变性,局限性淀粉样变性有相对较好的预后[9]。局限性治疗方式(手术、内镜下治疗)可成功控制疾病,一般无需系统性治疗。
综上所述,任何怀疑气管支气管淀粉样变性的患者均应行胸部高分辨CT扫描及冠状位曲面重建,气管支气管树的淀粉样变性CT平扫具有一定的诊断价值,可以发现病变分布范围、管腔狭窄程度以及一些肺部并发症,如肺不张、支气管狭窄、扩张等,而曲面重建技术在横断位基础上提供了更多的诊断信息,对病变诊断及鉴别诊断具有重要意义。
| [1] | Sideras K, Gertz M A. Amyloidosis[J]. Adv Clin Chem, 2009, 47:1-44. |
| [2] | Sánchez Antua A, García Marrón M, García García J M, Martínez Muiz M A, Sánchez Rodríguez A, Blanco Blanco I. [Localized tracheobronchial amyloidosis. The usefulness of computed tomography][J].Arch Bronconeumol, 1995, 31:540-542. |
| [3] | Li D, Shi Z, Wang Y, Thakur A. Primary tracheobronchial amyloidosis: coronal CT scan may provide clues for early diagnosis[J]. J Postgrad Med, 2013, 59:223-225. |
| [4] | Kirchner J, Jacobi V, Kardos P, Kollath J. CT findings in extensive tracheobronchial amyloidosis[J]. Eur Radiol, 1998, 8:352-354. |
| [5] | Sipe J D, Benson M D, Buxbaum J N, Ikeda S, Merlini G, Saraiva M J, et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of the International Society of Amyloidosis[J]. Amyloid, 2010, 17:101-104. |
| [6] | Pinney J H, Hawkins P N. Amyloidosis[J]. Ann Clin Biochem, 2012, 49:229-241. |
| [7] | 牟向东, 熊 焰, 陈 建, 章 巍, 邱志祥, 胡 艳, 等. 呼吸系统淀粉样变性11例临床分析[J]. 中华结核和呼吸杂志, 2013, 36:88-93. |
| [8] | Zalewska K I, Brown A, McKeon D J. An unusual cause of haemoptysis: isolated tracheobronchial amyloidosis[J].BMJ Case Rep, 2014, 2014. pii: bcr2014205118. |
| [9] | Gilad R, Milillo P, Som P M. Severe diffuse systemic amyloidosis with involvement of the pharynx, larynx, and trachea: CT and MR findings[J]. AJNR Am J Neuroradiol, 2007, 28:1557-1558. |
| [10] | Kwong J S, Muller N L, Miller R R. Diseases of the trachea and main-stem bronchi: correlation of CT with pathologic findings[J].Radiographics, 1992, 12:645-657. |
| [11] | Webb E M, Elicker B M, Webb W R. Using CT to diagnose nonneoplastic tracheal abnormalities: appearance of the tracheal wall[J].AJR Am J Roentgenol, 2000, 174:1315-1321. |
| [12] | Linke R P. Highly sensitive diagnosis of amyloid and various amyloid syndromes using Congo red fluorescence[J]. Virchows Arch, 2000, 436:439-448. |
 2015, Vol. 36
2015, Vol. 36


