2. 重庆医科大学公共卫生与管理学院生殖生物研究室, 重庆 400016
2. Laboratory of Reproductive Biology, School of Public Health, Chongqing Medical University, Chongqing 400016, China
维生素E(vitamin E,VE)普遍存在于生活与生产环境中,天然VE广泛存在于各种油料种子及植物油中,是重要的强抗氧化剂。研究表明,VE是哺乳动物细胞膜上清除自由基的首要因子,其抗氧化作用主要通过限制超氧化物的生成和降低超氧化物水平而发挥,在细胞抗氧化机制中发挥关键作用[1]。苯并[a]芘(benzo[a]pryene,B[a]P)是生产和生活环境中极为常见的污染物,具有明确的神经毒性及潜在致畸性或致癌性[2],其对细胞的凋亡作用主要通过氧化应激而实现。Zhang等[3]研究认为,人群长期暴露于B[a]P环境可引起认知功能及神经行为功能降低。此外,动物实验表明,B[a]P 染毒可造成小鼠学习记忆能力下降,而海马与学习记忆能力密切相关,其功能损害会造成学习记忆功能障碍[4]。
尽管对于B[a]P相关研究已有数年,但对其所致的神经毒性的拮抗剂研究鲜有报道。VE是生活中常见的强抗氧化剂,可能对B[a]P所致的神经毒性有拮抗作用,但并未见相关报道。本研究拟通过建立B[a]P亚慢性染毒大鼠模型,探究VE对B[a]P所致海马神经毒性的影响,为职业卫生提供劳动保护的科学依据。
1 材料和方法 1.1 主要仪器和试剂Morris水迷宫(北京硕林苑科技有限公司);VE(纯度98%)、B[a]P标准品(纯度99%),由Sigma公司提供;花生油、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS) 试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、氧化型谷胱甘肽(oxidized glutathione,GSSG)试剂盒及丙二醛(malonaldehyde,MDA)试剂盒均购于南京建成生物工程研究所。
1.2 实验动物及处理 60只21日龄健康SD雄性大鼠,由重庆医科大学动物实验中心提供[许可证号:SCXK(渝)2013-0001],体质量40~50 g。大鼠采用全营养饲料及自来水喂养,自由采食。动物房保持12 h/12 h光/暗周期,人工控温18~28℃,相对湿度40%~80%。大鼠喂养1周后随机分为6组,每组10只,分别为空白对照组(不做处理)、溶剂对照组(等量植物油)、B[a]P(5 mg/kg)组、VE低剂量组[VE(10 mg/kg)+ B[a]P(5 mg/kg)]、VE中剂量组[VE(50 mg/kg)+ B[a]P(5 mg/kg)]、VE高剂量组[VE(100 mg/kg)+ B[a]P(5 mg/kg)]。各组每天按各自剂量给予灌胃处理30 d。实验过程中每天记录大鼠体质量变化,观察饮食、活动等一般情况及神经系统反应。
1.3 学习记忆能力测试连续灌胃30 d后,从每组中随机选取5只大鼠采用Morris水迷宫实验检测学习记忆能力。 定位航行实验:历时4 d,每天将大鼠面向池壁分别从4个入水点放入水中,观察记录其到达平台的时间(逃避潜伏期)及有效搜索策略百分比。空间搜索试验:在第4天最后一次定位航行实验后撤除平台,然后任选一个入水点将大鼠放入水池中,记录其游泳轨迹,包括跨过平台相应位置的潜伏期以及120 s内跨过平台相应位置的次数和在原平台象限停留的时间,考察大鼠对原平台的记忆。
1.4 海马组织H-E染色行为学实验后,大鼠经10%水合氯醛腹腔麻醉后颈椎脱臼处死,剥离脑组织后迅速分离海马(切取1 mm×1 mm×1 mm海马组织块),将其置于1.33 mol/L多聚甲醛液中固定3~4 h后常规脱水、透明、浸蜡包埋制作石蜡切片(切片厚10 μm),贴附于多聚赖氨酸预处理过的载玻片上,H-E染色,封片,光镜观察并照相。
1.5 脂质氧化应激指标检测灌胃结束后,将每组剩余的大鼠按1.4项下方法分离双侧海马组织,用4℃预冷的生理盐水洗净血液,吸干水分并称质量,加9倍体积的预冷生理盐水,匀浆,160×g离心15 min,取上清液,按试剂盒说明测定SOD、GSH-Px、γ-GCS活性及MDA、GSH、GSSG含量。
1.6 统计学处理采用SPSS 19.0统计软件对实验数据进行统计分析,结果以x±s 表示,多组间比较采用单因素或者重复测量方差分析,组间两两比较用LSD法。检验水准(α)为0.05。
2 结 果 2.1 大鼠一般表现B[a]P组及VE低剂量组个别大鼠出现食物消耗减少、活动能力下降、体质量增长迟缓等情况,随着染毒时间的延长出现以上情况的大鼠逐渐增多,表现也逐渐明显。对照组及VE中、高剂量组大鼠未见明显异常改变。
2.2 B[a]P对大鼠空间学习记忆能力的影响 2.2.1 水迷宫定位航行实验结果显示,随训练天数的增加,各组大鼠平均逃避潜伏期呈下降趋势,差异有统计学意义(P < 0.01)。第1天各组间逃避潜伏期差异无统计学意义;第2、3、4天,B[a]P组平均逃避潜伏期均高于对照组和VE各剂量组(P < 0.01);相对于B[a]P组,VE各剂量组随VE剂量的增高,平均潜伏期缩短,差异有统计学意义(P < 0.01),且第3、4天VE高剂量组平均潜伏期与空白对照组、溶剂对照组差异均无统计学意义。见表1。
|
|
表 1 各组大鼠Morris水迷宫平均逃避潜伏期 Tab 1 Average escape latency of rats in Morris water maze |
B[a]P组大鼠跨平台次数和在原平台象限停留时间较对照组和VE各剂量组均降低,差异有统计学意义(P < 0.01);随着VE剂量的增加,大鼠跨平台次数和在原平台象限停留的时间呈上升趋势,差异有统计学意义(P < 0.01);且VE高剂量组与空白对照组和溶剂对照组比较,跨平台次数和在原平台象限停留时间差异均无统计学意义。见表2。
|
|
表 2 各组大鼠水迷宫跨台次数和在原平台象限停留时间 Tab 2 Cross-platform times and residence timeon the platform of rats in Morris water maze |
H-E染色光镜观察发现,空白对照组神经元细胞数目正常,且正常神经细胞数目较多,细胞排列紧密,形态正常,胞核呈圆形或椭圆形,清晰(图1A)。溶剂对照组海马形态(图1B)和空白对照组相比无明显差别。而B[a]P组大鼠海马体神经元细胞排列紊乱,数量明显减少,细胞间隙大,大量细胞核深染、变形、固缩,部分出现细胞核溶解(图1C)。VE各剂量组随着VE剂量的增加,细胞数目逐渐增多,间隙逐渐减小,排列逐渐整齐,深染细胞核数逐渐减少,细胞损伤明显改善(图1D~1F)。
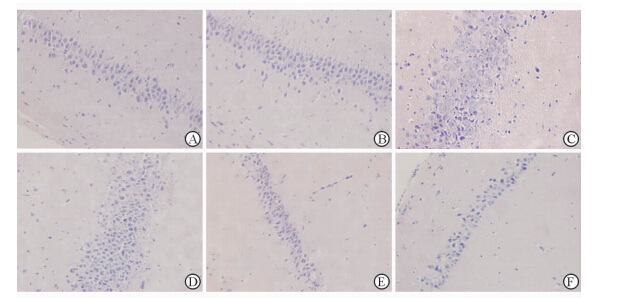
|
图 1 H-E染色观察海马细胞形态变化 Fig 1 H-E staining showing the morphological change of rat hippocampus in each group A: Blank control group; B: Vehicle group; C: B[a]P exposed group; D: VE low-dose treatment group; E: VE medium-dose treatment group; F: VE high-dose treatment group. B[a]P: Benzo[a]pryene; VE: Vitamin E. Oringinal magnification: ×400 |
与对照组相比,B[a]P组的SOD、GSH-Px、γ-GCS活性以及GSH、GSSG含量均下降,MDA含量增加,差异具有统计学意义(P < 0.01);与B[a]P组相比,VE各剂量组随VE剂量的增加SOD、GSH-Px、γ-GCS活性以及GSH、GSSG含量均上升,MDA含量下降,差异具有统计学意义(P < 0.01),且VE高剂量组MDA含量与空白对照组和溶剂对照组差异均无统计学意义(表3)。
|
|
表 3 各组大鼠氧化应激指标比较 Tab 3 Oxidative stress parameters in rats of each group |
近年来,对B[a]P所致的神经毒性及神经发育毒性已有大量的报道。Qiu等[5]证实了B[a]P暴露可损害SD大鼠的学习记忆能力等神经系统功能,即B[a]P具有肯定的神经毒性作用,可对运动、认知、情感、反应等多方面神经功能产生影响。本研究采用Morris水迷宫检测各组大鼠学习记忆能力,并采用H-E染色观察大鼠海马神经细胞形态学改变,从而了解B[a]P的神经毒性作用。
Morris水迷宫实验结果显示表明,B[a]P处理组平均逃避潜伏期高于对照组和VE各剂量组;而大鼠跨平台次数和在原平台象限停留时间较对照组和VE各剂量组降低,提示B[a]P对大鼠的学习记忆功能有损害作用,与李金艳等[6]报道基本一致。B[a]P对动物神经组织的损伤兼具凋亡和坏死两种特征,神经细胞形态学结果显示,前者出现了核周与核深染、变形、固缩等,后者少数出现胞浆空泡变性,两者中以凋亡的特征更为普遍和明显。通过对B[a]P组海马体神经细胞H-E染色光镜观察,发现其数量减少、排列稀疏、核变小、部分出现固缩等,表明了B[a]P的神经毒性。
VE是生活中常见的强抗氧化剂,在细胞抗氧化机制中起着关键的作用[1]。Morris水迷宫实验结果显示,相对于B[a]P组,随VE的剂量增高大鼠平均潜伏期缩短,跨平台次数和在原平台象限停留的时间呈上升趋势,提示VE对B[a]P所造成的神经毒性有拮抗性。在定位航行实验第3、4天时,当VE剂量增至100 mg/kg时,即VE高剂量组的平均潜伏期与对照组差异无统计学意义;在空间搜索试验中,VE高剂量组在跨平台次数和在原平台象限停留时间2个指标上也出现与对照组差异无统计学意义的现象,表明随着VE剂量增加其对毒性拮抗作用的效果增强,且在剂量值达到100 mg/kg时,VE的保护性几乎可完全拮抗B[a]P所产生的亚慢性神经毒性作用。VE的安全拮抗范围将在今后的研究中进一步加以探讨。此外,H-E染色结果发现,随着VE剂量增加,海马神经细胞损伤减小,细胞数目、形态逐渐恢复正常,提示VE对B[a]P所致的神经细胞损伤有拮抗作用。
在B[a]P所致细胞损伤中,初巍巍等[7]认为氧化应激是其诱导细胞凋亡的主要途径。GSH是组织细胞内重要的调节代谢剂和抗氧化剂,其含量与GSH-Px活性密切相关[8];而γ-GCS作为GSH合成过程中的限速酶,γ-GCS活性的升高可使GSH合成加速,从而提高细胞内外GSH的浓度。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,能特异地催化GSH对过氧化物的还原反应,其主要作用是清除脂类氢过氧化物,从而保护细胞膜结构和功能的完整性;SOD是清除机体内氧自由基的首要因子,是抗氧化酶系统的重要组成部分,它们的活性反映机体组织抗氧化能力[9, 10, 11];而膜脂过氧化物产物MDA的含量增加可以直接反映自由基生成增多[12, 13]。本研究氧化-抗氧化指标提示,B[a]P组的SOD、GSH-Px、γ-GCS活性及GSH、GSSG含量较对照组均下降,MDA含量增加,表明B[a]P对氧化-抗氧化指标有影响,这与Liang等[14]报道基本一致;而相较于B[a]P组,VE各剂量组随VE剂量增加,SOD、GSH-Px、γ-GCS活性及GSH、GSSG含量均上升,MDA含量下降,且VE高剂量组MDA含量与对照组差异无统计学意义,表明VE对B[a]P所致海马氧化损伤有拮抗作用,进一步证实了行为学实验结果。
综上所述,本实验进一步证明了B[a]P的神经毒性,通过改变海马氧化应激水平,降低海马中抗氧化酶活性,增加氧化物质含量,导致相应的海马神经细胞损伤,致使大鼠学习记忆能力受损。而VE能对B[a]P所致的海马神经损伤有一定程度的保护作用,保护机制途径可能与提高抗氧化酶活力、降低氧化物质含量、减轻海马体神经细胞损伤等有关,从而减轻对学习记忆能力的损伤。
| [1] | 李军生, 邹义英.维生素E作用机制研究新进展[J].中国医院药学杂志, 2005, 25: 556-558. |
| [2] | 陈承志, 汤 艳, 蒋学君, 涂白杰.苯并[a]芘对大鼠学习记忆及海马神经元影响[J].中国公共卫生, 2011, 27: 608-610. |
| [3] | Zhang H, Nie J, Li X, Niu Q. Association of aryl hydrocarbon receptor gene polymorphism with the neurobehavioral function and autonomic nervous system function changes induced by benzo[a]pyrene exposure in coke oven workers [J]. J Occupa Environmental Med, 2013, 55: 265-271. |
| [4] | 汤 艳, 陈承志, 郭庆喜, 戚友斌, 涂白杰. 14C-苯并(a)芘在大鼠海马中的分布及对海马神经元的损害[J].环境与职业医学, 2011, 28: 141-143. |
| [5] | Qiu C Y, Cheng S Q, Xia Y Y, Peng B, Tang Y, Tu B J. Effects of subchronic benzo(a)pyrene exposure on neurotransmitter receptor gene expression in the rat hippocampus related with spatial learning and memory change [J]. Toxicology, 2011, 289(2-3):83-90. |
| [6] | 李金艳, 常珊珊, 袁晋峰, 王 鑫, 蒋 勇, 郑金平.亚慢性染毒B[a]P与大鼠海马细胞凋亡及学习记忆损伤的关系[J].环境与职业医学, 2012, 29: 118-121. |
| [7] | 初巍巍, 霍 阳, 陈 悦, 宋 涛, 赵跃萍, 王 莉. 苯并芘氧化损伤鼠肺泡细胞及维生素E对其保护作用的机制研究[J]. 解放军医药杂志, 2013, 25: 66-68. |
| [8] | 沈梅红, 李 成, 李忠仁. 电针对脑缺血再灌注模型大鼠的GSH含量、GSH-Px及GR活性的影响[J]. 南京中医药大学学报, 2011, 27: 137-139. |
| [9] | 房 群, 马爱国, 孙永叶. 大剂量维生素E补充对大鼠抗氧化能力和红细胞膜流动性无明显改善作用[J]. 医学信息, 2011, 24: 4-5. |
| [10] | 李 斐, 赵 瑛. 津力达颗粒对糖尿病大鼠海马组织的保护作用[J]. 第二军医大学学报, 2013, 34: 137-141. Li F, Zhao Y. Protective effect of Jinlida granules on hippocampus of diabetic rats[J]. Acad J Sec Mil Med Univ, 2013, 34: 137-141. |
| [11] | 邰 贺, 王 丹, 梁 艳, 戴 红, 陈亚琼. 苯并芘氧化损伤胎盘组织作用机制及维生素E防护作用探讨[J]. 临床误诊误治, 2013, 26: 94-96. |
| [12] | 初巍巍, 霍 阳, 王 莉, 陈 悦, 宋 涛, 赵跃萍.黄芪注射液对苯并芘损伤的肺泡组织氧化相关物质的影响[J].临床误诊误治, 2013, 26: 90-92. |
| [13] | 李 明, 严律南. 益生注射液抗大鼠移植心慢性失功加快模型的实验研究[J]. 重庆医科大学学报, 2011, 36: 294-297. |
| [14] | Liang X, Tang Y, Duan L, Cheng S Q, Luo L, Cao X, et al. Adverse effect of sub-chronic exposure to benzo(a)pyrene and protective effect of butylated hydroxyanisole on learning and memory ability in male Sprague-Dawley rat [J]. J Toxicol Sci, 2014, 39: 739-748. |
 2015, Vol. 36
2015, Vol. 36


