2. 复旦大学附属公共卫生临床中心科学研究部, 上海 202508
2. Department of Scientific Research, Public Health Clinical Center Affiliated to Fudan University, Shanghai 202508, China
呼吸道病毒感染是引起哮喘急性发作与加重的主要原因,近80%的儿童哮喘急性发作或加重与呼吸道病毒感染有关[1]。呼吸道合胞病毒(respiratory syncytial virus,RSV)是一种RNA病毒,属于副黏病毒科,是小儿呼吸道感染最重要的病原之一。RSV感染与哮喘的发作存在明显的相关性[2]。流行病学研究提示婴幼儿期RSV感染不仅是哮喘发生的危险因素,还是导致哮喘病情加重甚至死亡的重要原因。研究表明RSV感染对哮喘病理生理变化的影响受感染的时间、量以及气道免疫炎症本身状态影响,但由于缺乏标准化的疾病动物模型,目前有关RSV参与哮喘气道炎症的机制仍存在较多争议[3, 4, 5]。本实验成功建立了哮喘合并RSV感染的BALB/c小鼠模型,从气道功能及炎症变化角度探讨了RSV感染在哮喘病理机制中的作用。
1 材料和方法 1.1 实验动物6~8周龄雄性BALB/c小鼠(SPF级)30只,平均体质量(20±2) g,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2013-0016],实验在生物安全2级实验室进行。
1.2 主要试剂卵清蛋白(OVA,Ⅴ级),美国Sigma公司。氢氧化铝,分析纯,美国Sigma公司,批号:030M1549。RSV A2 株,ATCC;喉癌细胞Hep-2,中国科学院上海细胞库。戊巴比妥钠、乙酰甲胆碱(Mch),上海化学试剂公司;H-E、PAS、VG染色液,上海化学试剂公司。切片机,德国 Leica 公司;超声雾化器,上海鱼跃医疗设备有限公司,型号:402AI;显微镜,德国Leica公司,型号:DFC320。小鼠动物呼吸机,Buxco RC 系统,美国 Buxco公司。
1.3 病毒的细胞培养Hep-2 细胞在含10%胎牛血清的DMEM中培养,培养箱条件为37℃、5% CO2,细胞铺满单层后,将RSV接种于Hep-2 细胞。 继续在原条件下的维持液中培养,3~5 d 即可出现细胞病变,待病变达100%时收获病毒。参照臧娜等[6]的方法,采用空斑试验测定病毒滴度,以空斑形成单位(PFU) 表示,取1×106 PFU病毒冻存于-80℃冰箱中,反复冻融2次,离心后取上清备用。
1.4 哮喘动物模型的建立及分组30只BALB/c 小鼠随机分为3组,每组10只。参照并改良Sun等[7]的方法建立哮喘模型: OVA/RSV组分别于第1、7、14 天腹腔注射OVA 致敏液0.2 mL[OVA 20 μg+氢氧化铝 2 mg,溶于PBS,pH 7.2],休息1周,第21天起将实验小鼠置于特制的容器中,以1%OVA(Ⅴ级)溶液30 mL雾化吸入,每日1 次,每次30 min,连续雾化激发7 d,雾化过程中出现了较明显的头面抓痒、前肢缩抬、弓背、呼吸加深加快、安静少动等哮喘急性发作症状;第29、31 天隔日予相同上述OVA雾化;第28、30、32天隔日给予浓度1×106 PFU、体积50 μL/次,将RSV鼻腔滴入,共3次。OVA组致敏、激发同OVA/RSV组,PBS鼻腔滴入,激发频次、时间同上。空白组以PBS代替OVA致敏、激发和PBS鼻腔滴入,激发频次、时间同上。
1.5 支气管肺泡灌洗液(BALF)的细胞学变化每次注入1 mL预冷无菌PBS液,按0.4、0.3、0.3 mL反复灌洗3次,回收BALF,2 000×g离心5 min,细胞沉淀用1 mL PBS液重悬后进行检测。
1.6 小鼠肺组织病理学变化的观察取各组小鼠的肺组织,经固定、脱水、包埋、切片后,按操作常规行H-E、PAS、VG染色,分别观察气道周围嗜酸粒细胞、气道黏液分泌物及气道周围胶原增生的变化。
1.7 小鼠气道阻力测定每只小鼠腹腔注射0.5~0.8 mL 1.5%戊巴比妥钠麻醉后,平放于试验台,以Y型管作为气管插管,一端连接动物微型呼吸机,另一端连接生理记录仪,记录气管内压力的变化。待呼吸平稳后,以0.04 mg/mL磷酸组胺溶液雾化吸入,依次在30、60、120、120、120 s喷入后记录气管内压力;在60 s喷入生理盐水作为对照,作标准曲线作为对照。在小鼠一侧静脉置入特制的静脉插管,依次给予3.125、6.25、12.50 mg/L Mch,每次间隔4 min,观察给药后小鼠气道阻力变化。
1.8 统计学处理采用SPSS 18.0软件进行统计学分析,计量资料以 x±s 表示,组间行t检验;计数资料采用χ2检验。检验水准(α)为0.05。
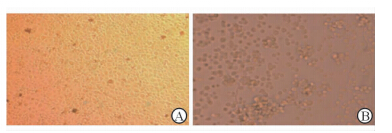
2 结 果 2.1 RSV 与Hep-2 细胞孵育后的变化感染前Hep-2细胞贴壁生长,形成单层细胞时镜下可见细胞铺满底壁,排列规则紧密,互相嵌合成多边形,呈铺路石状;RSV A2感染细胞后,出现典型的融合病变,镜下可见细胞边界不清,病变细胞相互融合呈“多核巨细胞”的合胞体(图1)。
|
图 1 RSV 与Hep-2 细胞孵育后的变化 Fig 1 Changes of Hep-2 cells after treatment with RSV A: Hep-2 cells; B: Syncytium. RSV: Respiratory syncytial virus. Original magnification: ×100 |
与空白组相比,OVA组和OVA/RSV组小鼠BALF中嗜酸粒细胞比例(EOS%)升高(P < 0.05,P < 0.01),OVA/RSV组与OVA组相比亦升高,差异有统计学意义(P < 0.05)。见表1。
|
|
表 1 各组小鼠BALF的炎症细胞变化 Tab 1 Changes of inflammatory cells in bronchial alveolar lavage fluid (BALF) in mice of different groups |
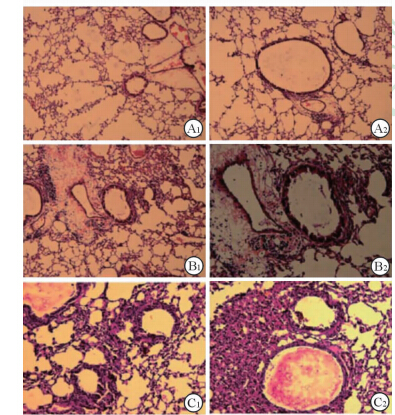
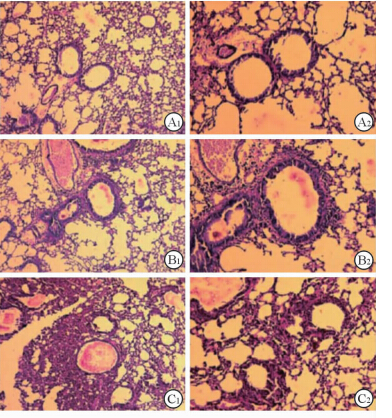
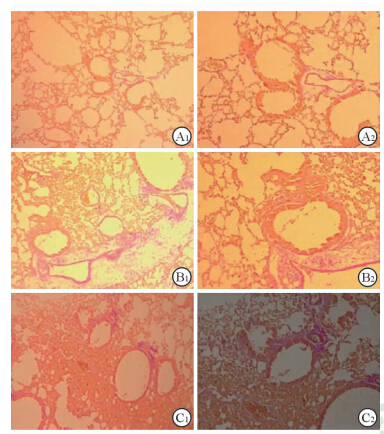
空白组小鼠肺间质无炎性细胞浸润,肺泡壁光滑,毛细血管无扩张,气道无黏液分泌物,气道周围胶原无增生(图2A1、2A2、3A1、3A2、4A1、4A2)。OVA组小鼠肺间质已有炎性细胞浸润,气道可见黏液分泌物,气道周围可见胶原增生(图2B1、2B2、3B1、3B2、4B1、4B2)。OVA/RSV组小鼠肺组织出现典型间质性肺炎表现,肺泡腔明显狭窄,炎性细胞浸润明显,毛细血管扩张充血,气道可见明显黏液分泌物,气道周围胶原增生明显(图2C1、2C2、3C1、3C2、4C1、4C2)。
|
图 2 各组小鼠气道周围嗜酸粒细胞(EOS)浸润情况(H-E染色) Fig 2 Peripheral airway eosinophils (EOS) infiltration in mice of different groups (H-E staining) A1,A2: Control group; B1,B2:OVA group; C1,C2: OVA/RSV group. OVA:Ovalbumin; RSV: Respiratory syncytial virus. Original magnification: ×100(A1,B1,C1),×200(A2,B2,C2) |
|
图 3 各组小鼠气道黏液分泌情况(PAS染色) Fig 3 Airway mucus secretion in mice of different groups (PAS staining) A1,A2: Control group; B1,B2: OVA group; C1,C2: OVA/RSV group. OVA: Ovalbumin; RSV: Respiratory syncytial virus. Original magnification: ×100(A1,B1,C1),×200(A2,B2,C2) |
|
图 4 各组小鼠气道周围胶原增生情况(VG染色) Fig 4 Airway collagen hyperplasia in mice of different groups (VG staining) A1,A2: Control group; B1,B2:OVA group; C1,C2: OVA+RSV group. OVA:Ovalbumin; RSV: Respiratory syncytial virus. Original magnification:×100(A1,B1,C1),×200(A2,B2,C2) |
与空白组相比,OVA组和OVA/RSV组小鼠的气道阻力增高(P < 0.05,P < 0.01),OVA/RSV组与OVA组相比亦升高,差异有统计学意义(P < 0.05,表2)。
|
|
表 2 各组小鼠气道阻力变化情况 Tab 2 Changes of airway resistance in mice of different groups |
哮喘是一种以慢性气道炎症为特征的异质性疾病,具有喘息、气促、胸闷和咳嗽等呼吸道症状,伴有可变的呼气气流受限,呼吸道症状和强度可随时间变化[8]。近年来,世界各国儿童哮喘的患病率总体上仍在上升,尤其是年幼儿童[9, 10]。我国流行病学调查研究结果显示,儿童哮喘的患病率呈显著上升趋势[11, 12, 13, 14],严重威胁儿童的健康。RSV是引起全球婴幼儿下呼吸道感染的首要病毒,几乎所有儿童在2岁之前均至少感染过1次RSV[15];儿童年龄越小,感染RSV后的病情越重,且容易再次感染[16]。也有研究表明,RSV可以导致哮喘急性发作且发生严重喘息并发症[17]。
研究RSV导致哮喘急性发作并加重喘息的病理机制关键环节之一是如何成功复制RSV感染的哮喘动物模型。哮喘是一种以嗜酸粒细胞浸润为特征的气道炎症性疾病,既往主要以肺组织中嗜酸粒细胞明显浸润来判断哮喘模型建立成功,但嗜酸粒细胞性支气管炎却无气道高反应性[5],所以BALF中嗜酸粒细胞比例的增加并不能完全判断哮喘模型建立,气道高反应性是判断哮喘模型建立的重要指标,鼠肺功能仪是目前检测小鼠气道高反应性的金指标[18]。本实验采用Buxco RC系统测定气道阻力[19, 20],该系统为有创小鼠肺功能检测仪,通过定量组胺类药物进行小鼠气道激发,其气道压力和气流信号经Buxco应用软件处理后输出数据,该检测的小鼠气道高反应性结果可靠。
用OVA致敏和雾化激发可以成功建立哮喘模型[7, 21, 22]。OVA 致敏剂量及级别各不相同:大多剂量10~100 μg,级别为Ⅲ~Ⅴ级。本实验采用OVA(Ⅴ级)20 μg致敏和1% OVA(Ⅴ级)雾化激发,结果显示小鼠肺部组织EOS%较空白组增加(P < 0.05),小鼠气道阻力也较空白组增加(P < 0.05),表明哮喘模型建立成功,同时该组小鼠肺间质有炎性细胞浸润,气道可见黏液分泌物,气道周围可见胶原增生。本研究还发现,用RSV感染后的哮喘小鼠与OVA组比较,小鼠肺部EOS%、气道阻力差异均有统计学意义(P < 0.05)。OVA/RSV组小鼠肺部病理学变化较OVA组更加显著:肺泡腔明显狭窄,炎性细胞浸润明显,毛细血管扩张充血,气道可见明显黏液分泌物,气道周围胶原增生明显。
综上所述,本实验成功建立了在病理机制上高度符合哮喘合并RSV感染的生理病理状态的动物模型;并证实了RSV急性感染诱发的哮喘急性发作的病理改变以气道高反应性增高及炎症反应加重为特征,但仍以嗜酸粒细胞为主要效应细胞。
| [1] | Kumar A, Grayson M H. The role of viruses in the development and exacerbation of atopic disease[J]. Ann Allergy Asthma Immunol, 2009, 103:181-186. |
| [2] | Hacking D, Hull J. Respiratory syneytial virus-viral biology and the host response[J].J Infect, 2002, 45:18-24. |
| [3] | Newcomb D C, Boswell M G, Reiss S, Zhou W, Goleniewska K, Toki S, et al. IL-17A inhibits airway reactivity induced by respiratory syncytial virus infection during allergic airway inflammation[J]. Thorax, 2013, 68:717-723. |
| [4] | Krishnamoorthy N, Khare A, Oriss T B, Raundhal M, Morse C, Yarlagadda M, et al. Early infection with respiratory syncytial virus impairs regulatory T cell function and increases susceptibility to allergic asthma[J]. Nat Med, 2012, 18:1525-1530. |
| [5] | Aeffner F, Davis I C. Respiratory syncytial virus reverses airway hyperresponsiveness to methacholine in ovalbumin-sensitized mice[J]. PLoS One, 2012, 7:e46660. |
| [6] | 臧 娜, 王莉佳, 陈伟超, 谢晓虹, 邓 旻, 刘恩梅, 等.呼吸道合胞病毒空斑检测方法的建立及应用[J].中国生物制品学杂志, 2010, 23:192-195. |
| [7] | Sun J, Li L, Wu J, Liu B, Gong W, Lv Y, et al. Effects of baicalin on airway remodeling in asthmatic mice[J].Planta Med, 2013, 79(3-4):199-206. |
| [8] | 尚云晓, 冯 雍.2014版全球哮喘防治创议(GINA)解读--与儿童哮喘相关内容[J].中国实用儿科杂志, 2014, 29:669-672. |
| [9] | Global Initiative for Asthma. Pocket guide for asthma management and prevention[EB/OL].(2012-12)[2013-05-25]http://www.ginasthma.org/local/uploads/files/GINA_Pocket_2013_May 15.pdf. |
| [10] | Global Initiative for Asthma. Global strategy for the diagnosis and management of asthma in children 5 years and younger[EB/OL]. [2013-05-25]. http://www.ginasthnla.org/local/uploads/files/GINA_ Under5_ 2009_ Corx-Augl 1_1.pdf. |
| [11] | 全国儿科哮喘协作组.全国90万0-14岁儿童中支气管患病情况调查[J].中华结核和呼吸杂志, 1993, 16(增刊):64-68. |
| [12] | 全国儿童哮喘防治协作组.中国城区儿童哮喘患病率调查[J].中华儿科杂志, 2003, 41:123-127. |
| [13] | 全国儿科哮喘协作组.2000年与1990年儿童支气管哮喘患病率的调查比较[J].中华结核和呼吸杂志, 2004, 27:112-116. |
| [14] | 全国儿科哮喘协作组, 中国疾病预防控制中心环境与健康相关产品安全所.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志, 2013, 51:729-735. |
| [15] | Black C P. Systematic review of the biology and medical management of respiratory syncytial virus infection[J]. Respir Care, 2003, 48:209-233. |
| [16] | Simes E A. RSV disease in the pediatric population: epidemiology, seasonal variability, and long-term outcomes[J]. Manag Care, 2008, 17(11 Suppl 12):3-6, 18-19. |
| [17] | 吴让琼, 陈宇宁.儿童哮喘发作与呼吸道合胞病毒感染关系研究[J].国际病毒学杂志, 2014, 21:277-279. |
| [18] | Gibson P G, Dolovich J, Denburg J, Ramsdale E H, Hargreave F E.Chronic cough: eosinophilic bronchitis without asthm[J]. Lancet, 1989, 1:1346-1348. |
| [19] | 沈 潞, 赖克方, 姜 华, 洪燕华, 钟南山.不同激发方式对小鼠过敏性支气管哮喘模型的影响[J].中华哮喘杂志(电子版), 2009, 3:404-408. |
| [20] | Locke N R, Royce S G, Wainewright J S, Samuel C S, Tang M L.Comparison of airway remodeling in acute, subacute, and chronic models of allergic airways disease[J].Am J Respir Cell Mol Biol, 2007, 36:625-632. |
| [21] | Trujillo-Vargas C M, Werner-Klein M, Wohlleben G, Polte T, Hansen G, Ehlers S, et al. Helminth-derived products inhibit the development of allergic responses in mice[J].Am J Respir Crit Care Med, 2007, 175:336-344. |
| [22] | Ju Y, Choi S J, Lee H, Kim H S, Won S, Chun Y H, et al. Effect of respiratory syncytial virus infection on regulated on activation, normal T-cells expressed and secreted production in a murine model of asthma[J].Korean J Pediatr, 2011, 54:456-462. |
 2015, Vol. 36
2015, Vol. 36


