淫羊藿是小檗科植物淫羊藿Epimedium brevicornum Maxim.的干燥叶,广泛分布于我国东北、华北、西南等地。其性味辛、温、甘,归肝肾经,具有补肾阳、强筋骨、祛风湿之功效[1]。临床研究表明淫羊藿具有性激素样作用,还可用于降压、降脂、降糖、抗菌等[2]。淫羊藿属植物具有较高的医用价值,近年已成为药用植物研究和开发的热点之一,但由于淫羊藿药材大多选用野生资源,种类繁多,各产区品种混杂,药材质量控制体系不完善,使得淫羊藿在医药方面的应用受到了极大的限制[3]。
2010版《中国药典》规定,淫羊藿药材质量控制的指标为淫羊藿苷,但由于各产地药材中淫羊藿苷含量参差不齐,迫切需要选择药材中多种黄酮类化合物一起参与质量控制[4]。淫羊藿中黄酮类成分有数十种[5],其中朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素具有相同的母核。通过文献调研[6, 7, 8, 9],这几种成分是近年来淫羊藿含量测定及体内药动学研究的热点,但尚未有同时测定这7种成分的报道。 结合课题组前期的工作[10, 11, 12],本研究选择了淫羊藿中7种具有代表性的黄酮类成分,同时进行含量测定,以期更全面地控制淫羊藿药材的质量,并为进一步开展淫羊藿中黄酮类成分的药动学及组织分布研究提供依据。
Agilent 1100系列高效液相色谱仪(美国安捷伦公司),配有在线脱气机、四元泵、自动进样器、柱温箱和二极管阵列检测器(DAD);分析软件为Chemstation工作站。DFY-200药材粉碎机(浙江温岭林大机械有限公司);Mettler AE240型十万分之一电子天平(瑞士梅特勒公司); SB3200-T超声发生器(上海必能信超声有限公司)。
1.2 药品和试剂朝藿定A、朝藿定B、朝藿定C对照品购自上海诗丹德生物技术有限公司(纯度>98.0%),淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素对照品购自上海融禾医药科技发展有限公司(纯度>98.0%)。淫羊藿药材分别购自中国食品药品检定研究院(对照药材,批号121032-201302)、上海雷允上大药房(产地辽宁,批号1312021;产地甘肃,批号LY1402014)、上海德康药店(产地湖北,批号130901)。药材均经第二军医大学生药学教研室黄宝康教授鉴定为小檗科植物淫羊藿的干燥地上部分。乙腈和甲醇为色谱纯(Fisher,USA),其余试剂均为分析纯,水为纯水。
2 方法和结果 2.1 溶液的配制 2.1.1 对照品溶液的制备精密称取朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素对照品,分别为8.24、12.56、11.92、20.00、20.00、20.08、21.36 mg,置10 mL容量瓶中,加甲醇溶解并定容至刻度,摇匀,即得浓度分别为0.824、1.256、1.192、2.000、2.000、2.008、2.136 mg/mL的对照品母液。分别精密量取上述对照品溶液2.5、1.6、1.6、1.0、0.2、0.4、0.2 mL,混合,置10 mL量瓶中,加甲醇至刻度,摇匀,即得混合对照品溶液。将混合对照品溶液按1、2、4、10、20、40倍稀释,即得系列浓度的混合对照品溶液,置于4℃冰箱保存。
2.1.2 样品溶液的制备将淫羊藿药材粉碎、过筛(40目),精密称取1 g,置具塞三角瓶中,加入70%的乙醇溶液30 mL,摇匀,称质量,超声提取30 min,补足失去的质量,滤过,备用;药渣加入70%乙醇同法提取1次,滤过,备用。2次滤液合并,蒸干,加入70%乙醇30 mL,超声至样品溶解,摇匀并经 0.45 μm微孔滤膜过滤后即得样品溶液,置4℃冰箱密封,避光保存。
2.2 色谱条件色谱柱:SHISEIDO MG-C18 (3.0 mm×100 mm,3.0 μm);流动相:A为乙腈,B为0.1%的甲酸水溶液;梯度洗脱,A相含量随时间的变化:25%(0~10 min),25%~40%(10~12 min),40%~45%(12~22 min),45%~75%(22~25 min),75%(25~30 min),流速:0.6 mL/min;紫外检测波长:270 nm;柱温:25℃;进样量:5 μL;外标法定量。
2.3 方法学验证 2.3.1 系统适用性分别取空白溶剂、混合对照品储备液、样品溶液,按2.2项下色谱条件测定,记录色谱图(图 1)。朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素的理论塔板数分别为7 423、7 913、8 118、9 075、163 380、132 756、860 921; 相邻色谱峰的分离度均大于1.5;脱尾因子均在1.0~1.2之间,符合定量分析要求。
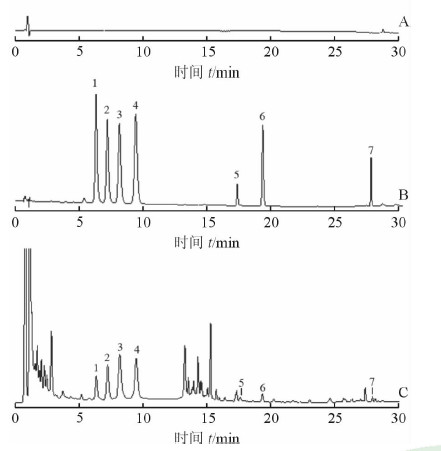
|
图 1 空白溶剂(A)、对照品溶液(B)及淫羊藿样品溶液(C)的HPLC图谱 1:朝藿定A;2:朝藿定B;3:朝藿定C;4:淫羊藿苷;5:淫羊藿次苷Ⅰ;6:淫羊藿次苷Ⅱ;7:脱水淫羊藿素 |
将2.1.1项下制备的系列浓度混合对照品溶液按2.2项下色谱条件依次连续进样,分别重复3次,以对照品溶液浓度(x,μg/mL)对峰面积(y)进行线性回归,呈良好的线性关系,见表 1。
|
|
表 1 淫羊藿中7种黄酮类成分的线性关系 |
将淫羊藿对照品溶液进行逐级稀释,以信噪比10∶1时,确定其最低定量限;以信噪比3∶1时,确定其最低检测限。7种黄酮类成分朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素的最低定量限分别为0.257、0.251、0.238、0.250、0.100、0.101和0.107 μg/mL,最低检测限分别为0.086、0.084、0.079、0.083、0.033、0.033和0.036 μg/mL。
2.3.4 精密度取2.1.1项下制备的淫羊藿系列混合对照品溶液中的第1、3、5三个点作为低、中、高3个浓度点,在1 d以内分别连续进样3次,以及连续3 d分别进样,分别考察日内精密度和日间精密度。结果7种淫羊藿成分的日内精密度低浓度点RSD 均 < 1.0%,中、高浓度点RSD均 < 2.0%;日间精密度低、中、高浓度点RSD均 < 2.0%,表明本方法的精密度良好。
2.3.5 重复性精密称取淫羊藿对照药材1 g(批号: 121032-201302),共5份,按2.1.2项下方法分别制成样品溶液,进样分析。7种黄酮类成分朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素的平均含量和RSD分别为0.85 mg/g (RSD=1.60%)、1.43 mg/g (RSD=0.89%)、2.27 mg/g (RSD=1.26%)、1.66 mg/g (RSD=1.09%)、0.04 mg/g (RSD=1.35%)、0.14 mg/g (RSD=1.73%)、0.06 mg/g (RSD=1.38%)。结果表明本方法的重复性良好。
2.3.6 稳定性取按2.1.2方法制备的淫羊藿对照药材溶液,分别在0、2、4、8、12、24 h测定7种淫羊藿黄酮类成分的峰面积,每个时间点测定1次,考察稳定性。7种黄酮类成分朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素的峰面积RSD分别为0.86%、0.98%、1.18%、1.05%、1.83%、1.50%、1.78%,表明供试品溶液在24 h内稳定。
2.3.7 加样回收率精密称取淫羊藿对照药材0.5 g(批号: 121032-201302),共9份,每3份为1组,按低、中、高3个水平分别加入对照品一定量(样品中各成分含量的50%、100%、150%),按2.1.2项下方法制备,进样分析,结果7种黄酮类成分朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ和脱水淫羊藿素的平均回收率和RSD分别为101.55% (RSD=1.67%)、101.79% (RSD=1.53%)、100.87% (RSD=1.14%)、101.61% (RSD%=1.45%)、98.47%(RSD=1.86%)、101.04% (RSD=1.23%)、99.13%(RSD=1.89%)。结果表明,以本法同时测定淫羊藿中7种黄酮类成分回收率良好。
2.4 样品测定按2.1.2项下方法制备4种淫羊藿药材样品溶液,按2.2项下色谱条件分析,计算样品含量。结果见表 2,其中产地为甘肃的药材,由于朝藿定C和淫羊藿苷含量很高,超出了线性上限,测定时样品采用稀释1倍处理。
|
|
表 2 淫羊藿中7种黄酮类成分的含量测定结果 |
淫羊藿药材的处理一般有4种:煎煮法、回流提取法、超声提取法和超高压提取法。本实验选择了提取效率高、提取时间短的超声波提取法。对于提取溶剂,前期预实验显示乙醇提取优于水和甲醇,而纯乙醇提取后杂质成分多,最终选择70%的乙醇提取。对于提取体积、提取时间、提取次数,本实验采用正交设计考察了溶剂体积(10、20、30 mL)、提取时间(15、30、45 min)、提取次数(1、2、3次),最终选择了70%乙醇30 mL、超声提取30 min、提取2次为最佳提取条件,总黄酮含量最高,达到6.40 mg/g,该提取条件可将药材中黄酮类成分充分提取出来。
3.2 液相条件的选择本实验考察了甲醇-水和乙腈-水体系,发现采用乙腈-0.1%甲酸水,有效成分分离良好且色谱峰无拖尾,因此选为流动相。由于前4种成分朝藿定A、朝藿定B、朝藿定C和淫羊藿苷极性相近,本实验重点调整了0~10 min段,采用25%乙腈等度洗脱,待测成分可有效分离,最终确定了2.2项下的洗脱条件。淫羊藿苷的最佳吸收波长为270 nm,而待测的所有黄酮类成分在此波长均有较好的响应,故检测波长定为270 nm。本研究采用了资生堂的溶剂节省柱,具有更窄的内径和更小的粒径,经摸索流速为0.6 mL/min时柱压相对较低,分离度良好,故选为最佳流速。
3.3 含量测定结果分析药材由于产地不同,各成分的含量也不尽相同,这主要与不同产地的气候、土壤、地形等条件密不可分。对照药材中,7种黄酮类成分全部测得;而产地为辽宁、甘肃和湖北的药材中淫羊藿次苷Ⅰ及产地为辽宁、湖北的药材中脱水淫羊藿素,由于含量极低未测得;甘肃产的淫羊藿药材中几种黄酮类成分的含量普遍高于其他3种药材。测定结果启示我们,临床在使用中草药时要充分考虑产地因素对有效成分含量的影响,注意剂量的调整。
本研究采用HPLC法快速测定了淫羊藿中朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、淫羊藿次苷Ⅰ、淫羊藿次苷Ⅱ、脱水淫羊藿素7种黄酮类成分的含量,方法简便、可行,重现性好,结果准确,可为药材的质量控制提供参考依据。本研究也为后期深入开展淫羊藿黄酮类有效成分药动学及组织分布研究奠定了基础。
| [1] | 国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社, 2010:306. |
| [2] | 刘凯杰, 李 超.淫羊藿药理研究进展(综述)[J].亚热带植物科学, 2014, 43:183-186. |
| [3] | 裴利宽, 郭宝林.近10年淫羊藿药材及饮片研究进展[J].中国中药杂志, 2007, 32:466-471. |
| [4] | 徐艳琴, 陈建军, 葛 菲, 刘小丽, 王 瑛. 淫羊藿药材质量评价研究现状与思考[J].中草药, 2010, 41:661-666. |
| [5] | 郭丽娜, 马莹慧, 赵 伟, 门丽慧, 丁 茹, 刘忠英.淫羊藿属植物中化学成分分析研究进展[J].中国新药杂志, 2013, 22:919-922, 936. |
| [6] | Xu W, Zhang Y, Yang M, Shen Z, Zhang X, Zhang W, et al.LC-MS/MS method for the simultaneous determination of icariin and its major metabolites in rat plasma[J]. J Pharm Biomed Anal, 2007, 45:667-672. |
| [7] | 马清娟, 王 晶, 韩 凌, 吕重宁, 贾凌云, 路金才.HPLC法同时测定淫羊藿药材中8种黄酮类成分的含量[J].沈阳药科大学学报, 2014, 31:970-978. |
| [8] | 雷永涛, 梁 妍, 郝小燕, 裘 璐, 胡朝阳.不同产地淫羊藿中4种活性成分含量的高效液相色谱法测定[J].时珍国医国药, 2013, 24:1404-1405. |
| [9] | 高 静, 周 文, 刘 然, 杨建雄.HPLC同时测定补肾益寿片中朝藿定A、B、C和淫羊藿苷的含量[J].药物分析杂志, 2012, 32:2253-2256. |
| [10] | 吕 磊, 张 海, 赵 亮, 贾 静, 李悦悦, 张国庆.RRLC-TOF/MS快速鉴别中药淫羊藿中43种化学成分[J].第二军医大学学报, 2011, 32:306-310. LV L, Zhang H, Zhao L, Jia J, Li Y Y, Zhang G Q. RRLC-TOF/MS in rapid identification of 43 chemical constituents of epimedium [J]. Acad J Sec Mil Med Univ, 2011, 32:306-310. |
| [11] | 吕 磊, 赵 亮, 张 海, 李悦悦, 张国庆.快速液相-高分辨率飞行时间质谱技术鉴别大鼠血中淫羊藿及其代谢产物[J].第二军医大学学报, 2013, 34:1104-1107. LV L, Zhao L, Zhang H, Li Y Y, Zhang G Q. RRLC-TOF/MS in identification of plasma constituents and metabolites of epimedium in rats after intragastric administration [J]. Acad J Sec Mil Med Univ, 2013, 34:1104-1107. |
| [12] | Lv L, Zhao L, Wang X X, Zhang H, Zhu Z Y, Chai Y F, et al. Identification and differentiation of major flavonoids in two kinds of Epimedium extracts and rat plasma by rapid-resolution liquid chromatography combined with time-of-flight mass spectrometry [J]. Acta Chromatographica, 2015, 27:331-353. |
 2015, Vol. 36
2015, Vol. 36


