还原型谷胱甘肽(GSH)是哺乳动物细胞内含量最丰富的低相对分子质量的多肽,由谷氨酸、半胱氨酸和甘氨酸残基组成。我们前期的研究显示,肝脏缺血再灌注(I/R)时,氧化应激导致的细胞线粒体能量障碍是细胞坏死和凋亡的关键环节[1, 2],而大部分的药物性肝保护措施均能提高组织GSH含量。肝脏I/R时,线粒体内钙超载是线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放的重要诱因[3]。采用非穿透性Ca2+荧光分子探针,通过动态检测线粒体悬液的荧光强度,能敏感观察到已知浓度的外源性Ca2+刺激下线粒体外钙流的变化,并以此判断MPTP开放的时机,评价MPTP敏感性[1, 2]。本研究拟在此基础上,研究大鼠肝脏缺血前GSH预处理对再灌注时肝细胞的保护作用及线粒体机制。
1 材料和方法 1.1 实验动物与试剂雄性SD大鼠,鼠龄8周,体质量220 g左右,购自上海西普尔-必凯实验动物有限公司[许可证号SYXK(沪)2012-0003]。饲养于第二军医大学实验动物中心,每日光照12 h,自由进食。于术前12 h开始禁食,不禁饮水。
GSH由重庆药友制药有限责任公司提供;Calcium green-5N 分子探针购自美国Invitrogen公司;原位末端标记法(TUNEL)检测试剂盒购自瑞士罗氏公司;GSH和氧化型谷胱甘肽(GSSG)检测试剂盒购自上海碧云天生物技术有限公司;其余试剂均为国产分析纯。
1.2 实验分组与动物模型的建立取大鼠60只,随机分为假手术组、I/R组和GSH组,每组20只。各组大鼠用1%戊巴比妥(30 mg/kg)腹腔注射麻醉后,腹部正中切口开腹。I/R组和GSH组大鼠用无损伤血管夹夹闭肝左叶和肝中叶入肝血管(相应肝叶的门静脉和肝动脉),进行70%肝脏热缺血处理60 min,之后松开血管夹行再灌注[1, 2]。缺血前5 min,GSH组大鼠经股静脉注射5 mg/kg GSH溶液(用生理盐水溶解),I/R组给予同体积的生理盐水。假手术组不阻断血流,其余操作同I/R组。
1.3 检测样本的采集与处理于再灌注后6 h和24 h各取10只大鼠断头处死,迅速经心脏取血,并分离和获取血清样本。取各组大鼠新鲜肝脏组织,经4℃生理盐水漂洗后,于肝左叶取约3 mm×3 mm×5 mm的肝组织块,置入4%的中性甲醛固定,用于病理学检查。其余肝组织迅速置入液氮中保存,备检,肝右叶用于线粒体分离纯化。肝脏线粒体分离和纯化使用差速离心法[2]。以牛血清白蛋白为标准,采用Bradford法进行线粒体蛋白定量。
1.4 血清天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平的测定将再灌注后6 h获取的大鼠血清样本经日立7600型全自动生化分析仪检测AST和ALT。
1.5 肝组织病理学检查取再灌注后24 h各组大鼠固定后的肝组织样本,切成2 mm×3 mm×6 mm的肝组织块,脱水,石蜡包埋,切片,H-E染色,光镜(×100)下观察肝组织形态。TUNEL染色按照试剂盒方法操作,切片在光镜下(×400)观察,并随机选取10个视野,计数TUNEL阳性细胞。
1.6 肝组织GSH/GSSG比值测定将液氮中标本于冰浴中解冻后,加入PBS匀浆,离心后取上清,按GSH和GSSG检测试剂盒要求步骤检测。
1.7 钙容纳力(CRC)测定取分离的线粒体蛋白2 mg,加入孵育介质[含70 mmol/L蔗糖、210 mmol/L甘露醇、10 mmol/L Tris-MOPS(3-吗啉丙磺酸)、5 mmol/L Tris-琥珀酸、2 μmol/L Tris-鱼藤酮、20 μmol/L Tris-EGTA(乙二醇四乙酸)、1 mmol/L KH2PO4,pH 7.4] 2 mL。在孵育介质中加入1 μmol/L Calcium green-5N分子探针,于25℃下孵育2 min后,每分钟向悬液中加入终浓度10 μmol/L CaCl2脉冲,通过FlexStationⅡ荧光检测仪(美国Molecular Devices公司)动态检测线粒体悬液中荧光强度,激发和发射波长分别为500 nm和530 nm,直到出现持久性的线粒体外Ca2+浓度剧增,记录所需要的外源性钙脉冲的次数。计算驱动单位线粒体MPTP开放所需要的外源性Ca2+的摩尔量即为CRC。
1.8 统计学处理用SPSS 10.0统计软件进行两因素方差分析,所有数据用 x±s 表示,组间两两比较采用LSD法。检验水准(α)为0.05。
2 结 果 2.1 各组大鼠血清ALT和AST水平的比较再灌注后6 h,与I/R组比较,GSH组的血清AST和ALT水平均降低(P < 0.05),见图1。

|
图 1 再灌注后6 h各组大鼠血清ALT和AST水平的比较 Fig 1 Serum levels of ALT and AST 6 h after reperfusion in rats of each group I/R: Ischemia/reperfusion; GSH: Glutathione; ALT: Alanine aminotransferase; AST: Aspartate transaminanse. P < 0.05 vs I/R group. n=10,x±s |
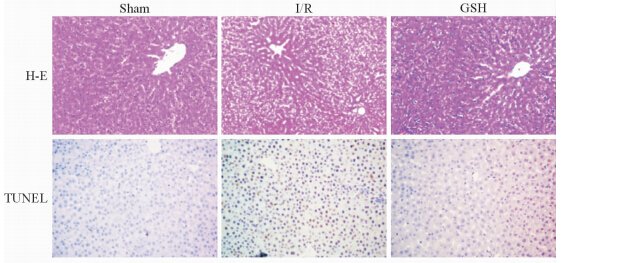
再灌注后24 h,I/R组的肝组织汇管区血窦内见大量充血,血窦排列紊乱,肝细胞出现核固缩,空泡变性,呈现大片坏死; 而GSH组肝组织汇管区大部分肝细胞形态完好,无明显充血,汇管区远端有局灶坏死(图2)。TUNEL染色显示,GSH组肝细胞凋亡减少(图2),阳性细胞比例为(17.3±4.1)%,低于I/R组的(33.3±6.0)%,差异有统计学意义(n=10,P < 0.05)。
|
图 2 再灌注后24 h各组肝组织H-E染色和原位末端转移酶标记染色结果 Fig 2 H-E and TUNEL staining 24 h after reperfusion in rat liver of each group I/R: Ischemia/reperfusion; GSH: Glutathione. Original magnification: ×100 (H-E),×400 (TUNEL) |
再灌注后6 h,假手术组肝组织GSH/GSSG比值为(8.74± 0.66);与I/R组(3.89±0.96)比较,GSH组肝组织中GSH/GSSG比值(6.22± 1.24)升高(n=10,P < 0.05)。
2.4 各组肝细胞MPTP通透性的比较再灌注后6 h,与I/R组比较,GSH组肝细胞线粒体在外源性Ca2+脉冲诱导下的耐受性增加(P < 0.05):使用琥珀酸为能量底物时,对线粒体悬液施加单次10 μmol/L CaCl2脉冲,假手术组线粒体接受的脉冲次数最多,CRC也最高,为(73.2±12.6) nmol/mg; GSH组为(54.2±17.3) nmol/mg;而相同反应条件下,I/R组的耐受性最差,为(31.4±3.3) nmol/mg,与GSH组相比较CRC降低(n=10,P < 0.05)。 提示再灌注后6 h,GSH预处理能降低I/R时MPTP对外源性Ca2+刺激的敏感性,抑制其开放。
3 讨 论I/R损伤是临床常见病理过程,其机制复杂,主要包括微循环障碍、间质水肿、炎症细胞浸润、免疫调节障碍、实质细胞功能障碍、细胞坏死和凋亡等。在一些手术如体外循环、肝切除、肝移植术等中,I/R损伤不可避免,并直接影响手术疗效和患者预后。因此,如何减轻I/R损伤一直是临床面临的重要任务。目前,大量的研究致力于药物性缺血预处理以期减轻I/R损伤。理想的预处理药物应该能模拟人体生理保护作用,对I/R损伤的产生机制具有拮抗作用,同时对机体无或仅有较小不良反应[4]。目前临床上尚无能符合上述条件的药物。
GSH是哺乳动物细胞内自然合成的,含量最丰富的,由谷氨酸、半胱氨酸和甘氨酸组成的低相对分子质量的多肽。药理研究表明,GSH在人体内作为一种还原剂,具有清除体内氧自由基、抗氧化、解毒等重要生理活性[5, 6, 7]。前期研究显示,肝脏I/R损伤时细胞内GSH生物合成能力降低,含量下降[1, 2]。本研究发现使用外源性GSH预处理可以减轻I/R后的肝组织细胞损伤,降低血浆AST和ALT水平,并在远期起到保护肝组织作用,减少肝细胞凋亡。机制研究显示,GSH预处理能增加再灌注早期肝线粒体CRC,抑制MPTP开放。我们认为该作用可能与GSH的强还原性特性、减少了活性氧(reactive oxygen species,ROS) 等过氧化物的产生、阻断了MPTP开放的瀑布级联,从而进一步抑制了后续的线粒体相关细胞坏死和凋亡有关。
线粒体是真核生物进行氧化代谢的部位,在维持组织器官功能稳定及细胞结构完整中起到至关重要的作用[8]。I/R时,由于细胞外Ca2+超载、氧化应激反应产物增加,线粒体外膜对蛋白质的通透性增高,以致可溶性的膜间蛋白从线粒体释放出来;同时线粒体内膜的膜电位下降[9, 10, 11],导致线粒体膜通透性改变,直接引发线粒体破坏,细胞坏死,同时诱导Bcl-2及Caspase家族活化,引起细胞凋亡的级联反应,并导致细胞凋亡[12, 13]。因此,稳定线粒体膜电位、保护线粒体功能、抑制线粒体参与的细胞坏死和凋亡途径能有效改善I/R损伤[8, 9, 10, 11, 12, 13]。结合我们以往的研究发现,I/R损伤后,由于ROS产生增加,对氧化反应十分敏感的线粒体膜通透性升高,线粒体功能受损,并进一步诱发细胞凋亡,加重细胞损伤[14]。因此,理论上采用抗氧化药物直接抑制ROS产生可以有效改善线粒体功能。GSH是一种强还原剂,可以减少体内ROS和超氧化物歧化酶的产生[15],本研究进一步证实了GSH通过抑制MPTP开放引起的细胞坏死和凋亡,从而起到肝保护作用。本实验结果为临床肝切除或肝移植手术中使用GSH进行肝保护提供了理论依据。
| [1] | Fu H, Chen H, Wang C, Xu H, Liu F, Guo M, et al. Flurbiprofen, a cyclooxygenase inhibitor, protects mice from hepatic ischemia/reperfusion injury by inhibiting GSK-3β signaling and mitochondrial permeability transition [J]. Mol Med, 2012, 18: 1128-1135. |
| [2] | Fu H, Xu H, Chen H, Li Y, Li W, Zhu Q, et al. Inhibition of glycogen synthase kinase 3 ameliorates liver ischemia/reperfusion injury via an energy-dependent mitochondrial mechanism [J]. J Hepatol, 2014, 61: 816-824. |
| [3] | Pardo A C, Rinaldi G J, Mosca S M. Mitochondrial calcium handling in normotensive and spontaneously hypertensive rats: correlation with systolic blood pressure levels[J]. Mitochondrion, 2015, 20: 75-81. |
| [4] | Alchera E, Dal Ponte C, Imarisio C, Albano E, Carini R. Molecular mechanisms of liver preconditioning [J]. World J Gastroenterol, 2010, 16: 6058-6067. |
| [5] | Murry C E, Jennings R B, Reimer K A. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J]. Circulation, 1986, 74: 1124-1136. |
| [6] | Zhang Y C, Zhang Q, Li H, Zhang J, Wang G S, Xu C, et al. Prognostic factors for late mortality after liver transplantation for benign end-stage liver disease[J]. Chin Med J (Engl), 2011, 124: 4229-4235. |
| [7] | Abe K, Kimura H. The possible role of hydrogen sulfide as an endogenous neuromodulator[J]. J Neurosci, 1996, 16: 1066-1071. |
| [8] | Lowicka E, Beltowski J.Hydrogen sulfide (H2S)-the third gas of interest for pharmacologists[J]. Pharmacol Rep, 2007, 59: 4-24. |
| [9] | Kimura Y, Kimura H. Hydrogen sulfide protects neurons from oxidative stress[J]. FASEB J, 2004, 18:1165-1167. |
| [10] | Whiteman M, Li L, Kostetski I, Chu S H, Siau J L, Bhatia M, et al. Evidence for the formation of a novel nitrosothiol from the gaseous mediators nitric oxide and hydrogen sulphide [J]. Biochem Biophys Res Commun, 2006, 343: 303-310. |
| [11] | Bernardi P, Scorrano L, Colonna R, Petronilli V, Di Lisa F. Mitochondria and cell death. Mechanistic aspects and methodological issues [J]. Eur J Biochem, 1999, 264: 687-701. |
| [12] | Bauerfeld C P, Rastoqi R, Pirockinaite G, Lee I, Huttemann M, Monks B, et al. TLR4-mediated AKT activation is MYD88/TRIF-dependent and critical for induction of oxidative phosphorylation and mitochondrial transcription factor A in murine macrophages[J]. J Immunol, 2012, 188:2847-2857. |
| [13] | Hirsch J, Hansen K C, Choi S, Noh J, Hirose R, Roberts J P, et al. Warm ischemia-induced alterations in oxidative and inflammatory proteins in hepatic Kupffer cells in rats[J]. Mol Cell Proteomics, 2006, 5:979-986. |
| [14] | Picard C, Casanova J L, Puel A. Infectious diseases in patients with IRAK-4, MyD88, NEMO, or IkappaBalpha deficiency[J]. Clin Microbiol Rev, 2011, 24:490-497. |
| [15] | Francis R C, Vaporidi K, Bloch K D, Ichinose F, Zaplo W M. Protective and detrimental effects of sodium sulfide and hydrogen sulfide in murine ventilator-induced lung injury[J]. Anesthesiology, 2011, 115: 1012-1021. |
 2015, Vol. 36
2015, Vol. 36


