2. 第二军医大学长征医院肿瘤科, 上海 200070;
3. 第二军医大学东方肝胆外科医院病理科, 上海 200438;
4. 第二军医大学长海医院病理科, 上海 200433;
5. 第二军医大学东方肝胆外科医院超声科, 上海 200438
2. Department of Medical Oncology, Changzheng Hospital, Second Military Medical University, Shanghai 200070, China;
3. Department of Pathology, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
4. Department of Pathology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China;
5. Department of Ultrasonography, Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China
肝门部胆管癌是消化系统中恶性程度最高的肿瘤之一,术后复发率高,预后极差[1, 2]。其根本原因在于肝门部胆管癌早诊率低,就诊时大部分患者既已失去手术机会,而且胆管癌侵袭能力强、转移率高[3, 4]。其中神经侵犯是肝门胆管癌的一大特征,胆管癌的神经侵犯率高达80%~90%[5, 6, 7]。为了深入研究胆管癌神经侵犯的病理发生机制,合适的模型是关键环节。本研究利用胆管癌细胞系QBC939建立荷瘤鼠原位种植模型,并观察该模型神经侵犯发生率,为后续研究奠定基础。
1 材料和方法 1.1 细胞培养及实验动物人胆管癌细胞株QBC939购自中国科学院上海生命科学院细胞库,培养于含10%胎牛血清的DMEM培养基中,置于37℃、5%CO2孵箱。BALB/cA nu/nu裸鼠由中国科学院上海实验动物中心提供[SCXK(沪)2012-0003],雄性,4周龄,体质量14~17 g,在第二军医大学实验动物中心SPF级裸鼠室内饲养。
1.2 动物模型的建立 将生长状态良好、处于对数期的QBC939细胞胰酶消化,PBS洗涤2次,配成密度为1×107/mL的细胞悬液,将明胶海绵制成0.5 cm×0.5 cm大小,浸入细胞悬液备用。裸鼠经0.5%水合氯醛腹腔注射(350 mg/kg)麻醉,固定,常规消毒,于剑突下沿腹白线开腹,钝性分离肝脏和肠道组织,暴露肝门部,将浸有肿瘤细胞的明胶海绵置于肝门部胆管与门静脉交汇处,关腹。术后抗生素肌内注射3 d。
1.3 种植瘤影像学观察接种后1~2周间,B超观察肿瘤的位置、大小和血供等情况。
1.4 裸鼠生存情况及解剖学观察观察荷瘤鼠的饮食、活动、体质量等状况。2周内死亡裸鼠直接解剖,观察肿瘤情况;未死亡裸鼠于接种后15 d处死,观察肿瘤情况和周围组织侵犯情况。
1.5 种植瘤组织学观察瘤组织经10%甲醛固定过夜,常见石蜡包埋、 切片、H-E染色,显微镜观察。采用S-P法进行免疫组化染色,兔抗S100多克隆抗体 (RAB-0150,即用型)和S-P免疫组化试剂盒购自福州迈新生物技术开发有限公司。PBS替代一抗作阴性对照。S100阳性染色呈棕黄色或棕褐色,定位于细胞质。
2 结 果 2.1 荷瘤裸鼠状况及B超检查裸鼠接种肿瘤细胞后,伤口愈合良好,无感染、发热、伤口裂开等,腹壁静脉曲张(图 1A),活动能力下降、消瘦、体质量增长缓慢;4只于7~10 d内陆续死亡。裸鼠成瘤率达100%(10/10)。成瘤至7 d左右,B超观察肿瘤情况,显示肿瘤位于肝门部位,周围血供较丰富(图 1B)。

|
图 1 荷瘤鼠腹壁静脉曲张大体观及荷瘤裸鼠B超检查 A:箭头所指为腹壁扩张的血管; B:B超显示肿瘤及血供概况 |
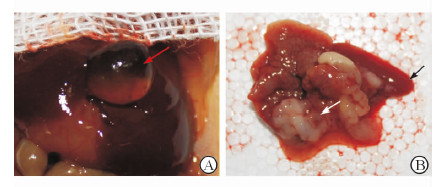
解剖结构(图 2)显示:大部分肿瘤位于肝门部,白色质硬,单个或播散生长,肿瘤体积不等,5~10 mm3;裸鼠肝脏肿大,胆囊扩大明显,部分裸鼠出现肝脏及淋巴结转移。
|
图 2 裸鼠胆管癌原位种植瘤模型的建立 A:肝门部肿瘤合并胆囊肿大,红色箭头为肿大胆囊;B:肝门部肿瘤合并肝脏粘连和转移,白色箭头为肿瘤,黑色箭头为肝脏转移灶 |
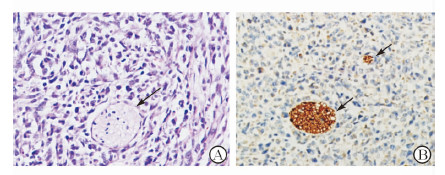
肿瘤组织有假包膜包绕,但大部分肿瘤组织突破包膜侵及周围组织和(或)脏器。肿瘤细胞分化差,核大深染,异型性明显,未见明显腺腔形成(图 3A)。免疫组化结果(图 3B)显示移植瘤内肿瘤细胞包绕大量神经组织。神经侵犯率高达80%(8/10)。
|
图 3 胆管癌移植瘤H-E及免疫组化染色 Fig 3 A: H-E染色;B:免疫组化染色可见移植瘤内神经组织侵犯. 黑色箭头为神经纤维组织. Original magnification: ×200 |
肝门部胆管癌动物模型是研究胆管癌的发病机制、临床表现和临床治疗极为重要的研究工具。肝外胆管模型的建立有多种方式,包括化学药物(如二异丙醇亚硝胺)诱导和手术干预(如胆总管结扎)等,以及肿瘤细胞直接注射到裸鼠肝门部等。前二者操作复杂、周期长、成功率低;后者相对简单,成功率较高。李成刚等[8]利用自制的显微注射器直接将肿瘤细胞悬液注入肝门部胆管与门静脉组织间隙处,成功率达100%。但该方法要求较高,需充分暴露裸鼠肝门部,且裸鼠肝门部组织菲薄,注射困难,我们尝试用该方法进行肝门部局部注射,但均告失败。为了提高成功率,本研究采用明胶海绵法将肿瘤细胞直接固定于裸鼠肝门部,该方法简单易行,成功率极高。
肝门部胆管癌的临床表现特殊,如食欲下降、黄疸、消瘦、疼痛、发热等,甚至有门脉高压以及胆囊炎等表现。本研究成瘤率达到100%,荷瘤动物出现食欲下降、消瘦和黄疸等症状,而且存在腹壁静脉曲张,个别裸鼠出现呕血,影像学和解剖均显示肿瘤位于肝门部,且胆囊扩张明显。因此,本研究构建的裸鼠肝门部肿瘤模型能够充分反映肝门部胆管癌的临床特征,与李成刚等[8]的研究较为类似。肝门部原位移植瘤具有胆管癌患者的一系列特征,但本研究结果同时显示肝门部胆管癌移植瘤模型还具有门静脉受压或肿瘤浸润造成门脉高压等特点。
QBC细胞是由王曙光等[9]建立的肝门部胆管癌细胞株,侵袭性较强。本研究中所有裸鼠的荷瘤均表现为肿瘤细胞呈团块状和侵袭性生长,大部分肿瘤组织突破假包膜,侵及周围组织,如腹膜、肝脏、脾脏、胰腺和腹膜后淋巴结等,成瘤均一性较强,显示了该细胞具有高侵袭性,完全符合肝门部胆管癌的生物学特性。神经侵犯是胆管癌的一大特征[10, 11],本研究采用S100蛋白对肿瘤内部神经纤维组织进行染色,观察原位移植瘤内是否存在神经侵犯,结果显示肿瘤组织内部存在大量的神经纤维,这些神经纤维直接与肿瘤细胞接触,未见明显神经鞘。通过S100染色,我们发现80%荷瘤鼠的肿瘤存在神经侵犯,且呈多发性分布,提示胆管癌细胞具有嗜神经性。本研究提出了一种模拟肝门部胆管癌恶性生物学行为,包括神经侵犯的动物模型,可用于临床药物等的干预和治疗。然而肿瘤细胞和神经纤维的互动关系还有待于进一步研究。
综上所述,本研究成功建立了肝门部胆管癌原位移植瘤模型,该模型能够较好反映胆管癌患者临床表现和胆管癌生物学行为,如高转移性和嗜神经性,为了解肝门部胆管癌的生长和浸润规律以及进行干预治疗研究提供了有效的实验平台。所有荷瘤鼠种植肿瘤后均常规使用3 d抗生素治疗,无感染相关事件发生,但约40%的荷瘤鼠因肿瘤相关并发症而死亡,主要为胆总管受压、肝功能受损严重所致。因此,在制备荷瘤鼠时要根据实验目的和要求,选择适当的细胞接种密度,以及合适的干预时间,如在成瘤的第7天进行干预或治疗,尽量减少死亡率。此外,即使是裸鼠肝门部原位种植瘤,其病理学特点与临床肝门部胆管癌镜下表现完全不同,移植瘤组织部位肿瘤细胞致密,纤维结缔组织极少,而人肿瘤组织正好相反,纤维结缔组织多,而肿瘤细胞相对较少。因此该模型只是反映了肝门部胆管癌细胞的生物学特点,还不能够很好模拟临床肝门部胆管癌患者的病理生理环境。因此,寻找合适的诱导肝门部胆管癌自发成瘤模型是未来的重要研究方向。
| [1] | Tabata M, Kawarada Y, Yokoi H, Higashiguchi T, Isaji S. Surgical treatment for hilar cholangiocarcinoma [J]. J Hepatobiliary Pancreat Surg, 2000, 7: 148-154. |
| [2] | Serrablo A, Tejedor L. Outcome of surgical resection in Klatskin tumors [J]. World J Gastrointest Oncol, 2013, 5:147-158. |
| [3] | Lee J H, Hwang D W, Lee S Y, Park K M, Lee Y J. The proximal margin of resected hilar cholangiocarcinoma: the effect of microscopic positive margin on long-term survival [J]. Am Surg, 2012, 78: 471-477. |
| [4] | Patel S H, Kooby D A, Staley C A 3rd, Sarmiento J M, Maithel S K. The prognostic importance of lymphovascular invasion in cholangiocarcinoma above the cystic duct: a new selection criterion for adjuvant therapy ? [J]. HPB (Oxford), 2011, 13: 605-611. |
| [5] | 李成刚, 黄志强, 韦立新, 赵之明, 胡明根, 肖 雨, 等. 肝门部胆管癌神经浸润及围肝门经丛的分布[J].中华医学杂志, 2012, 92: 2699-2702. |
| [6] | Shen F Z, Zhang B Y, Feng Y J, Jia Z X, An B, Liu C C, et al. Current research in perineural invasion of cholangiocarcinoma[J]. J Exp Clin Cancer Res, 2010, 29: 24. |
| [7] | Shirai K, Ebata T, Oda K, Nishio H, Nagasaka T, Nimura Y, et al. Perineural invasion is a prognostic factor in intrahepatic cholangiocarcinoma [J]. World J Surg, 2008, 32: 2395-2402. |
| [8] | 李成刚, 李崇辉, 张爱群, 董家鸿. 肝门部胆管癌裸鼠动物模型的建立[J].军医进修学院学报, 2011, 32: 511-512. |
| [9] | 王曙光, 韩本立, 段恒春, 陈意生, 彭志明. 肝外胆管癌细胞系的建立[J].中华实验外科杂志, 1997, 14: 67-68. |
| [10] | 李成刚, 黄志强, 韦立新, 董家鸿, 刘军桂, 王燕生.肝门部胆管癌神经浸润特征的临床病理学分析[J].世界华人消化杂志, 2008, 16: 379-384. |
| [11] | 郑秀海, 王曙光. 胆管癌浸润转移途径及其机制[J].世界华人消化杂志, 2007, 15: 276-281. |
 2015, Vol. 36
2015, Vol. 36


