2. 上海皮肤病医院药材科, 上海 200443;
3. 第二军医大学长海医院消化内科, 上海 200433
2. Department of Pharmacy, Shanghai Dermatology Hospital, Shanghai 200443, China;
3. Department of Gastroenterology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
胰腺癌起病隐匿,进展快速,治疗难度和死亡率都很高,并且近年来其发病率呈明显上升趋势[1]。胰腺癌治疗中最有效的手段是早期根治性手术切除[2],但目前受诊断水平的限制,胰腺癌的手术切除率只有10%~20%,5年生存率仅为0.4%~3.4%[1, 3]。因此,早期诊断从而早期治疗是改善胰腺癌预后的关键。超声造影增强(contrast-enhanced endoscopic ultrasound,CE-EUS)技术是一种能够对各种病灶进行“血池成像”的新技术[4, 5],与其他影像技术(如CT、 MRI等)相比,具有安全、无辐射、操作简单、观察实时和价格低廉等优势。CE-EUS通过静脉注射微泡造影剂,扫查界面回声声阻抗差,将病灶从组织中凸显出来,可以作为胰腺癌筛查的常规手段,已成为胰腺疾病诊断的研究热点之一[6, 7]。由于普通的造影剂在胰腺组织中浓度整体偏低,半衰期短,较小的病灶会出现漏诊[8]等,使得这项技术具有一定的局限性。
近年来,随着分子影像学的高度发展,靶向分子成像技术越来越受到研究者的重视。Hedgehog蛋白几乎在所有胰腺癌中高度表达,且高度表达状态在肿瘤病变早期已出现[9, 10],而Hedgehog蛋白在正常组织中分布有限,故制备一种能够靶向Hedgehog蛋白的超声造影剂对胰腺癌早期诊断具有重要的意义。聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]是经过美国FDA认证可以体内应用的生物降解材料,具有良好的生物相容性,可制备成多种药物的纳米级微粒载体[11, 12, 13]。液态氟碳具有以靶向聚集为基础的超声增强显影性能,当液态氟碳造影剂微粒处于分散状态时,对超声敏感性非常弱,只有当微粒聚集到靶组织或细胞时,才在超声下显影,可作为纳米造影剂中的包裹药物[14]。全氟溴辛烷(perfluoroctyl bromide,PFOB)是液态氟碳造影剂中的代表性化合物[15]。本研究利用聚乙二醇(polyethylene glycol,PEG)修饰的PLGA作为液态PFOB的纳米级微粒载体,连接能够靶向早期胰腺癌细胞膜表面Hedgehog蛋白的单抗(Hedgehog mAb),制备胰腺癌靶向的纳米级超声造影剂,并探讨其体外细胞靶向能力,旨在寻找一种理想的胰腺癌早期诊断的超声造影剂。
1 材料和方法 1.1 仪器和试剂真空干燥箱(Binder公司,德国);Mercury Plus 600 MHz超导核磁共振波谱仪(Varian公司,美国);超声乳化仪(新芝生物科技有限公司,宁波);高速离心机(Eppendorf公司,德国);冷冻干燥机(Virtis公司,美国);Zeta sizer ZS90电位粒径分析仪(Malvern公司,英国);透射电镜 (JEM-2010,JEOL公司,日本);全自动酶标仪(Thermo公司,美国);气相色谱-质谱联用仪(GC-MS,由GC6890气相色谱仪和5973N质谱检测仪组成,Agilent公司,美国);荧光显微镜(Leica公司,德国);FACSCalibur流式细胞仪(BD公司,美国);聚乳酸-羟基乙酸共聚物(PLGA-COOH,乳酸∶羟基乙酸=50∶50,LAKESHORE公司,美国);双功能聚乙二醇(NH2-PEG-COOH,平均相对分子质量5 000,嘉兴博美生物技术有限公司);Hedgehog mAb(Abcam公司,英国);香豆素-6(coumarin-6,Sigma-Aldrich公司,美国);DMEM培养液、胎牛血清(FBS;Gibco公司,美国),其他试剂均为分析纯。胰腺癌细胞株SW1990和CFPAC-1均购自美国ATCC公司。
1.2 PLGA-PEG-NHS的合成将2 000 mg PLGA-COOH溶解在5 mL二氯甲烷中,向溶液中加入50 mg N-羟基琥珀酰亚胺(NHS)、100 mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl),避光搅拌反应12 h,氮气吹干二氯甲烷,加入乙醚沉淀并洗涤,真空干燥得到PLGA-NHS。称取合成的PLGA-NHS 1 000 mg溶解在2 mL三氯甲烷中,加入300 mg NH2-PEG-COOH,反应12 h后在甲醇中沉淀并氮气吹干得到PLGA-PEG-COOH。将500 mg PLGA-PEG-COOH溶解在2 mL二氯甲烷中,向溶液中加入15 mg NHS和25 mg EDC·HCl,充分反应后乙醚沉淀,并用乙醚洗去NHS和EDC,真空干燥得到制备纳米造影剂的材料PLGA-PEG-NHS。合成产物溶解于氘代氯仿(CDCl3)中,利用300 MHz核磁鉴定。
1.3 包裹PFOB的PLGA靶向纳米造影剂的制备利用乳化挥发法制备包裹PFOB的PLGA纳米粒,具体方法如下:称取50 mg PLGA-PEG-NHS溶解于2 mL 二氯甲烷中作为分散相,加入5 μL PFOB(约9.7 mg)和1 mg荧光染料香豆素-6,充分混匀后倒入10 mL 1%的胆酸钠溶液中,冰水浴下400 W超声乳化30 s,间隔10 s,重复3次。将所得纳米乳化液倒入盛有10 mL水的烧杯中,在室温下开口搅拌约3 h使二氯甲烷挥发,高速离心收集纳米粒。之后将纳米粒分散于5 mL PBS,加入1 000 μg Hedgehog mAb,避光搅拌反应6 h,高速离心收集纳米粒,洗涤3次后冻干即可得固态纳米粒(图1)。抗体连接比例利用酶标仪以BCA法测定抗体蛋白的含量后计算得到。
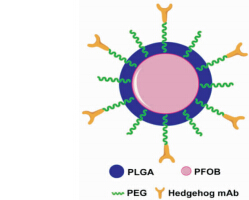
|
图 1 胰腺癌靶向纳米造影剂示意图 Fig 1 Diagrammatic sketch of pancreatic cancer-targeted nano-scale ultrasound contrast agent PLGA:Poly(lactic-co-glycolic acid);PFOB:Perfluoroctyl bromide;PEG:Polyethylene glycol; Hedgehog mAb:Hedgehog monoclonal antibody |
将适量的靶向纳米造影剂溶液滴到覆盖有碳膜的铜网上,用滤纸吸干多余水分,白炽灯下进一步干燥后,利用透射电镜观察形态。另外分别取纳米造影剂溶液20 μL,加入PBS溶液稀释成1 mL,利用电位粒径分析仪测定纳米粒的粒径和电位,测定条件为25℃、固定角90°。
1.5 纳米造影剂的载药量和包封率的测定取纳米粒10 mg,加入5 mL水复溶,将纳米粒溶液置于超滤管(滤过相对分子质量为5 000)中5 000×g超滤离心20 min,再向超滤管中加入5 mL水后离心20 min,重复2次合并滤液,利用GC-MS法测定滤液中游离PFOB的含量。另取纳米粒10 mg,加入5 mL甲醇超声3 min破坏掉纳米粒,高速离心5 min后,取上清液利用GC-MS法测定纳米粒中总PFOB的含量。气相色谱条件为:DB-5MS UI色谱柱(30 m×0.25 mm×0.25 μm),起始柱温60℃,以8℃/min的速率升至180℃,然后再以20℃/min的速率升至250℃,保持2 min,以排尽样品,进样口温度250℃,检测器温度280℃,载气为氦气,进样量1 μL。质谱条件为:EI离子源,离子源温度230℃,流量1.0 mL/min。进样之后溶剂的延迟运行时间为3.5 min。纳米造影剂的载药量和包封率按照以下公式计算:载药量(%)=(纳米粒中总PFOB量-游离PFOB量)/纳米粒总量×100%,包封率(%)=(纳米粒中总PFOB量-游离PFOB量)/投入的PFOB量×100%。
1.6 纳米造影剂体外释放度的测定取20 mg 纳米粒,加入2 mL PBS溶解,装入透析袋中(MWCO 3 500)并封住袋口,透析袋随后放入100 mL的恒温(37℃) PBS中,PBS中加入1 mol/L的水杨酸钠溶液(由于PFOB在水中溶解度较低,加入水杨酸钠后可以增加PFOB的溶解度,以使释放满足漏槽条件),在搅拌速率为100 r/min的条件下进行释放度测定。分别于0.5、1、2、3、6、9、12、18、24、36、48 h吸取1 mL PBS测定PFOB的释放量,并补加1 mL PBS。
1.7 纳米造影剂对胰腺癌细胞的体外靶向性评价采用Hedgehog高表达的人胰腺癌SW1990细胞株和Hedgehog低表达的人胰腺癌CFPAC-1细胞株对包裹PFOB纳米粒的体外靶向性进行评价,细胞培养液为添加10% FBS的DMEM培养液,培养环境为37℃、5% CO2的孵箱。取对数生长期细胞按照每孔2×105个的密度接种于6孔板,培养24 h使细胞贴壁。之后每孔加入100 μL纳米造影剂溶液(500 μg/mL),37℃孵育1 h后,PBS润洗3次,利用荧光显微镜观察纳米造影剂的细胞摄取情况。之后利用胰酶将细胞消化,离心重悬至500 μL,利用流式细胞仪定量分析细胞对纳米造影剂的摄取。为进一步评价靶向Hedgehog抗体对纳米造影剂入胞的作用,细胞预先加入过量的Hedgehog mAb(10 μg)孵育30 min,封闭Hedgehog蛋白受体,然后每孔加入100 μL纳米造影剂溶液(500 μg/mL),37℃孵育1 h后,分别通过荧光显微镜和流式细胞仪进行观察和检测。
2 结 果 2.1 合成材料的核磁共振谱图取合成的产物PLGA-PEG-NHS溶于CDCl3,利用300 MHz核磁共振成像,图2显示的是合成的PLGA-PEG-NHS的谱图,其中峰1、2、5为PLGA的特征峰,峰4为PEG的特征峰,峰3为NHS的特征峰。核磁共振图谱表明所合成的材料为制备纳米粒所需的目标产物PLGA-PEG-NHS。
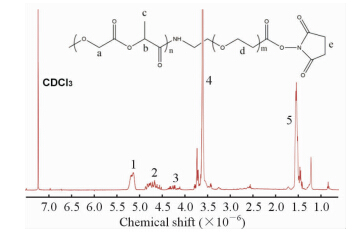
|
图 2 PLGA-PEG-NHS的核磁共振氢谱图 Fig 2 1H-NMR spectrum of the prepared PLGA-PEG-NHS 1,2,5: PLGA; 3: NHS; 4: PEG. PLGA: Poly(lactic-co-glycolic acid); PEG: Polyethylene glycol;NHS: N-hydroxysuccinimide |
利用BCA法测得纳米造影剂的抗体含量,结果为每1 mg的纳米造影剂含有17.9 μg的抗体,抗体的连接比例为(17.9±3.1)μg/mg。将制得的靶向纳米造影剂于电子显微镜下观察,发现粒子为形态比较规则的圆球形,大小均匀,分散度好,没有出现粒子团聚的现象(图3A)。电位粒径分析仪测得靶向纳米造影剂的粒径在95~370 nm范围内呈正态分布(图3B),平均粒径为198.9 nm,多分散系数PDI为0.26;靶向纳米造影剂的表面Zeta电位为-31.8 mV(图3C)。
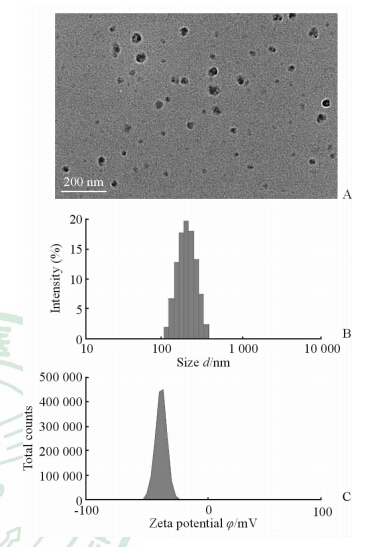
|
图 3 靶向纳米造影剂的形态(A)、粒径(B)和Zeta电位分布(C) Fig 3 The morphology (A),size (B) and Zeta potential distribution (C) of targeted nano-scale ultrasound contrast agent |
GC-MS法测定PFOB含量的标准曲线为 y=12.609x +0.444 1 (R2=0.999 7),日内精密度RSD为0.71%。纳米造影剂包封率测定结果为(63.7±3.9)%( n =3),载药量测定结果为(14.3±0.9)%( n= 3)。
2.4 纳米造影剂体外释放特性的测定利用透析法考察靶向纳米造影剂的体外释药特性,对PFOB的释放进行拟合得到曲线:Y =16.52ln(t)+19.446(R2=0.997 1),该曲线符合一级速率方程,即释放是按时间变化先多后少的非恒速释药。由图4可见,纳米造影剂中的PFOB释放可以分成3个阶段:第一阶段释放比较快,前3 h有一个突释,释放量占总药量的37.4%,这是纳米造影剂表层的PFOB从纳米造影剂脱离导致的快速释放;3 h后进入了一个平稳释放的状态,这是纳米造影剂内部的PFOB向表层扩散从而进入了释放液中,前24 h累计释放了73.2%;24 h后药物的扩散进入一个平衡状态,纳米造影剂中的PFOB释放减缓。前48 h PFOB累计释放了85.3%。

|
图 4 纳米造影剂中PFOB的体外释放曲线 Fig 4 Release curves of PFOB from targeted nano-scale ultrasound contrast agent PFOB: Perfluoroctyl bromide. n=3,x±s |
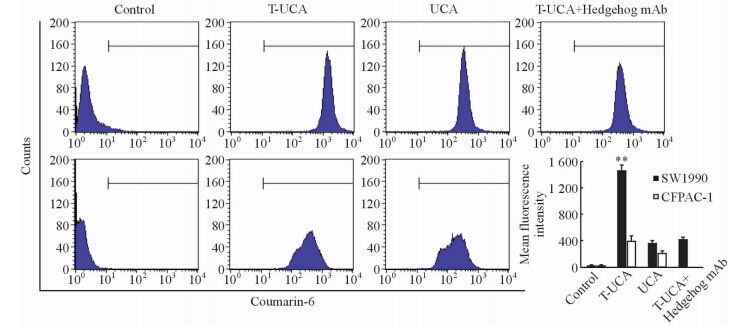
利用荧光显微镜观察胰腺癌细胞对靶向纳米造影剂的摄取(图5),可以发现高表达Hedgehog抗原的SW1990细胞对靶向纳米造影剂的摄取量比较多,绿色荧光在细胞内分布比较均匀,荧光强度明显高于非靶向纳米造影剂的对照组;而不表达Hedgehog抗原的CFPAC-1细胞对靶向纳米造影剂的摄取量没有明显增加,说明Hedgehog抗体修饰的纳米造影剂对表达Hedgehog抗原的胰腺癌细胞有靶向作用。利用过量的Hedgehog抗体封闭细胞表面的Hedgehog抗原后,SW1990细胞对靶向纳米造影剂的摄取量显著下降,表明在SW1990细胞对靶向纳米造影剂的摄取过程中,Hedgehog抗原-抗体介导的内吞途径发挥了重要作用。利用流式细胞仪对纳米造影剂摄取的定量研究发现,靶向纳米造影剂作用1 h后,SW1990细胞的平均荧光强度为1 463.9,而非靶向纳米造影剂作用的SW1990细胞平均荧光强度只有352.6,仅为前者的1/4,而利用抗体封闭Hedgehog抗原后,靶向纳米造影剂作用的细胞平均荧光强度下降为414.1,下降非常明显。而Hedgehog抗原低表达的CFPAC-1细胞的平均荧光强度与纳米造影剂表面是否连接抗体关联不大,靶向和非靶向纳米造影剂组的细胞平均荧光强度分别为389.7和205.6(图6)。
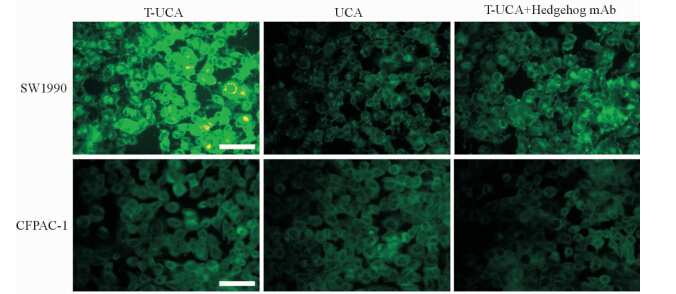
|
图 5 荧光显微镜观察纳米造影剂的细胞摄取情况 Fig 5 Cellular uptake of nano-scale ultrasound contrast agent observed by fluorescence microscope T-UCA: Cells were treated with targeted nano-scale ultrasound contrast agent; UCA: Cells were treated with non-targeted nano-scale ultrasound contrast agent; T-UCA + Hedgehog mAb: Cells were pretreated with excessive Hedgehog monoclonal antibody before treated with targeted nano-scale ultrasound contrast agent. Original magnification: ×20 |
|
图 6 流式细胞仪检测SW1990细胞(上排)和CFPAC-1细胞(下排)对纳米造影剂的摄取情况 Fig 6 The cellular uptake of nano-scale ultrasound contrast agent determined by flow cytometry (The upper line for SW1990 cells and the lower line for CFPAC-1 cells) Control: The untreated cells; T-UCA: Cells were treated with targeted nano-scale ultrasound contrast agent; UCA: Cells were treated with non-targeted nano-scale ultrasound contrast agent; T-UCA + Hedgehog mAb: Cell were pretreated with excessive Hedgehog monoclonal antibody before treated with targeted nano-scale ultrasound contrast agent. **P < 0.01 vs other groups. n=3,x±s |
近年来CE-EUS已成为胰腺癌诊断的首选方法,超声造影剂可以大大提高CE-EUS的敏感性。现有的超声造影剂主要为微泡造影剂,微泡的直径较大(多为2~6 μm),存在无法穿透血管壁到达靶细胞、特异性不强、半衰期短等局限[16],易造成误诊或漏诊[16]。而纳米级造影剂具有穿透血管内皮间隙使血管外靶组织显像的能力[17],因此靶向性、纳米级的造影剂成为近年来分子影像学的研究热点。
为克服传统微泡造影剂的缺点,本课题利用PLGA、双功能PEG和PFOB构建了一种能对胰腺癌特异性靶向的纳米级造影剂。PFOB的聚集成像性能克服了微泡造影剂的声影现象与背景噪声,从而提高成像的分辨准确度[15]。PLGA是一种优良的纳米粒制备材料,但单独应用制备的纳米微粒会在体内清除迅速,PEG的修饰可以减少网状内皮系统(reticuloendothelial system,RES)对PLGA纳米微粒的清除,延长其在血液循环的存留时间,有利于纳米粒到达肿瘤部位[18],同时PEG有独特的亲水特性,桥接Hedgehog mAb后可使得后者分布于纳米粒表层,有助于单抗靶向功能的发挥。
本研究采用乳化挥发法制备纳米粒时,目标粒径为200 nm左右,本实验制得的纳米粒的平均粒径为198.9 nm,制得的靶向纳米造影剂稳定性好,粒径大小均匀,该粒径大小可以充分利用肿瘤的增强渗透滞留效应 (enhanced permeability and retention effect,ERP),使纳米造影剂在肿瘤部位滞留和蓄积[19];靶向纳米造影剂的表面Zeta电位为-31.8 mV,Zeta电位的绝对值在30 mV以上时,纳米粒表面的净电荷足以让微粒间产生较大的静电斥力,使得纳米粒稳定性提高,保持粒径大小均匀,减少聚集现象[20]。体外释放实验表明,纳米粒PFOB的释放符合一级速率方程,经3 h的突释后进入平稳释放状态,24 h后释放减缓,前48 h累计释放了85.3%。靶向纳米造影剂作为肿瘤特异性诊断试剂,需要在注射后靶向并富集到肿瘤部位,然后进行超声诊断成像,在体内这一过程需要一定时间才能实现,因此PFOB不能立即全部释放,但也不能释放太缓慢,而我们制得的纳米造影剂的释放特性可以满足这一条件。在体外寻靶实验中,靶向造影剂被高表达Hedgehog抗原的SW1990细胞大量摄取,而不表达Hedgehog抗原的CFPAC-1细胞未见特异性的摄取增强。利用抗体封闭Hedgehog抗原后,靶向纳米粒随着抗体浓度增高而与细胞的结合能力减弱,可进一步证明靶向纳米造影剂与SW1990细胞的特异性结合,即抗体导向的靶向纳米造影剂具有靶向结合胰腺癌细胞的能力。
综上所述,本研究选用PFOB包裹在PEG修饰的PLGA纳米微粒中得到纳米级超声造影剂,在表面连接Hedgehog单抗以实现胰腺癌的靶向性,体外评价表明具有成为胰腺癌靶向的新型造影剂的潜力,后期我们将进一步在动物体内验证其靶向性和超声造影增强效果。
| [1] | Hidalgo M. Pancreatic cancer [J]. N Engl J Med, 2010, 362: 1605-1617. |
| [2] | Verbeke C S. Resection margins in pancreatic cancer[J]. Pathologe, 2013, 34(Suppl 2): 241-247. |
| [3] | Bilimoria K Y, Bentrem D J, Feinglass J M, Stewart A K, Winchester D P, Talamonti M S, et al. Directing surgical quality improvement initiatives: comparison of perioperative mortality and long-term survival for cancer surgery [J]. J Clin Oncol, 2008, 26: 4626-4633. |
| [4] | Diethich C F, Sharma M, Hocke M. Contrast-enhanced endoscopic ultrasound [J]. Endosc Ultrasound, 2012, 1: 130-136. |
| [5] | Luz L P, Al-Haddad M A, Sey M S, DeWitt J M. Applications of endoscopic ultrasound in pancreatic cancer [J]. World J Gastropenterol, 2014, 20: 7808-7818. |
| [6] | Deshpande N, Needles A, Willmann J K. Molecular ultrasound imaging: current status and future directions [J]. Clin Radiol, 2010, 65: 567-581. |
| [7] | Liu H L, Fan C H, Ting C Y, Yeh C K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview [J]. Thernostics, 2014, 4: 432-444. |
| [8] | Kaufmann B A, Lindner J R. Molecular imaging with targeted contrast ultrasound [J]. Curr Opin Biotechnol, 2007, 18: 11-16. |
| [9] | Chiu J W, Wong H, Leung R, Pang R, Cheung T T, Fan S T, et al. Advanced pancreatic cancer: flourishing novel approaches in the era of biological therapy [J]. Oncologist, 2014, 19: 937-950. |
| [10] | Gonnissen A, Isebaert S, Haustermans K. Hedgehog signaling in prostate cancer and its therapeutic implication [J]. Int J Mol Sci, 2013, 14:13979-14007. |
| [11] | Choi J S, Seo K, Yoo J W. Recent advances in PLGA particulate systems for drug delivery [J]. J Pharm Invest, 2012, 42: 155-163. |
| [12] | Danhier F, Ansorena E, Silva J M, Coco R, Breton A L, Préat V. PLGA-based nanoparticles: an overview of biomedical applications [J]. J Control Release, 2012, 161: 505-522. |
| [13] | Gao W, Wang J. Synthetic micro/nanomotors in drug delivery [J]. Nanoscale, 2014, 6:10486-10494. |
| [14] | Díaz-López R, Tsapis N, Santin M, Bridal S L, Nicolas V, Jaillard D, et al. The performance of PEGylated nanocapsules of perfluorooctyl bromide as an ultrasound contrast agent [J]. Biomaterials, 2010, 31: 1723-1731. |
| [15] | Díaz-López R, Tsapis N, Fattal E. Liquid perfluorocarbons as contrast agents for ultrasonography and 19F-MRI [J]. Pharm Res, 2010, 27: 1-16. |
| [16] | Zheng S G, Xu H X, Chen H R. Nano/microparticles and ultrasound contrast agents[J]. World J Radiol, 2013, 5: 468-471. |
| [17] | Paefgen V, Doleschel D, Kiessling F. Evolution of contrast agents for ultrasound imaging and ultrasound-mediated drug delivery [J]. Front Pharmacol, 2015, 6:197. |
| [18] | Kolate A, Baradia D, Patil S, Vhora I, Kore G, Misra A. PEG-a versatile conjugating ligand for drugs and drug delivery systems [J]. J Control Release, 2014, 192: 67-81. |
| [19] | Nichols J W, Bae Y H. EPR: evidence and fallacy [J]. J Control Release, 2014, 190:451-464. |
| [20] | Elzoqhby A O. Gelatin-based nanoparticles as drug and gene delivery systems: reviewing three decades of research [J]. J Control Release, 2013, 172: 1075-1091. |
 2015, Vol. 36
2015, Vol. 36


