2. 江苏大学附属人民医院泌尿外科, 镇江 212002
2. Department of Urology, People's Hospital Affiliated to Jiangsu University, Zhenjiang 212002, Jiangsu, China
心肌梗死(myocardial infarction,MI)是冠状动脉急性、持续性缺血缺氧所引起的心肌坏死,常可危及生命[1]。水飞蓟素作为临床上常用的保肝药物,具有保护肝细胞膜、清除氧自由基、抗脂质过氧化等活性[2]。随着研究的不断深入,发现水飞蓟素还具有保护心肌及抑制血管内膜增生等作用[3]。本研究观察水飞蓟素对小鼠心肌梗死的影响,并通过检测凋亡蛋白表达水平的变化探讨其作用机制。
1 材料和方法 1.1 动物与试剂清洁级近交系C57BL/6小鼠,由第二军医大学实验动物中心提供,许可证号:SYXK(沪)2010-0101。8~10周龄,体质量19~21 g,雄性,垫料经高温消毒。水飞蓟素(S0292)购自Sigma公司。水飞蓟素溶解于含0.9%氯化钠、3%乙醇、1%吐温-80和6.6 mmol/L氢氧化钠的水溶液中[4]。
1.2 建模和分组将小鼠随机分为4组,每组15只,分别为假手术组(Sham组)、急性心肌梗死(acute myocardial infarction,AMI)组、急性心肌梗死+50 mg/(kg·d)水飞蓟素组(AMI+Silymarin组)、急性心肌梗死+溶剂组(AMI+Vehicle)组。 急性心肌梗死造模方法如下:将小鼠置于充满异氟烷的麻醉罐中,当肌肉充分松弛后,背部固定小鼠,实施气管插管。术中异氟烷持续吸入,维持浓度为1%,连接小动物呼吸机,潮气量为0.5~1.0 mL/min。 连接心电图,观察术中心电图变化。打开胸腔,暴露小鼠心脏,结扎左冠状动脉前降支近端,待心电图Ⅰ导联显示ST段弓背向上抬高,左室前壁变苍白时,说明心肌梗死模型建立成功。排出胸腔气体并连续缝合关闭胸腔。假手术组开胸后,只在相同部位穿线,不做结扎,其余过程相同[5]。术后注射青霉素以防感染。术后第2天开始灌胃给药,连续4周。
1.3 生存分析所有小鼠进行生存分析。每天检查鼠笼,对死亡小鼠进行解剖检查,检查心肌梗死程度以及胸腔积液和心脏破裂情况。
1.4 小鼠心脏超声检查和血流动力学检测评价心功能术后4周将小鼠以1%异氟烷持续吸入麻醉后,背部固定,取胸骨旁短轴观切面,轻轻地放置超声探头在左前胸壁中上部,并向心底和心尖部缓缓移动和调整角度,直到获得理想的图像,并使用M-模式以走纸速度为50 mm/s进行记录。M型超声模式下记录反映心室收缩功能的缩短分数 (fractional shortening,FS)和射血分数(ejection fraction,EF)。
灌胃4周后,腹腔注射2%戊巴比妥麻醉小鼠,分离右颈总动脉,连接十六导生理记录仪,记录小鼠左室内压峰值(left ventricular systolic pressure,LVSP)、左室舒张末压力(left ventricular end-diastolic pressure,LVEDP)和左室等容收缩末期压力上升最大速率(+dp/dtmax),以评价心功能。
1.5 H-E染色评价心肌梗死程度将结扎部位以下心肌组织用不同浓度乙醇脱水,二甲苯透明,浸蜡、包埋、切片,脱腊,二甲苯透明,苏木素染色5 min,盐酸乙醇分化数秒,伊红染色2 min,梯度乙醇脱水,二甲苯透明,中性树脂封固,光学显微镜观察。
1.6 原位末端转移酶标记法(TdT-mediated dUTP nick end labeling,TUNEL)检测细胞凋亡将结扎部位以下心肌组织浸入多聚甲醛固定,包埋,切片,脱蜡,水合,加TUNEL反应液,PBS漂洗,加converter-POD避光30 min,PBS漂洗,与底物DAB反应显色,PBS漂洗,苏木素复染数秒,蒸馏水冲洗,梯度乙醇脱水,二甲苯透明,中性树脂封固,光学显微镜观察。每张切片随机选取10个视野,观察凋亡细胞,计算凋亡指数。凋亡指数=心肌凋亡细胞数/总心肌细胞数×100%。
1.7 蛋白质印迹法检测心肌组织中 Bcl-2、Bax和Cleaved Caspase-3的表达收集小鼠左室梗死边缘心肌组织,加入裂解液,离心后收集上清,BCA法测定蛋白浓度,煮沸变性。取样本50 g,常温下SDS-PAGE电泳,转移至PVDF膜上,5%BSA封闭2 h后,加入一抗(1∶1 000)4℃冰箱过夜,用TBST洗涤10 min×3次,再孵育二抗(1∶1 000)2 h,用TBST洗涤10 min×3次。加入曝光液显影。以GAPDH为内参,用目的蛋白与内参的比值表示其相对含量。图片采用Image J软件进行分析。
1.8 统计学处理采用SPSS 14.0软件进行统计学处理。计量资料以 x±s 表示,在正态分布且方差齐的情况下对其进行单因素方差分析,两两比较采用LSD法。检验水准(α)为0.05。
2 结 果 2.1 生存分析建模7d内,小鼠死亡8只。解剖发现7只小鼠胸腔内大量血凝块,左室前壁近心尖处有明显破口,其中AMI组2只、AMI+Silymarin组3只、AMI+Vehicle组2只。AMI+Silymarin组中1只由于结扎时位置过高,引起心室颤动不能复律而死亡。7d后至实验终点,小鼠死亡2只,其中AMI组1只、AMI+Vehicle组1只。心脏超声检查显示死亡小鼠心室前壁变薄,心室腔扩大,有明显瘢痕区,病理切片呈典型的瘢痕样改变。各组小鼠死亡率差异无统计学意义(P>0.05)。
2.2 水飞蓟素对心肌梗死小鼠心脏超声结果的影响心脏超声结果显示,AMI组小鼠心脏前后壁运动较Sham组明显减弱,左室舒张末期容积和内径增加,前壁变薄,后壁增厚,心腔明显扩大;EF降为(14.97±2.34)%,FS降为(17.82±3.61)%,与Sham组相比分别下降了79.02%和49.93%(P < 0.05)。而心肌梗死小鼠服用了水飞蓟素后,心腔扩大不明显,与Sham组相比,EF、FS仅分别下降了27.40%、26.64%;与AMI组相比,心肌梗死程度减轻,左室收缩功能得以改善(P < 0.05)。AMI+Vehicle组小鼠上述指标与AMI组相比差异没有统计学意义(P>0.05)。见图1及表1。
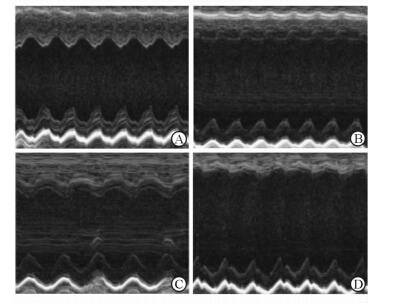
|
图 1 小鼠心脏超声影像 Fig 1 Echocardiographic assessment of mice A: Sham group; B: AMI group; C: AMI+Silymarin group; D: AMI+Vehicle group. AMI: Acute myocardial infarction |
|
|
表 1 小鼠EF和FS的比较 Tab 1 Echocardiographic assessment of EF and FS of mice in different groups |
心肌梗死后,小鼠血流动力学发生变化,LVSP和+dp/dtmax急剧下降,LVEDP上升(P < 0.05)。与Sham组相比,AMI组小鼠LVEDP升高至(15.17±3.94)mmHg(1 mmHg = 0.133 kPa),LVSP和+dp/dtmax分别下降至(82.34±5.14)mmHg和(3 896.24±407.39)mmHg/s。而AMI+Silymarin组小鼠血流动力学指标改变幅度较小,LVSP和+dp/dtmax的降幅分别由AMI组中的39.53%和27.69%减少至17.57%和10.18%,LVEDP也由AMI组中增幅120.82%减少至39.30%(P < 0.05)。AMI+Vehicle组与AMI组相比差异没有统计学意义(P>0.05)。见表2。
|
|
表 2 小鼠血流动力学结果 Tab 2 Hemodynamic parameters of mice in different groups |
Sham组心脏结构清晰,心室形态正常,心肌细胞排列整齐,未见断裂、变性及坏死,间质内未见炎细胞浸润,心内膜、心外膜亦未见异常改变(图2A)。AMI组心脏左室前壁及心尖部心肌梗死,左室进行性扩大,室壁变薄。高倍镜下见梗死区域残存少量心肌组织,排列紊乱,间隙增宽,细胞皱缩,细胞核溶解。纤维组织取代坏死组织,肉芽组织增生。梗死边缘区有少量炎性细胞浸润,瘢痕组织形成(图2B)。AMI+Silymarin组梗死面积较模型组明显减小,梗死区有岛状或细带状的存活心肌组织(图2C)。AMI+Vehicle组左室扩大,室壁变薄、心室腔球形改变,镜下见心肌梗死区由成纤维细胞和纤维细胞以及致密的胶原纤维束组成,呈束状或平行排列,胶原纤维束之间有极少残存的心肌组织,地图状瘢痕组织形成(图2D)。
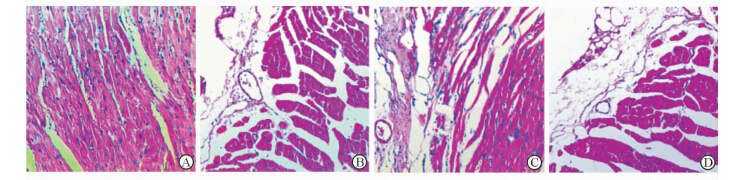
|
图 2 各组小鼠缺血边缘区心肌组织H-E染色 Fig 2 H-E staining for ischemic myocardium edge of mice in different groups A: Sham group; B: AMI group; C: AMI+Silymarin group; D: AMI+Vehicle group. AMI: Acute myocardial infarction. Original magnification: ×200 |
TUNEL标记定位于心肌细胞核,显微镜下阴性细胞核染色呈蓝色,阳性细胞核染色呈棕褐色,细胞核固缩,染色质浓集,形态多呈圆形。AMI组小鼠心肌组织中呈现大量阳性细胞核,凋亡指数增加至(53.66±3.75)%,AMI+Silymarin组切片中阳性细胞核较少,凋亡指数(29.68±4.76)%较AMI组降低(P < 0.05)。AMI+Vehicle组(55.36±6.29)%与AMI组相比差异没有统计学意义(P>0.05),见图3。
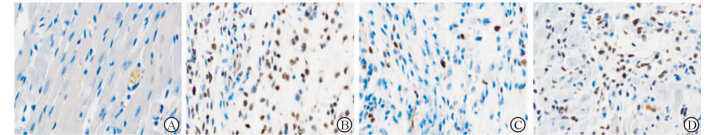
|
图 3 小鼠缺血边缘区心肌组织TUNEL染色 Fig 3 TUNEL staining for ischemic myocardium edge of mice in different groups A: Sham group; B: AMI group; C: AMI+Silymarin group; D: AMI+Vehicle group. AMI: Acute myocardial infarction. Original magnification:×200 |
与Sham组相比,AMI组心肌组织中Bax、Cleaved Caspase-3、Bcl-2蛋白表达升高(P < 0.05)。服用水飞蓟素的心肌梗死小鼠心肌组织中Bax、Cleaved Caspase-3蛋白表达较AMI组减弱,Bcl-2蛋白表达增强,差异有统计学意义(P < 0.05)。AMI+Vehicle组与AMI组相比蛋白表达水平差异没有统计学意义(P>0.05),见图4。
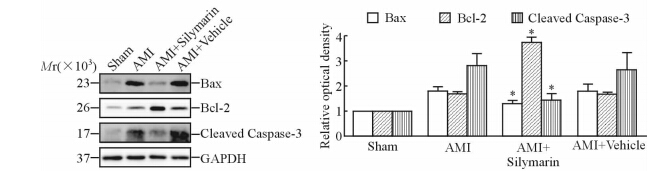
|
图 4 小鼠Bax、Bcl-2及Cleaved Caspase-3蛋白表达水平 Fig 4 Expression of Bax,Bcl-2 and Cleaved Caspase-3 detected by Western blotting analysis in mouse myocardium of different groups *P < 0.05 vs AMI group. n=15 for Sham group,n=12 for AMI group,n=11 for AMI+Silymarin group,n=12 for AMI+Vehicle group, x±s |
急性心肌梗死后,大量心肌细胞凋亡或坏死,导致活力心肌细胞数目减少、功能减退,这是心肌梗死临床表现的病理基础[6]。心肌梗死后血流动力学发生变化,LVSP、+dp/dtmax急剧下降,LVEDP上升。LVSP及LVEDP是反映心脏舒张和收缩功能的敏感指标,是评估心肌梗死预后的重要因素[7]。 本研究发现水飞蓟素能够调整LVSP、LVEDP和+dp/dtmax等血流动力学指标,同时心脏超声检查及组织病理学检测证实心肌梗死程度减轻,心功能得到改善,说明水飞蓟素能够减轻心肌梗死造成的损伤。
在大鼠心肌梗死的研究中,Kajstura等[8]发现梗死区86%细胞丢失源于心肌细胞凋亡。在人心肌梗死的心肌缺血再灌注损伤研究中,在梗死区及非梗死区交界区发现大量DNA碎片,证实细胞凋亡参与心肌梗死的形成[9]。细胞凋亡途径复杂,受一系列基因、生长因子和蛋白调控。Bcl-2蛋白质家族是参与细胞凋亡的主要调节因子,是迄今为止细胞凋亡中研究最深入的调控因子。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax以同源或异源二聚体形式共同调节,其蛋白表达水平和功能状态之间的平衡是细胞存亡的关键因素。当Bax表达增加或(和)Bcl-2表达减少时,会激活Caspase-3 表达,剪切DNA,导致心肌细胞凋亡[10]。在介导细胞凋亡的过程中Caspase家族起着非常重要的作用,其中Cleaved Caspase-3为关键的执行分子,在凋亡信号转导的多条途径中发挥功能。在凋亡的早期阶段,Caspase-3被激活裂解为Cleaved Caspase-3,通过活化脱氧核糖核酸酶降解DNA,最终导致细胞凋亡[11]。本研究发现水飞蓟素能够减少心肌梗死小鼠心肌细胞凋亡数量,增加抗凋亡相关蛋白Bcl-2的表达并减少凋亡蛋白Bax、Cleaved Caspase-3 的表达水平,说明水飞蓟素可能通过抑制心肌细胞凋亡减轻心肌梗死。
本研究发现水飞蓟素能够改善心肌梗死小鼠血流动力学,减少心肌细胞凋亡数量,缩小梗死面积,其机制与调控凋亡相关蛋白Bcl-2、Bax及Cleaved Caspase-3 的表达水平有关,但心肌梗死细胞凋亡途径复杂,确切的作用机制需要进行更深入的研究。
| [1] | Hoffmann J, Shmeleva E, Boag S E, Fiser K, Bagnall A, Murali S, et al. Myocardial ischemia and reperfusion leads to transient CD8 immune deficiency and accelerated immunosenescence in CMV-seropositive patients[J].Circ Res, 2015, 116:87-98. |
| [2] | Vargas-Mendoza N, Madrigal-Santillan E, Morales-Gonzalez A, Esquivel-Soto J, Garcia-Luna Y, Gonzalez-Rubio M, et al. Hepatoprotective effect of silymarin[J]. World Hepatol, 2014, 6: 144-149. |
| [3] | Rao P R, Viswanath R K. Cardioprotective activity of silymarin in ischemia-reperfusion-induced myocardial infarction in albino rats[J]. Exp Clin Cardiol, 2007, 12: 179-187. |
| [4] | Zhao J, Agarwal R. Tissue distribution of silibinin, the major active constituent of silymarin, in mice and its association with enhancement of phase Ⅱ enzymes: implications in cancer chemoprevention[J]. Carcinogenesis, 1999, 20: 2101-2108. |
| [5] | Gao E, Lei Y H, Shang X, Huang Z M, Zuo L, Boucher M, et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J].Cric Res, 2010, 107: 1445-1453. |
| [6] | Xu L, Yates C C, Lockyer P, Xie L, Bevilacqua A, He J, et al. MMI-0100 inhibits cardiac fibrosis in myocardial infarction by direct actions on cardiomyocytes and fibroblasts via MK2 inhibition[J]. J Mol Cell Cardiol, 2014, 77: 86-101. |
| [7] | Harada M, Qin Y, Takano H, Minamino T, Zou Y, Toko H, et al. G-CSF prevents cardiac remodeling after myocardial infarction by activating the Jak-Stat pathway in cardiomyocytes[J]. Nat Med, 2005, 11: 305-311. |
| [8] | Kajstura J, Cheng W, Reiss K, Clark W A, Sonnenblick E H, Krajewski S, et al. Apoptotic and necrotic myocyte cell death are independent contributing variables of infarct size in rats[J]. Lab Invest, 1996, 74: 86-107. |
| [9] | Saraste A, Pulkki K, Kallajoki M, Henriksen K, Parvinen M, Voipio-Pulkki L M. Apoptosis in human acute myocardial infarction[J]. Circulation, 1997, 95: 320-323. |
| [10] | Yamaguchi M. The anti-apoptotic effect of regucalcin is mediated through multisignaling pathways[J]. Apoptosis, 2013, 18: 1145-1153. |
| [11] | Biala A K, Kirshenbaum L A. The interplay between cell death signaling pathways in the heart[J]. Trends Cardiovasc Med, 2014, 24: 325-331. |
 2015, Vol. 36
2015, Vol. 36


