结肠癌是我国常见的消化道恶性肿瘤之一[1, 2]。近年来,随着人民生活水平的提高和饮食结构的变化,结肠癌的发病率呈逐年上升趋势。尽管随着手术以及化疗等技术的日臻完善,结肠癌患者的生存期得到了有效的延长,但长期疗效仍不理想。造成结肠癌患者长期生存率低下的主要原因为肿瘤的复发和转移[1, 2]。
线粒体是真核生物细胞中重要的细胞器,被认为是调节细胞功能的多信号通路综合平台,其对真核生物的生存、发育、衰老和疾病的发生等具有重要的调控作用[3, 4]。线粒体呼吸链位于线粒体内膜上,由5个复合物组成,复合物Ⅰ是线粒体呼吸链上的第一个同时也是最大的一个呼吸复合物[5]。线粒体呼吸链通过一系列的氧化还原过程最终形成三磷酸腺苷(ATP),为细胞提供能量。以往研究结果显示,线粒体呼吸链功能异常可导致多种线粒体疾病如线粒体肌病、共济失调并发色素性视网膜炎等,严重威胁身体健康[6, 7]。但目前,有关线粒体呼吸链功能异常对肿瘤细胞生物学活性的研究较少。本研究采用线粒体呼吸链复合物Ⅰ的特异性抑制剂鱼藤酮干预体外培养的结肠癌细胞株Caco2,继而通过细胞学实验检测抑制线粒体呼吸链复合物Ⅰ活性对Caco2细胞迁移、侵袭能力的影响,从而探讨线粒体呼吸链复合物Ⅰ在结肠癌转移发生中的作用。
1 材料和方法 1.1 材料结肠癌细胞株Caco2购自中国科学院上海生命科学研究院细胞资源中心。 DMEM培养基、胎牛血清(FBS)购自Invitrogen公司,Transwell小室购自BD公司,鱼藤酮及Matrigel购自Sigma公司,线粒体呼吸链复合物Ⅰ活性及胞内活性氧(reactive oxygen species,ROS)水平检测试剂盒购自GENMED公司。
1.2 细胞培养Caco2细胞使用DMEM(含10%FBS)培养基于5% CO2、37℃条件下培养。培养至对数生长期后在培养基中添加鱼藤酮至终浓度分别为0、0.5、1.0、1.5、2.0 μmol/L。48 h后检测细胞内线粒体呼吸链复合物Ⅰ活性。
1.3 线粒体呼吸链复合物Ⅰ活性检测线粒体呼吸链复合物Ⅰ活性检测按照试剂盒说明书操作:取1×107细胞,加入1 mL细胞裂解液,充分混匀裂解细胞,4℃,15 000×g离心10 min,取上清,4℃保存待用;设定分光光度计测量波长为340 nm,并置零;取500 μL缓冲液,加入500 μL反应液及500 μL阴性液混合,测量值作为背景值;500 μL细胞裂解液,加入500 μL缓冲液及500 μL反应液混合均匀,测量值作为数据值;特异性呼吸链复合物Ⅰ活性=数据值-背景值。
1.4 细胞迁移能力检测Transwell小室放入预先每孔加有600 μL培养基(含10%FBS的24孔板内,随后在Transwell的内室加入100 μL Caco2细胞悬液(含0.1%FBS的培养基,1×103 /孔),37℃培养24 h 后取出Transwell小室。用棉签擦去黏附于膜上室面的细胞后将膜置于70%乙醇常温固定30 min,0.1%结晶紫常温染色10 min,清水漂净,显微镜下计数显色细胞,计算迁移细胞占总细胞的百分比。
1.5 细胞侵袭能力检测Matrigel(5 μg/mL)稀释液包被Transwell小室底部膜的上室面,无菌条件下4℃干燥。随后把Transwell小室倒置,在Transwell小室的膜的下室面预涂纤连蛋白(10 μg/mL),37℃静置2 h。 PBS漂洗一遍后,放入预先每孔加有600 μL培养基(含10%FBS)的24孔板内,随后在Transwell的内室加入100 μL Caco2细胞悬液(含0.1%FBS的培养基,1×103 /孔),37℃培养24 h 后取出Transwell小室。用棉签擦去黏附于膜上室面的细胞后将膜置于70%乙醇中常温固定30 min,0.1%结晶紫常温染色10 min,清水漂净,显微镜下计数显色细胞,计算侵袭细胞占总细胞的百分比。
1.6 胞内ROS水平检测 取1×107细胞,500×g离心弃上清;用清理液洗涤细胞1次;加入2 mL含有染色液和稀释液的染色工作液,轻柔混匀,放进37℃恒温水槽避光孵育20 min;500×g离心5 min,弃上清后加入预冷的500 μL保存液,轻柔混匀细胞颗粒群,行细胞流式术分析荧光细胞比例。 1.7 统计学处理采用SPSS 15.0软件分析,实验数据用x± s 表示,两样本均数比较采用独立样本t检验,多组间均数比较采用方差分析(ANOVA),检验水准(α)为0.05。
2 结 果 2.1 Caco2细胞线粒体呼吸链复合物Ⅰ活性结果显示1.0、1.5、2.0 μmol/L处理组线粒体呼吸链复合物Ⅰ活性均低于0 μmol/L处理组(P < 0.01),而1.0、1.5、2.0 μmol/L处理组间呼吸链复合物Ⅰ的活性差异无统计学意义(图 1)。因此,本研究选择1.0 μmol/L鱼藤酮处理细胞。

|
图 1 鱼藤酮对Caco2细胞线粒体呼吸链复合物Ⅰ活性的影响 Fig 1 Activity of mitochondrial respiratory chain complex I in Caco2 cells treated with or without rotenone **P < 0.01 vs control (0 μmol·L-1)group. n=4, x± s |
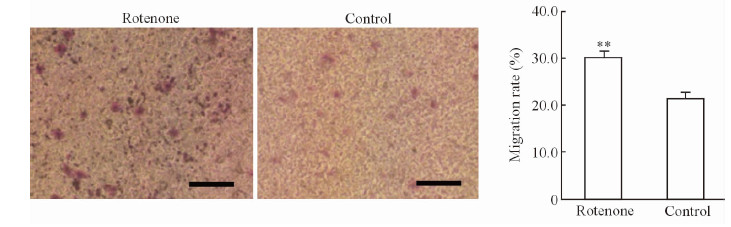
通过Transwell小室实验对细胞的体外迁移能力进行检测,结果显示,经鱼藤酮处理的Caco2细胞迁移率为(30.4±1.4)%,高于未处理Caco2细胞的迁移率(22.6±1.4)%,差异有统计学意义(P < 0.01,图 2)。提示鱼藤酮抑制线粒体呼吸链复合物Ⅰ活性后增强了Caco2细胞的迁移能力。
|
图 2 鱼藤酮(1.0 μmol/L)抑制细胞线粒体呼吸链复合物Ⅰ活性对Caco2细胞迁移能力的影响 Fig 2 Migration capability of Caco2 cells treated with or without rotenone(1.0 μmol/L) Bar=100 μm; **P < 0.01 vs control. n=4, x± s |
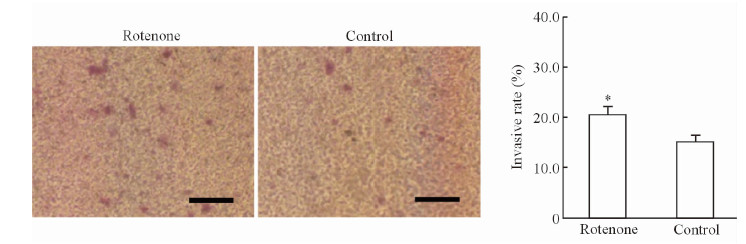
通过Matrigel包被的Transwell小室实验对细胞的侵袭能力进行检测,结果显示经鱼藤酮干预处理的Caco2细胞及未干预的Caco2细胞的侵袭率分别为(20.3±1.0)%和(15.2±1.3)%,差异有统计学意义(P < 0.05,图 3)。提示鱼藤酮抑制线粒体呼吸链复合物Ⅰ活性后增强了Caco2细胞的侵袭能力。
|
图 3 鱼藤酮(1.0 μmol/L)抑制细胞线粒体呼吸链复合物Ⅰ活性对Caco2细胞侵袭能力的影响 Fig 3 Invasive capability of Caco2 cells treated with or without rotenone (1.0 μmol/L) Bar=100 μm; **P < 0.05 vs control. n=4, x± s |
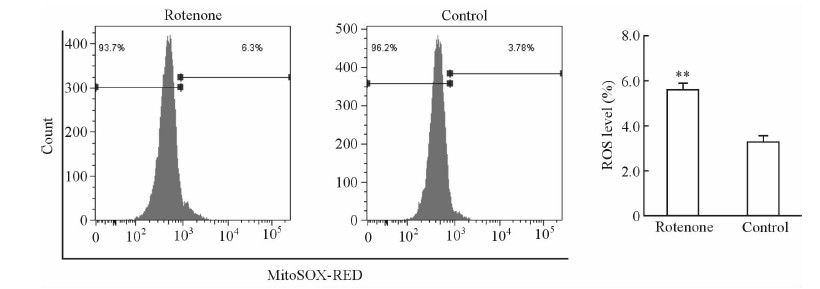
1 μmol/L鱼藤酮干预组细胞的ROS水平为(5.68±0.44)%,高于未干预组(3.46±0.30)%,差异有统计学意义(P < 0.01,图 4)。提示鱼藤酮抑制Caco2细胞内线粒体呼吸链复合物Ⅰ活性后可致使胞内ROS水平上升,从而增强细胞的迁移侵袭能力。
|
图 4 鱼藤酮(1 μmol/L)干预对Caco2细胞胞内ROS水平的影响 Fig 4 The reactive oxygen species (ROS) level in Caco2 cells treated with of without rotenone (1.0 μmol/L) **P < 0.01 vs control. n=4, x± s |
肿瘤转移是一个多步骤、多环节的过程,其分子机制涉及癌基因、抑癌基因、转移相关基因、生长因子及其受体、黏附分子及细胞外基质、肿瘤血管、机体免疫等多个环节[8]。探索肿瘤转移发生机制并开展相应靶向治疗一直是肿瘤研究领域的热点。
线粒体是真核生物细胞中重要的细胞器,随着研究的不断深入,人们对线粒体功能的认识已由最初单纯的“细胞能量工厂”拓展为调节细胞功能的多信号通路综合平台[3, 4]。研究表明,线粒体在合成ATP为细胞提供能量的同时,可调节细胞的氧化还原电势和信号转导,进而调控细胞氧化应激、凋亡、基因表达等多种生理反应[9]。因此线粒体功能对调控真核生物的生存、发育、衰老和疾病的发生等生理过程具有重要的作用[10, 11, 12]。近年来,有研究结果显示在肺癌、肝癌和肾癌等数种肿瘤细胞中检测到线粒体功能障碍[13, 14, 15],因此线粒体功能在肿瘤病因学方面的研究逐渐得到重视。
线粒体呼吸链复合物(也称为线粒体呼吸链酶、线粒体呼吸链复合酶)位于线粒体内膜上,其功能为通过一系列的氧化还原过程最终形成ATP,为机体组织提供能量。线粒体呼吸链复合物由5个复合物组成,线粒体呼吸链复合物Ⅰ(也称CoQ还原酶、NADH脱氢酶)在ATP的生成过程中发挥关键作用[5, 6, 7]。以往研究显示,线粒体呼吸链复合物Ⅰ功能缺陷导致的ATP合成障碍可引起多脏器的损伤[5, 6, 7],但对于线粒体呼吸链复合物Ⅰ在肿瘤发生发展中的作用报道较少。Ishikawa等[16]通过细胞杂合技术研究发现,将低转移性的小鼠纤维肉瘤细胞株的线粒体替换为高转移性肿瘤细胞株的线粒体构建的杂合细胞具有与高转移性细胞株一致的高转移能力;反之,将高转移性肿瘤细胞株的线粒体替换为低转移性肿瘤细胞株的线粒体后,杂合细胞不具有高转移能力。进一步的研究显示,高转移性肿瘤细胞中编码线粒体呼吸链复合物Ⅰ亚基的基因突变导致线粒体呼吸链复合物Ⅰ活性下降可能是导致肿瘤细胞转移活性增强的原因[16, 17]。本研究中,我们通过用线粒体呼吸链复合物Ⅰ的特异性抑制物鱼藤酮抑制结肠癌细胞Caco2线粒体呼吸链复合物Ⅰ活性后,Caco2的体外迁移及侵袭能力出现明显上升,提示线粒体呼吸链复合物Ⅰ的活性下降可能在结肠癌转移发生过程中发挥重要作用。
ROS与肿瘤发生发展密切相关[18]。ROS的增加可引起羟基游离产物羟基脱氧鸟苷的大量贮积,促进DNA突变进而引起细胞氧化磷酸化功能异常。有研究显示,电离辐射所致DNA损伤与ROS的产生有关,此外多种化学物质在其自发氧化过程中产生的大量ROS是其致癌的主要原因[17]。在细胞内,ROS是调节电子传递的副产品,而线粒体呼吸链是产生ROS的主要来源,其中线粒体呼吸链复合物Ⅰ是调控胞内ROS产生的最主要部位[19]。本研究中,我们通过鱼藤酮特异性抑制Caco2的线粒体呼吸链复合物Ⅰ活性后,细胞内ROS水平明显上升,由此推测线粒体呼吸链复合物Ⅰ功能下降可能引发了ROS在胞内的过量积聚,进而导致了结肠癌细胞转移能力显著增强。
综上,本研究从细胞生物学角度探讨了线粒体呼吸链复合物Ⅰ对结肠癌细胞Caco2迁移侵袭能力的影响,结果显示抑制线粒体呼吸链复合物Ⅰ具有增强结肠癌细胞迁移侵袭能力的作用。在以后的研究中,将进一步探索线粒体呼吸链复合物Ⅰ相关基因的变异与线粒体呼吸链复合物Ⅰ活性的相关性并探讨其在结肠癌转移中的作用,以更好地揭示线粒体调控结肠癌转移的机制,从而为结肠癌转移诊断、预防及治疗提供新的思路和理论基础。
| [1] | 刘荫华, 姚宏伟. 结直肠癌外科手术的原则与进展[J]. 中华消化外科杂志, 2013, 12: 401-404. |
| [2] | 付金金, 林英豪, 肖 冰. 大肠癌的综合治疗[J]. 现代消化及介入诊疗, 2013, 18: 115-118. |
| [3] | Scheffler I E.A century of mitochondrial research: achievements and perspectives[J].Mitochondrion, 2001, 1:3-31. |
| [4] | McBride H M, Neuspiel M, Wasiak S.Mitochondria: more than just a powerhouse[J].Curr Biol, 2006, 16:R551-R560. |
| [5] | Swalwell H, Kirby D M, Blakely E L, Mitchell A, Salemi R, Sugiana C, et al.Respiratory chain complex Ⅰ deficiency caused by mitochondrial DNA mutations[J].Eur J Hum Genet, 2011, 19:769-775. |
| [6] | Schapira A H V. Mitochondrial diseases[J]. Lancet, 2012, 379: 1825-1834. |
| [7] | Bratic A, Larsson N G.The role of mitochondria in aging[J].J Clin Invest, 2013, 123:951-957. |
| [8] | Wan L, Pantel K, Kang Y.Tumor metastasis: moving new biological insights into the clinic[J].Nat Med, 2013, 19:1450-1464. |
| [9] | Murphy M P.How mitochondria produce reactive oxygen species[J].Biochem J, 2009, 417:1-13. |
| [10] | James D I, Martinou J C.Mitochondrial dynamics and apoptosis: a painful separation[J].Dev Cell, 2008, 15:341-343. |
| [11] | Jeong S Y, Seol D W. The role of mitochondria in apoptosis[J]. BMB Rep, 2008, 41:11-22. |
| [12] | Grandemange S, Herzig S, Martinou J C.Mitochondrial dynamics and cancer[J].Semin Cancer Biol, 2009, 19:50-56. |
| [13] | Johannsen D L, Ravussin E.The role of mitochondria in health and disease[J].Curr Opin Pharmacol, 2009, 9:780-786. |
| [14] | Gaude E, Frezza C.Defects in mitochondrial metabolism and cancer[J].Cancer Metab, 2014, 2:10. |
| [15] | Sotgia F, Whitaker-Menezes D, Martinez-Outschoorn U E, Flomenberg N, Birbe R C, Witkiewicz A K, et al.Mitochondrial metabolism in cancer metastasis: visualizing tumor cell mitochondria and the "reverse Warburg effect" in positive lymph node tissue[J].Cell Cycle, 2012, 11:1445-1454. |
| [16] | Ishikawa K, Takenaga K, Akimoto M, Koshikawa N, Yamaguchi A, Imanishi H, et al.ROS-generating mitochondrial DNA mutations can regulate tumor cell metastasis[J].Science, 2008, 320:661-664. |
| [17] | Tan A S, Baty J W, Berridge M V.The role of mitochondrial electron transport in tumorigenesis and metastasis[J].Biochim Biophys Acta, 2014, 1840:1454-1463. |
| [18] | Parri M, Chiarugi P. Redox molecular machines involved in tumor progression[J].Antioxid Redox Signal, 2013, 19:1828-1845. |
| [19] | Sena L A, Chandel N S.Physiological roles of mitochondrial reactive oxygen species[J].Mol Cell, 2012, 48:158-167. |
 2015, Vol. 36
2015, Vol. 36


