2. 温州市中心医院放射影像科, 温州 325000;
3. 第二军医大学长海医院影像医学科, 上海 200433
2. Department of Radiology, Wenzhou Central Hospital, Wenzhou 325000, Zhejiang, China;
3. Department of Radiology, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
胰腺导管腺癌(ductal adenocarcinoma of pancreas,DACP)占胰腺外分泌癌的90%,近年来在我国的发病率逐年上升,占恶性肿瘤发病率第7位,严重威胁人类健康[1, 2, 3]。但与胃癌、肠癌等消化道常见肿瘤相比,DACP发病率仍较低,且存在明显的地域分布不均的特点,其中上海市胰腺癌发病率位居我国榜首(13.56/10万~16.83/10万),病死率最高[2, 3]。
DACP术前诊断主要依靠影像学检查,由于其发病率相对较低、地域性分布不均、影像学特征多变,影像科医师对其认识水平参差不齐,极易造成误诊。因此,本研究回顾性复习第二军医大学长海医院2009年至2014年51例误诊DACP患者影像学资料,对比分析影像学特征与病理标本,探讨可能的误诊原因,提高其影像学诊断水平,为临床诊治提供准确的决策依据。
1 资料和方法 1.1 一般资料2009年至2014年第二军医大学长海医院共收治误诊DACP患者51例,其中男13例,女38例,年龄37~79岁,中位年龄54岁。5例无明显症状,为体检发现;46例临床症状包括:黄疸、白陶土样大便、全身瘙痒、食欲减退、消瘦、低热、腹胀、腹痛、腰背部放射痛、腹泻等。47例患者CA19-9指标高于正常,其中29例CA19-9>400 U/L。27例患者血淀粉酶、尿淀粉酶高于正常。
1.2 影像学检查所有患者来第二军医大学长海医院初诊均行CT平扫加增强检查和MRI平扫加增强检查。CT检查采用飞利浦16层螺旋CT扫描仪、西门子64层CT扫描仪。螺距1.0~1.2 mm,层厚4 mm。增强选用非离子对比剂碘海醇(含碘300 mg/mL)80~90 mL,注射速率3~4 mL/s,分别于注射对比剂后20~25 s、60~70 s、110~130 s进行3期扫描。
MR检查分别采用西门子1.5 T Avanto全身扫描仪和西门子1.5 T Syngo全身扫描仪。扫描采用8通道腹部表面线圈,扫描序列:T2WI为快速反转恢复脂肪抑制自旋回波序列,回波时间(echo time,TE) 86 ms,重复时间(repetition time,TR) 6 300 ms;T1WI为三维容积内插快速扰相梯度回波序列,T1 5 ms,TE 2.6 ms,TR 5.8 ms;磁共振胆道水成像(magnetic resonance cholangiopancreatography,MRCP)序列,TE 1 274 ms,TR 7 000 ms。层厚和层间距分别采用4.0 mm和1.2 mm。钆喷酸葡胺注射液增强,剂量0.1 mL/kg,注射流速2 mL/s,分别于注射对比剂后20~25 s、60~70 s、110~130 s进行3期扫描。
1.3 误诊原因回顾分析术后病理确诊后,由1名长期从事胰腺影像研究的副主任医师对术前影像资料与病理标本对比研究,回顾分析误诊原因,总结经验教训。
2 结 果 2.1 一般情况51例患者中有20例被误诊为“胰腺囊性肿瘤”或“胰腺囊肿”;16例误诊为“胰腺炎伴假性囊肿”;15例误诊为“局灶性胰腺炎”,其中4例进行超声内镜下引导的细针穿刺活检,均未发现癌细胞。
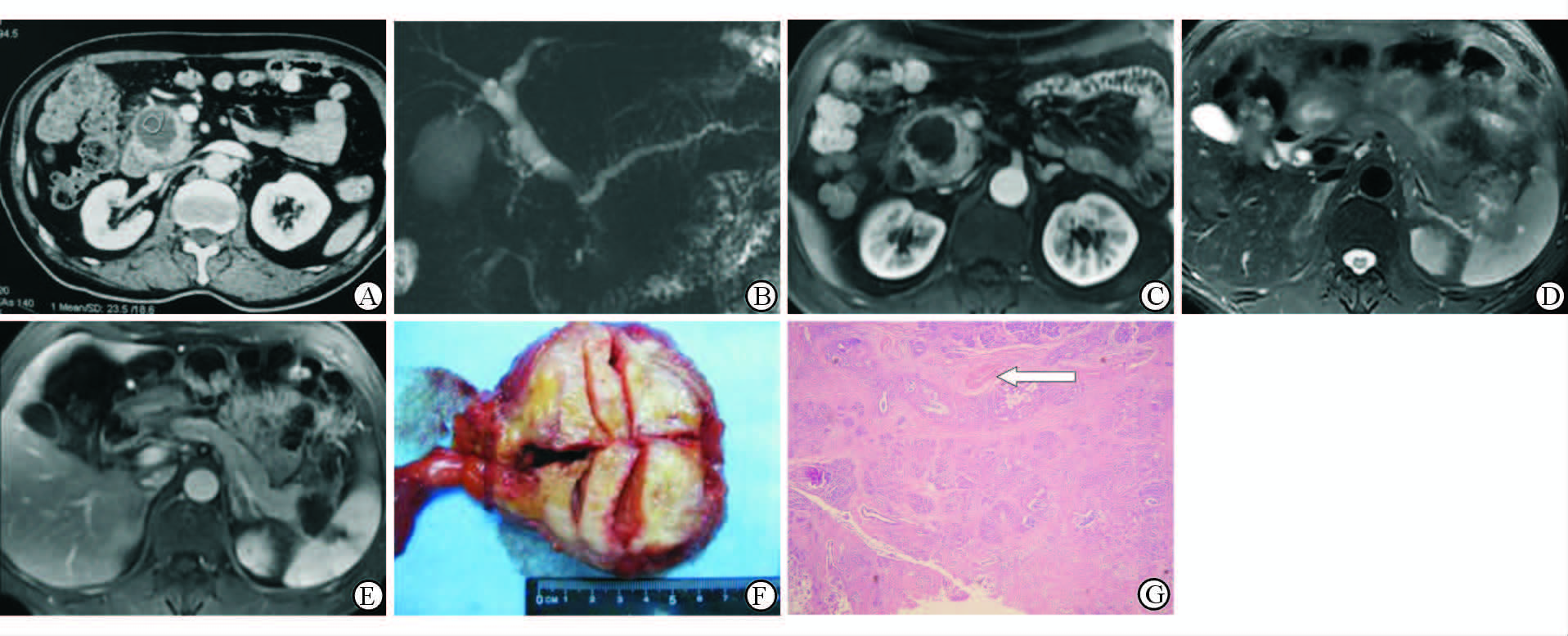
2.2 DACP误诊为“囊性肿瘤”或“囊肿”患者的影像及病理特征 2.2.1 术前影像12例位于胰头,8例位于胰尾。肿块CT平扫为等低密度,CT值21~34 Hu,增强后CT值增加不超过10 Hu,几乎没有变化(图1A~1C)。MR T1WI低信号、T2WI等高或等信号,MRCP未见囊性高信号,增强后未见强化(图 1D、1E)。除3例位于胰尾末端者,其余17例可见上游主胰管扩张并至肿瘤处“截断”。12例位于胰头者可见胆总管胰腺段受阻,胆道扩张。
|
图 1 DACP误诊为“胰腺囊肿”(A~C,F,G)或“黏液性囊腺瘤”(D,E)患者术前影像与术后病理对照 DACP: 胰腺导管腺癌;MRCP: 磁共振胆道水成像. A: CT增强延迟期,可见胰头无明显强化肿块,CT值25 Hu(平扫23 Hu); B: MRCP MIP图像,可见胰头无囊肿信号; C: MR T1WI增强延迟期,可见胰头肿块无明显强化. D: MR T2WI横断位,可见胰尾有一等高信号边缘不清晰肿块; E: T1WI增强延迟期,可见胰头肿块无明显强化; F: DACP误诊为“胰腺囊肿”患者大体标本,肿瘤呈灰白色实性,完全无囊性成分(手术医师将肿瘤剖开寻找影像报告所称“囊肿”); G: H-E染色镜下可见肿瘤内几乎无血管结构,仅肿瘤与正常胰腺组织交界处可见血管(白色箭头; Original magnification: ×50) |
术后病理显示全部为实性肿瘤(图 1F),肿瘤内无任何囊变,质地坚韧,镜下为大量纤维胶原和少量肿瘤性腺泡组织,几乎无血管成分(图 1G)。所有患者病理分级为低分化腺癌。
2.3 DACP误诊为“胰腺炎伴假性囊肿”患者的影像及病理特征 2.3.1 术前影像胰头5例,胰颈1例,胰体4例,胰尾6例。胰腺节段性CT密度降低,MR T1WI低信号、T2WI等或等高信号。胰周可见渗出,14例病变段主胰管方向上游可见单个囊肿;2例病变段受多个囊肿包绕(图 2A)。囊肿大小约1.0~4.0 cm。5例囊腔内可见CT等高密度、MR T1WI高信号、T2WI低信号;其余囊腔内呈现CT低密度、MR T1WI低信号、T2WI高信号。囊壁厚度不均匀,最厚者不超过2 mm,最薄处在0.1 mm以下,难以测量。所有囊腔周围脂肪内均出现渗出表现。其中2例囊壁与脾脏分界不清晰(图 2A)。增强后,14例伴发单囊病变与正常胰腺组织交界处出现边界不清的轻度强化结节;2例伴发多囊的病例在囊腔中央可见边界不清晰的轻度强化结节,结节大小约0.8~2.0 cm。除发生于胰尾末端的5例外,其余11例均出现病变段内主胰管轻度扩张并至病变处“截断”征象(图 2B)。

|
图 2 胰腺导管腺癌误诊为“胰腺炎伴假性囊肿”患者术前影像与术后病理对照 A: CT增强延迟期可见胰尾巨大囊肿边缘不清晰的轻度强化实性肿块(白色箭头); B: CT增强延迟期,可见胰体多个囊肿包绕不规则轻度强化肿块,上游胰管扩张并“截断”(白色箭头); C: 患者大体标本,可见囊腔下游灰黄色肿块(白色箭头),囊壁与脾脏及肾脏粘连; D: 肿块周围囊肿病理切片H-E染色可见囊肿内大片坏死无结构红染,周围纤维胶原包裹,并伴炎性细胞浸润,为典型假性囊肿 (Original magnification: ×50) |
4例患者术中囊壁无法剥脱而导致破裂。大体标本可见囊肿下游或多个囊腔中央的灰白色或灰黄色肿块(图 2C)。5例囊腔内可见红色液体,囊内壁为深褐色。囊壁结构在镜下可见为无上皮组织覆盖的纤维胶原,伴有大量炎细胞浸润(图 2D),符合假性囊肿诊断标准。2例为高分化腺癌,4例为中分化腺癌,10例为低分化腺癌。
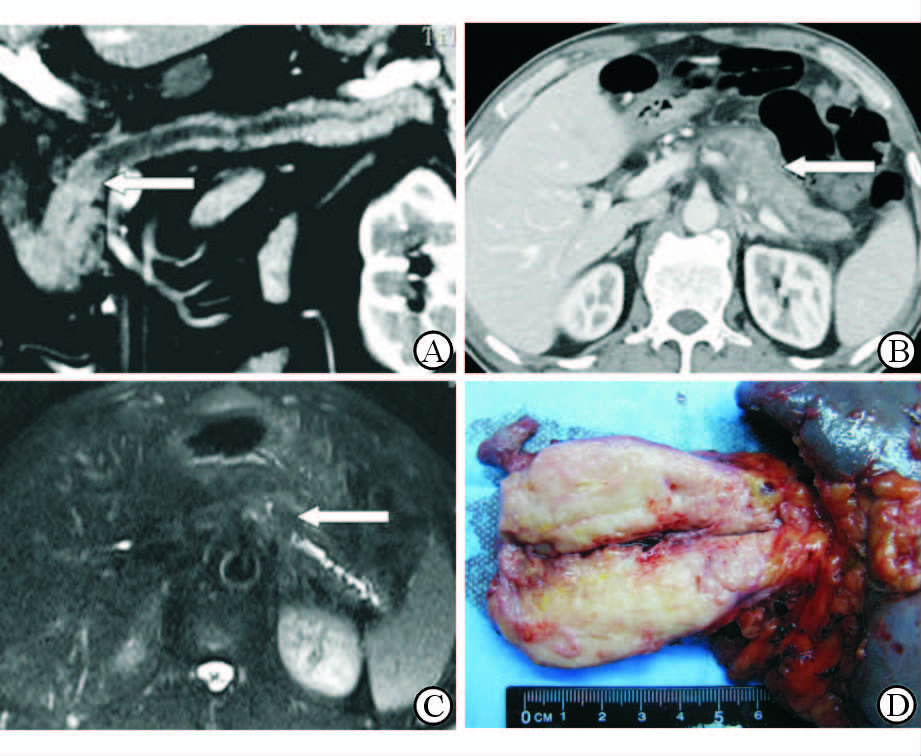
2.4 DACP误诊为“局灶性胰腺炎” 患者的影像及病理特征 2.4.1 术前影像11例病变占据胰腺体部、尾部,4例占据胰腺颈、体、尾部。CT扫描显示病变段密度降低,MR T1WI低信号、T2WI等或等高信号。胰腺体积肿胀,胰腺周围有渗出。增强后,9例动脉期病变段强化弱于正常胰腺组织,门脉期后强化与正常组织相仿;同时,在病变段与正常胰腺组织交界处出现不规则明显弱强化结节,大小约0.5~1.2 cm,上游主胰管轻度扩张,至病变段与正常胰腺组织交界处“截断”(图 3A)。6例病变段各期扫描均弱于正常胰腺组织,肿瘤与发生炎症的胰腺混在一起,未能清晰显示,但可见病变段内主胰管扩张“截断”处与正常胰腺之间存在的弱强化肿块(图 3B、3C)。
|
图 3 胰腺导管腺癌误诊为“局灶性胰腺炎” 患者术前影像与术后病理对照 A: CT增强后门脉期主胰管方向曲面重建图像,可见病变段主胰管扩张并至轻度强化肿块处“截断”(白色箭头); B: CT增强门脉期,可见胰体、尾部僵硬,节段性强化较弱,胰周有渗出,但病变段胰管扩张(白色箭头); C: 磁共振胆道水成像(MRCP)横断位薄层图像,可见病变段内主胰管扩张近胰腺体尾交界部“截断”(白色箭头); D: 患者大体标本可见胰体灰白色肿块与萎缩、纤维化的胰体尾分界不清晰 |
手术病理显示胰腺组织萎缩,被脂肪和白色纤维胶原取代,肿瘤呈现灰白色或灰黄色,与萎缩伴纤维化的胰腺组织分界不清晰(图 3D)。6例为高分化腺癌,2例为中分化腺癌,7例为低分化腺癌。
3 讨 论 3.1 DACP诊断与鉴别诊断概述DACP体积较小、边界不清晰、很少坏死囊变、几乎不发生钙化,内部缺乏血管以及易阻塞胰(胆)管导致继发性改变等这些特点使其与其他胰腺实性肿瘤如腺泡细胞癌、实性-假乳头状瘤和神经内分泌肿瘤较好区分[4, 5]。但当伴发阻塞性炎症或假性囊肿时,则需要与胰腺炎鉴别。单纯急性胰腺炎发生时胰腺高度水肿或组织坏死溶解,主胰管受炎性水肿的压迫不会扩张,更不会“截断”,胰腺内也不会出现弱强化肿块。与慢性胰腺炎的鉴别需要从临床病史和影像学表现入手。一般来说,40岁以下、病程超过2年以上、胰腺内无明显弱强化肿块或肿块内有明显钙化、主胰管扩张但无“截断”,或扩张是由结石引起等临床、影像表现的,都不符合DACP影像学诊断特征[6]。
3.2 DACP常见影像学误诊原因分析 3.2.1 实性肿瘤误诊为“囊性肿瘤”或“囊肿”本研究中20例DACP在术后显示肿瘤无任何囊性成分,但因在影像检查中无明显强化被误诊为“囊性”。而这些“囊性”病灶均未在T2WI和MRCP中呈现囊性液体信号,也没有在T1WI呈现提示出血的高信号,因此提示其并非囊性病灶(囊腔内含有清亮液体或血凝块)。阅片者对DACP的“硬癌”组织结构特点不了解,存在“不强化就是囊性表现”的错误概念,忽略了MR序列特别是MRCP对囊性病变的鉴别价值[7]。DACP富含纤维胶原,组织结构排列紧密,血管稀少。而且分化程度越低,其内部血管就越稀疏,纤维胶原成分就越多[8]。因此,低分化DACP常无明显强化或仅有轻度强化,有无强化并不能说明病变就是囊性。
3.2.2 假性囊肿和阻塞性胰腺炎等继发性病变掩盖肿瘤本研究中16例DACP伴发假性囊肿,这些假性囊肿掩盖了肿瘤的存在。14例在囊肿主胰管方向下游就可见到“肇事肿瘤”,2例多囊中央可见“肇事肿瘤”。9例阻塞性胰腺炎的病变段与正常胰腺交界处可发现轻度强化的“肇事肿瘤”,另外6例肿瘤与炎症混在一起,增强后仍难以分辨,但可见主胰管扩张“截断”处与正常胰腺间的弱强化区域。因此,无明显强化或轻度强化的肿块在本研究的所有病例中出现率为100%。阅片者不了解DACP可能造成的继发改变,即“secondary signal”。 DACP起源于主胰管和较大的分支胰管,易造成胰管阻塞从而导致阻塞性胰腺炎、假性囊肿或潴留性囊肿等继发改变[8]。发生于胰头时,则容易造成胆总管胰腺段受阻。同时,DACP的生长方式为高度侵袭性,除了造成与周围胰腺组织分界不清外,也使得上述继发性改变更易发生。如继发假性囊肿或潴留性囊肿体积大于肿瘤,则更易掩盖DACP的存在。
3.2.3 胰胆管扩张并“截断”征象被忽视本研究中43例(84%)出现上游主胰管扩张并至肿瘤处“截断”征象,其余无此征象的8例肿瘤均在胰尾末端。胆总管扩张至胰腺段“截断”征象在肿瘤位于胰头的病例中占100%。肿瘤体积较小,且引发阻塞性胰腺炎,使得肿瘤本身很难在平扫或增强时被发现。此时,如果又忽视了肿瘤上游主胰管扩张、“截断”或胆总管胰腺段受阻等继发改变,就会草率将其诊断为“局限性胰腺炎”。
3.3 DACP影像学诊断经验及要点首先要了解DACP的临床特点。DACP发病率与年龄相关,好发于40岁以上人群。绝大多数DACP患者伴有腹部症状,实验室检查CA19-9敏感度最高(70%~90%)[9]。对于有可疑症状和肿瘤标记物升高的40岁以上患者必须予以注意。
其次要了解DACP本身的特点。肿瘤内部结构紧密,富含纤维胶原而缺少血管,使得肿瘤在增强扫描时呈现乏血供、弱强化表现。特别是在低分化肿瘤中,由于几乎没有血管,可以出现近乎无强化表现。此时需要依靠测量CT值加以鉴别。对于CT值在20 Hu以上者,不应轻易相信其为囊性病灶。必要时可以采用MR加以鉴别。囊性病灶在MR上的典型表现为T1WI低信号、T2WI高信号;如囊腔内有出血则会出现T1WI高信号和(或)T2WI低信号,这取决于出血的多少和时间早晚。因此对于无强化且CT值并不表现为经典水密度的肿块,不能仅因为其无强化就认定为囊性肿块,而要结合MR,特别是T2WI和MRCP。
最后,掌握DACP的继发性改变。由于高度侵袭的生长方式和容易阻塞胰管的特点,DACP几乎是发生继发性改变最常见的胰腺肿瘤。因此,DACP在就诊时往往不会生长为巨大肿块,特别是位于胰腺头颈部的DACP。因此,对于发生“胰腺炎”、“胰腺炎伴假性囊肿形成”的初次就诊病例,特别是40岁以上者,影像学检查不能仅依靠CT和MR的平扫,而必须予以增强扫描,寻找有无 “肇事肿瘤”的存在[5]。同时,对于胰(胆)管扩张并“截断”这一征象必须予以警惕。应该沿扩张的胰(胆)管方向寻找有无肿瘤存在。如果由于肿瘤体积小且伴发阻塞性胰腺炎而难以清晰显示,也可以采用短期复查的方式,待胰腺炎消退后,肿瘤就会较为清晰地显示出来。
综上所述,由于DACP发病率相对较低、地域性分布不均、影像学特征多变,术前影像学检查极易造成误诊,熟练掌握胰腺局部解剖及DACP病理组织学特点,了解其常见继发性改变的影像特征有助于避免其影像学误诊,提高术前诊断率。
| [1] | McIntyre C A, Winter J M. Diagnostic evaluation and staging of pancreatic ductal adenocarcinoma[J].Semin Oncol,2015,42:19-27. |
| [2] | 上海市疾病预防控制中心.2009年上海市市区恶性肿瘤发病率[J].肿瘤,2012,32:854. |
| [3] | 陈万青,王庆生,张思维,郑荣寿,何 慧,陈建平,等.2003-2007年中国胰腺癌发病与死亡分析[J].中国肿瘤,2012,21:248-253. |
| [4] | Stroszczynski C, Grützmann R, Kittner T. CT and MR imaging of pancreatic cancer[J].Recent Results Cancer Res,2008,177:5-14. |
| [5] | Jeffrey R B. Pancreatic cancer: radiologic imaging[J].Gastroenterol Clin North Am,2012,41:159-177. |
| [6] | Klöppel G, Adsay N V. Chronic pancreatitis and the differential diagnosis versus pancreatic cancer[J].Arch Pathol Lab Med,2009,133:382-387. |
| [7] | Fusari M, Maurea S, Imbriaco M, Mollica C, Avitabile G, Soscia F, et al. Comparison between multislice CT and MR imaging in the diagnostic evaluation of patients with pancreatic masses[J].Radiol Med,2010,115:453-466. |
| [8] | Elias J Jr, Semelka R C, Altun E, Tsurusaki M, Pamuklar E, Zapparoli M, et al. Pancreatic cancer: correlation of MR findings, clinical features, and tumor grade[J].J Magn Reson Imaging,2007,26:1556-1563. |
| [9] | Kanji Z S, Gallinger S. Diagnosis and management of pancreatic cancer[J].CMAJ,2013,185:1219-1226. |
 2015, Vol. 36
2015, Vol. 36


