2. 重庆医科大学附属第二医院妇产科, 重庆 400010;
3. 重庆医科大学附属第二医院康复医学科, 重庆 400010
2. Department of Obstetrics and Gynecology, The Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China;
3. Department of Rehabilitation Medicine, The Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
卵巢癌为女性生殖系统常见的恶性肿瘤,其中上皮性卵巢癌死亡率居妇科肿瘤首位,严重威胁着女性的生命健康。卵巢癌症状不典型,发现时已是晚期,使患者失去了手术机会,并且随着对化疗药物耐受的产生,寻求新的卵巢癌治疗方法已迫在眉睫[1]。光动力疗法(photodynamic therapy,PDT)是顺应医学发展而兴起的一种新型肿瘤治疗方法,其利用特异性聚集于肿瘤组织中的光敏剂,在特定波长的光照下被激活,发生复杂的光化学反应产生活性氧(reactive oxygen species,ROS),导致肿瘤组织不可逆的损伤[2]。焦脱镁叶绿酸甲酯(methyl pyropheophorbide-a,Mppa)属于叶绿素衍生物,为第2代新型光敏剂,于667 nm处有最大吸收峰。因其吸收性好、能量密度高、渗透性强而具有广泛的临床应用前景[3, 4, 5]。本课题通过观察Mppa介导的PDT抑制人卵巢癌SKOV3细胞活性及触发其凋亡的现象,探讨其可能的作用机制,为PDT应用于卵巢癌的临床治疗提供实验资料。
1 材料和方法 1.1 主要试剂及仪器Mppa(购于Sigma-Aldrich)用二甲亚砜(DMSO)溶解后过滤除菌,配制成浓度为10 mmol/L的储存液,-20℃避光保存;LED多波长光源由本研究小组自行开发研制;胎牛血清、RPMI1640培养基、胰蛋白酶购于HyClone;CCK-8购于日本同仁化学研究所;Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司;荧光染料DAPI购于碧云天生物技术有限公司;DCFH-DA购于Sigma;p53抗体、Caspase-3抗体购于Abacm;Bax、Bcl-2、β-actin抗体购于Proteintech;二抗购于中杉金桥生物技术有限公司。
1.2 细胞培养及实验分组人卵巢癌SKOV3细胞株购于上海复旦大学细胞库,37℃、5%CO2条件下于RPMI1640培养液(含1%青霉素-链霉素和10%胎牛血清)中常规培养。将处于对数生长期的人卵巢癌SKOV3细胞随机分为Mppa-PDT处理组(加光敏剂Mppa和LED光照处理)、空白对照组(既不加光敏剂Mppa也不接受LED光照处理)、单药对照组(仅加光敏剂Mppa处理)、单光对照组(仅接受LED光照处理)3组。Mppa-PDT组及单药对照组更换为含终浓度为2 μmol/L Mppa的培养液避光培养,空白及单光对照组加入含等浓度DMSO的培养液培养。12 h后去除含Mppa的培养液,PBS洗涤细胞3次后更换成完全培养液。Mppa-PDT组及单光对照组接受LED光照处理,波长为630 nm,连续输出方式,功率密度为30 mW/cm2,光照时间为360 s。调整光斑面积使各组细胞接受到的光照强度为10.8 J/cm2(光照强度=功率×光照时间)。
1.3 CCK-8法检测SKOV3细胞活性常规消化处于对数生长期的SKOV3细胞,以5×103/孔的密度接种于96孔板培养。待其贴壁后随机分组并进行光动力处理,光敏剂Mppa浓度分别为0、1、2、3、4、5 μmol/L,LED光照时间为0、120、240、360、480、600 s,即使其接受到的光照强度为0、3.6、7.2、10.8、14.4、18.0 J/cm2。继续避光培养24 h后加入CCK-8试剂10 μL,37℃、5%CO2条件下孵育1 h,用全波长酶标仪于450 nm波长下测定各孔光密度值(D值),取平均值,按公式计算细胞存活率:存活率(%)=(实验组D值-空白对照组D值)/(阴性对照组D值-空白对照组D值)×100%。实验组为具有细胞和CCK-8溶液且受处理的孔,空白对照组为具有培养液和CCK-8溶液而没有细胞的孔,阴性对照组为有细胞和CCK-8溶液而没有受处理的孔。
1.4 Annexin Ⅴ-FITC/PI双染流式细胞术检测Mppa-PDT诱发的SKOV3细胞凋亡常规消化处于对数生长期的SKOV3细胞,以1×105/孔的密度接种于6孔板培养。待其贴壁后随机分为组,并进行光动力处理。12 h后常规消化收集细胞,采用Annexin Ⅴ-FITC/PI双染,流式细胞仪检测细胞凋亡情况。
1.5 DAPI染色观察凋亡细胞的形态学改变将处于对数生长期的人卵巢癌SKOV3细胞接种于48孔板中,分组及处理同上。12 h后去掉原培养液,PBS轻轻洗涤细胞3次,4%多聚甲醛固定15 min,0.1%Triton X-100破膜2 min,5 μg/mL DAPI染料于暗处染色15 min,PBS洗涤细胞3次后用荧光显微镜观察并拍照。
1.6 DCFH-DA染色检测SKOV3细胞内ROS水平细胞内的ROS可以将不带荧光的DCFH-DA氧化为带绿色荧光的DCF,通过检测 DCF能够反映细胞内ROS的水平。常规消化处于对数生长期的SKOV3细胞,接种于48孔板中,待其贴壁后随机分组并进行光动力处理。1 h后去掉原培养液,PBS洗涤细胞3次,加含20 μmol/L的DCFH-DA无血清培养液,37℃、5%CO2条件下孵育30 min,弃掉培养液后PBS洗涤细胞3次,荧光显微镜下观察并拍照。另取细胞接种于96孔板中,Mppa-PDT处理1 h后,按上述方法进行DCFH-DA染色后用全波长酶标仪对ROS水平进行定量检测(激发波长为488 nm,发射波长525 nm)。
1.7 单细胞凝胶电泳观察DNA损伤单细胞凝胶电泳实验又称彗星实验,可检测DNA断裂水平,准确反映DNA损伤情况。通过观察彗星的头长、尾长及头尾比来确定DNA损伤情况。细胞接种于6孔板中,随机分组并进行光动力处理。12 h后收集细胞用于实验。1%正常熔点琼脂糖凝胶150 μL滴加于经多聚赖氨酸处理的载玻片上,4℃固化20 min后再滴加含8×103细胞的1%低熔点胶,4℃固化20 min后置于碱性裂解液中过夜,取出玻片,碱性电泳液中解旋20 min后,25 V、300 mA电泳20 min,中性缓冲液洗涤3次(每次10 min),5 μg/mL DAPI暗处染色15 min,蒸馏水洗15 min,置于荧光显微镜下观察并拍照。
1.8 蛋白质印迹法检测凋亡相关蛋白处于对数生长期的实验组和对照组细胞,经PBS洗涤后于冰上加入裂解液RIPA及PMSF(RIPA∶PMSF=100∶1),提取细胞全蛋白,BCA法测各组蛋白浓度。取等质量各组蛋白进行SDS-PAGE,湿转法将蛋白质转移至0.45 μm的PVDF膜上,经封闭、孵育一抗(1∶1 000)、二抗(1∶1 000)后采用ECL化学发光法显色,观察各组相应蛋白的表达情况。以β-actin为内参,以目的蛋白条带和β-actin条带的灰度比值进行半定量。
1.9 统计学处理所得数据采用SPSS 17.0统计软件分析。数据以x±s表示,组间数据的差异比较采用单因素方差分析及两因素方差分析,两两比较采用SNK-q法。检验水准(α)为0.05。
2 结果 2.1 Mppa-PDT抑制人卵巢癌SKOV3细胞活性如图 1所示,在0~5 μmol/L浓度范围内单纯的Mppa对细胞活性无影响,在0~18.0 J/cm2的光照强度范围内单纯的光照对细胞活性也几乎无影响。Mppa联合光照对细胞活性有明显的抑制作用,且其抑制作用呈剂量依赖性。本研究在后续的实验中参考以往研究[6]选择2 μmol/L的Mppa用于实验。
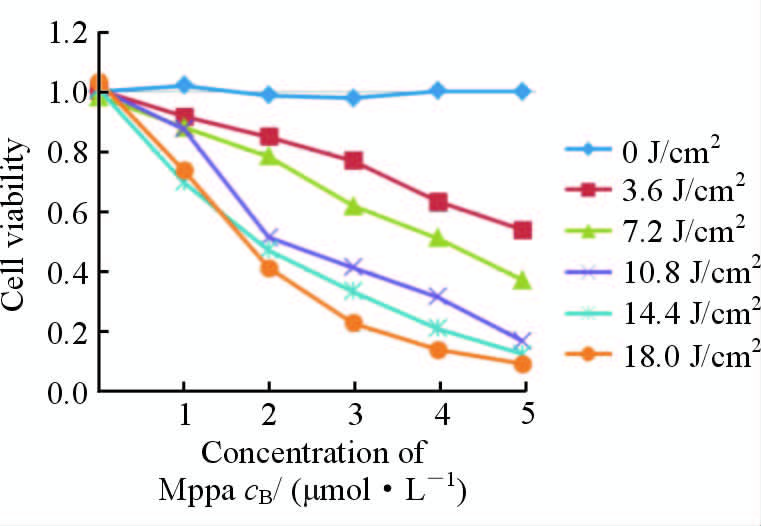
|
图 1 CCK-8法检测人卵巢癌细胞SKOV3的活性 Fig 1 Viability of SKOV3 cells detected by cell counting kit-8 Mppa:Methyl pyropheophorbide-a |
PDT处理(2 μmol/L Mppa接受10.8 J/cm2光照)人卵巢癌SKOV3细胞12 h后,流式细胞术检测细胞凋亡情况,结果见图 2。Mppa-PDT组人卵巢癌细胞SKOV3的凋亡率[(28.30±1.96)%]高于空白对照组[(2.43±0.24)%]、单药对照组[(2.86±0.41)%]和单光对照组[(2.95±0.36)%](P < 0.05),Mppa-PDT组凋亡率分别为空白、单药、单光对照组的11.65、9.90、9.60倍,且空白、单药、单光3对照组组间细胞凋亡率差异无统计学意义(P>0.05)。
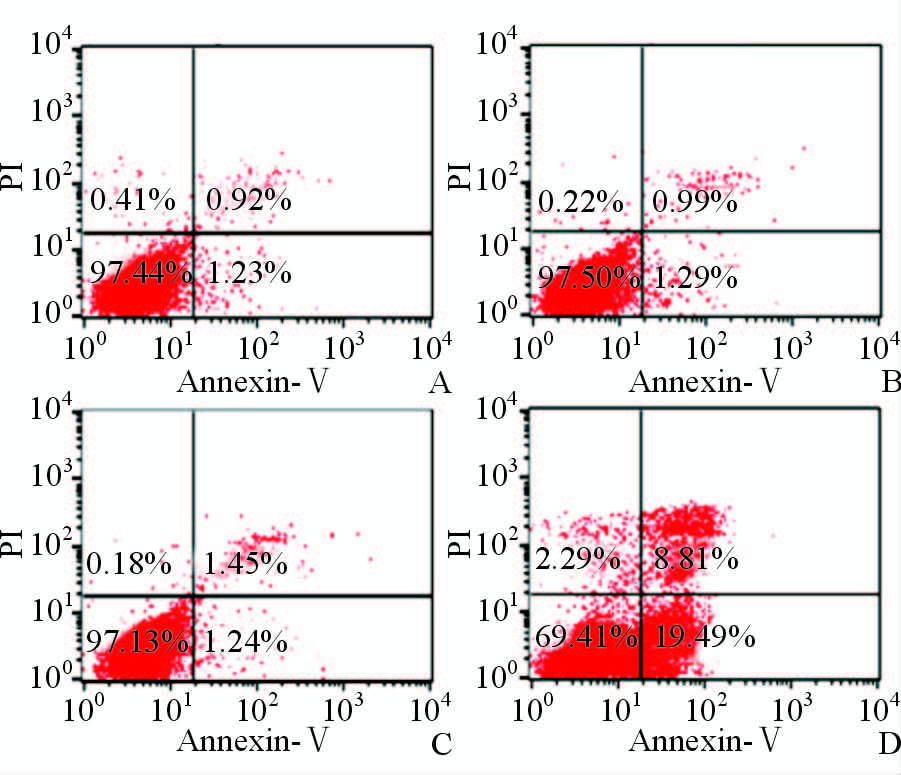
|
图 2 流式细胞术检测人卵巢癌SKOV3细胞凋亡情况 Fig 2 Analysis of apoptosis in SKOV3 cells in different groups by flow cytometry A: Blank group; B: Only Mppa treated group; C: Only PDT treated group; D: Mppa-PDT group. PDT: Photodynamic therapy; Mppa: Methyl pyropheophorbide-a |
由图 3 A1~D1所示,Mppa-PDT处理组细胞核染色质浓缩、深染,凋亡小体形成,且这类细胞明显多于空白、单药、单光3对照组,而3个对照组间这类染色质深染的细胞数无明显差异。

|
图 3 DAPI染色观察人卵巢癌SKOV3细胞胞核改变情况(A1~D1);DCFH-DA染色检测SKOV3细胞内ROS的产生及其定量(A2~D2);单细胞凝胶电泳观察SKOV3细胞DNA损伤情况(A3~D3) Fig 3 Changes of nuclei in SKOV3 cells by DAPI staining (A1-D1); production of ROS in SKOV3 cells by DCFH-DA staining (A2-D2); and DNA damage in SKOV3 cells by single cell gel electrophoresis (A3-D3) A1,A2,A3:Blank group; B1,B2,B3:Only Mppa treated group; C1,C2,C3:Only PDT treated group; D1,D2,D3:Mppa-PDT group.ROS:Reactive oxygen species; PDT:Photodynamic therapy;Mppa:Methyl pyropheophorbide-a.Original magnification:×200 |
DCFH-DA荧光染色结果(图 3 A2~D2)显示,Mppa-PDT组绿色荧光强度(1.82±0.07)高于空白(0.27±0.03)、单药(0.30±0.05)、单光(0.28±0.04)3个对照组(P < 0.05)。且3组对照组绿色荧光强度差异无统计学意义(P>0.05)。这表明Mppa-PDT能够诱导细胞产生ROS。
2.5 Mppa-PDT触发人卵巢癌SKOV3细胞DNA损伤单细胞凝胶电泳结果(图 3 A3~D3)显示,Mppa-PDT处理组有明显“彗星”现象形成,而空白、单药、单光3个对照组无“彗星”形成,即Mppa-PDT组存在DNA损伤,而3个对照组无明显DNA损伤。
2.6 Mppa-PDT诱导p53及凋亡相关蛋白的表达蛋白质印迹结果(图 4)显示,Mppa-PDT组p53、Caspase-3、Bax蛋白表达高于空白、单药、单光3个对照组,Bcl-2低于3个对照组(P < 0.05),且空白、单药、单光3个对照组间上述蛋白的表达差异无统计学意义(P>0.05)。
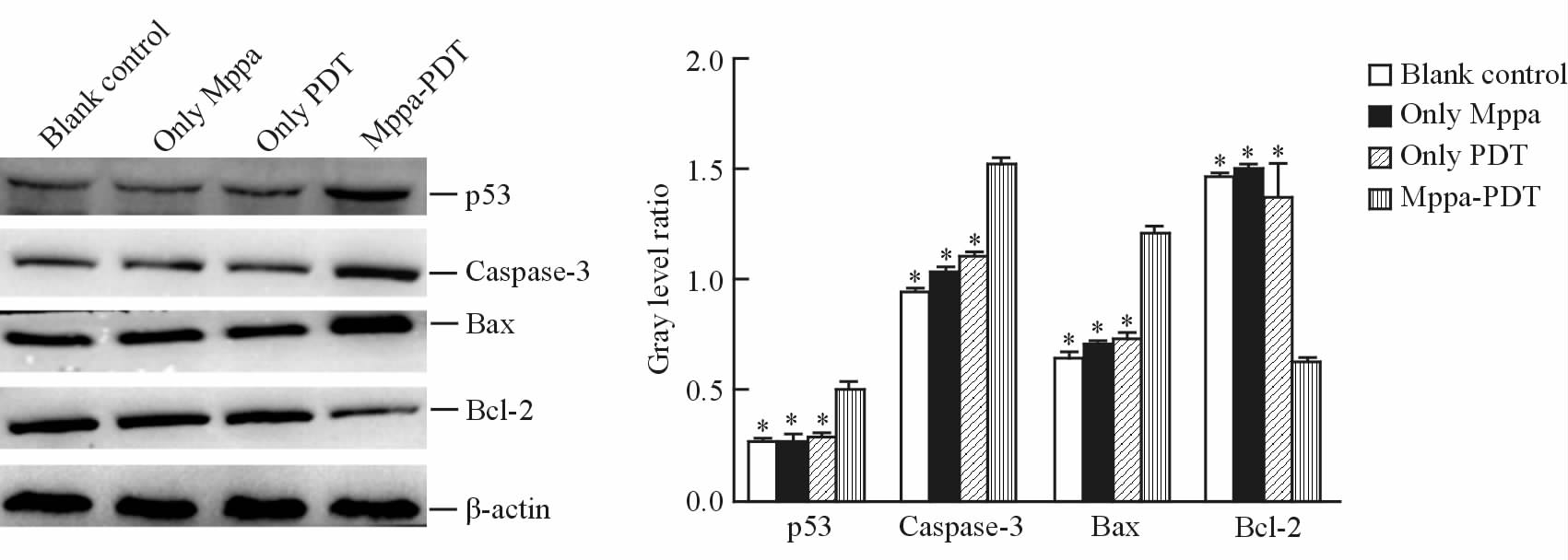
|
图 4 蛋白质印迹法检测p53、Caspase-3、Bax、Bcl-2蛋白表达情况 Fig 4 Analysis of p53, Caspase-3, Bax and Bcl-2 protein levels in differernt groups by Western blotting analysis Mppa: Methyl pyropheophorbide-a; PDT: Photodynamic therapy. *P < 0.05 vs Mppa-PDT group. n=3, x±s |
卵巢癌严重威胁着女性健康,传统的手术、放化疗等治疗手段具有一定的局限性,因此寻找新型的卵巢癌治疗方法迫在眉睫[7]。PDT因其无创、不良反应小、可反复应用等优点具有广阔的临床应用前景[8]。目前研究认为PDT杀伤肿瘤的机制主要是:(1)产生大量的ROS损伤蛋白、质膜等,最终导致细胞凋亡;(2)作用于肿瘤血管,使血管闭塞,形成血栓等导致肿瘤营养输入途径的中断,最终杀伤肿瘤细胞;(3)激活机体免疫系统,通过特异性及非特异性免疫反应杀伤肿瘤细胞[2]。Mppa属于叶绿素衍生物,最大吸收波长位于红光区,因其能量密度高、渗透性强而成为非常具有潜能的新型光敏剂[3, 4, 5]。但目前Mppa-PDT对卵巢癌细胞的作用研究报道甚少,本研究探讨Mppa-PDT对卵巢癌细胞增殖的影响及其可能的机制,为Mppa-PDT用于临床卵巢癌治疗提供实验资料。本研究结果提示LED光照(10.8 J/cm2)活化Mppa(2 μmol/L)能显著抑制人卵巢癌细胞活性,促进其凋亡。
PDT通过一定波长的光照活化光敏剂,使低能量态的氧分子跃迁到高能量态产生ROS而起作用[9]。ROS是生物代谢的产物,化学反应性极强,参与广泛的细胞信号转导,通过调节凋亡信号通路导致细胞凋亡[10, 11]。本实验发现经Mppa-PDT处理后细胞内ROS表达升高。ROS可以攻击细胞DNA,使DNA链断裂、位点突变[12]。p53为一种抑癌基因,主要分布于细胞核,能特异性与DNA结合,还可在细胞周期的G1期检查DNA损伤点,监视基因组的完整性。如存在DNA损伤,p53蛋白能够阻止DNA进行复制,以便提供足够的时间修复受损的DNA;但如果DNA修复失败,p53蛋白则引发受损细胞凋亡[13, 14]。本实验观察到Mppa-PDT处理后出现明显的“彗星”现象,p53蛋白表达上调,提示细胞核可能为光动力作用靶点。DNA损伤能够启动细胞凋亡,也能够激活外源性死亡受体细胞凋亡通路及内源性线粒体凋亡通路[15, 16]。线粒体为细胞能量代谢的中心,在维持细胞稳态中起着举足轻重的作用。于是我们检测了线粒体凋亡途径相关蛋白的表达,发现在Mppa-PDT处理后有线粒体凋亡蛋白Bax、Caspase3的升高及抗凋亡蛋白Bcl-2的降低。与本研究一致的是也有研究证实Mppa-PDT能够引起骨巨细胞瘤线粒体膜电位降低,导致线粒体凋亡通路激活[6]。
综上所述,本研究证实Mppa-PDT能够抑制人卵巢癌SKOV3细胞活性,诱导SKOV3细胞凋亡。同时在该过程中伴随有ROS的产生、DNA的损伤及线粒体凋亡通路的激活。最近也有研究证实光动力能够诱导自噬的发生,将自噬抑制后凋亡增多,说明在光动力中自噬起着抗凋亡的作用[17]。至于Mppa-PDT导致SKOV3细胞DNA损伤后发生凋亡的同时是否有自噬的发生、自噬在该过程的作用如何及自噬发生的具体机制将是本研究小组进一步深入探讨的方向。
| [1] | Gentry-Maharaj A, Menon U.Screening for ovarian cancer in the general population[J].Best Pract Res Clin Obstet Gynaecol, 2012, 26:243-256. |
| [2] | Rkein A M, Ozog D M.Photodynamic therapy[J].Dermatol Clin, 2014, 32:415-425. |
| [3] | Luo T, Wilson B C, Lu Q B.Evaluation of one-and two-photon activated photodynamic therapy with pyropheophorbide-a methyl ester in human cervical, lung and ovarian cancer cells[J].J Photochem Photobiol B, 2014, 132:102-110. |
| [4] | Guelluy P H, Fontaine-Aupart M P, Grammenos A, Lécart S, Piette J, Hoebeke M.Optimizing photodynamic therapy by liposomal formulation of the photosensitizer pyropheophorbide-a methyl ester: in vitro and ex vivo comparative biophysical investigations in a colon carcinoma cell line[J].Photochem Photobiol Sci, 2010, 9:1252-1260. |
| [5] | Xu J, Xia X, Leung A W, Xiang J, Jiang Y, Yu H, et al.Sonodynamic action of pyropheophorbide-a methyl ester induces mitochondrial damage in liver cancer cells[J].Ultrasonics, 2011, 51:480-484. |
| [6] | Li K T, Zhang J, Duan Q Q, Bi Y, Bai D Q, Ou Y S.Apoptosis triggered by pyropheophorbide-α methyl ester-mediated photodynamic therapy in a giant cell tumor in bone[J]. Laser Phys, 2014, 24: 066002. |
| [7] | Bagley C M Jr, Young R C, Canellos G P, DeVita V T.Treatment of ovarian carcinoma: possibilities for progress[J]. N Engl J Med, 1972, 287:856-862. |
| [8] | Allison R R, Bagnato V S, Cuenca R, Downie G H, Sibata C H.The future of photodynamic therapy in oncology[J].Future Oncol, 2006, 2:53-71. |
| [9] | Pena Luengas S L, Marin G H, Aviles K, Cruz Acuña R, Roque G, Rodríguez Nieto F, et al.Enhanced singlet oxygen production by photodynamic therapy and a novel method for its intracellular measurement[J].Cancer Biother Radiopharm, 2014, 29:435-443. |
| [10] | Wu C C, Bratton S B.Regulation of the intrinsic apoptosis pathway by reactive oxygen species[J].Antioxid Redox Signal, 2013, 19:546-558. |
| [11] | Hua P, Sun M, Zhang G, Zhang Y, Tian X, Li X, et al.Cepharanthine induces apoptosis through reactive oxygen species and mitochondrial dysfunction in human non-small-cell lung cancer cells[J].Biochem Biophys Res Commun, 2015, 460:136-142. |
| [12] | Klammer H, Mladenov E, Li F, Iliakis G.Bystander effects as manifestation of intercellular communication of DNA damage and of the cellular oxidative status[J].Cancer Lett, 2015, 356:58-71. |
| [13] | Li Z J, Mack S C, Mak T H, Angers S, Taylor M D, Hui C C.Evasion of p53 and G2/M checkpoints are characteristic of Hh-driven basal cell carcinoma[J].Oncogene, 2014, 33:2674-2680. |
| [14] | Akdemir K C, Jain A K, Allton K, Aronow B, Xu X, Cooney A J, et al.Genome-wide profiling reveals stimulus-specific functions of p53 during differentiation and DNA damage of human embryonic stem cells[J]. Nucleic Acids Res, 2014, 42:205-223. |
| [15] | Roos W P, Kaina B.DNA damage-induced cell death: from specific DNA lesions to the DNA damage response and apoptosis[J].Cancer Lett, 2013, 332:237-248. |
| [16] | De Zio D, Cianfanelli V, Cecconi F.New insights into the link between DNA damage and apoptosis[J].Antioxid Redox Signal, 2013, 19:559-571. |
| [17] | 涂平华, 李开庭, 陈 青, 欧云生, 白定群.芦荟大黄素介导的光动力诱导骨肉瘤MG63细胞自噬[J].第二军医大学学报, 2014, 35:1347-1352. Tu P H, Li K T, Chen Q, Ou Y S, Bai D Q.Autophagy of osteosarcoma MG63 cells induced by aloe emodin-mediated photodynamic therapy[J].Acad J Sec Mil Med Univ, 2014, 35:1347-1352. |
 2015, Vol. 36
2015, Vol. 36


