2. 第二军医大学药学院药物分析学教研室, 上海 200433
2. Department of Pharmaceutical Analysis, School of Pharmacy, Second Military Medical University, Shanghai 200433, Chin
苦参为木兰科植物苦参的干燥成熟果实,习称“北苦参”。其味酸、甘,性温。有收敛固涩、益气生津、补肾宁心之功效。苦参多用于久咳虚喘、梦遗滑精、久泻不止、遗尿尿频、自汗、盗汗、短气脉虚、津伤口渴、内热消渴、心悸失眠等症状。现代药理学研究发现,苦参具有降低肝炎患者血清丙氨酸转氨酶、抗菌抗病毒、抗氧化、促进代谢等作用[1, 2]。现代研究证明,苦参主要生物活性成分是生物碱类成分,具有抗肝脏损伤、抗氧化的作用[3, 4, 5],但苦参生物碱类成分的代谢速率及吸收特性尚不明确。
目前药物吸收的研究广泛采用Caco-2细胞模型。Caco-2细胞系来源于人类结肠腺癌,在普通的培养条件下就可以自发地分化为肠上皮细胞单层,因此可以模拟体内小肠上皮细胞层。由于其形态学及生化性质都与小肠上皮很相似,可作为预测药物在人体小肠吸收以及药物转运机制研究的标准体外模型[6, 7],广泛用于药物的吸收、分布、代谢、排泄以及毒性研究。
药物吸收进入体内后的代谢过程由肝脏代谢酶来完成,肝脏是药物在体内的重要生物转化场所,肝微粒体中有着丰富的代谢酶,其中CYP450酶是主要的药物代谢酶,其对药物的代谢是药物从体内消除的限速步骤,可影响药物的半衰期、清除率等药代动力学参数。目前,体外肝微粒体孵育体系已经成为研究药物代谢的重要模型,根据待研究成分在肝微粒体中代谢速率结果可对药物的成药性进行初步判定,从而降低药物研发的成本[8, 9, 10, 11, 12, 13, 14]。
本研究借助大鼠肝微粒体体外孵育模型和Caco-2细胞吸收模型,采用高效液相色谱单重四级杆质谱联用技术(HPLC-MS)研究3种苦参生物碱类成分在Caco-2细胞模型中的吸收特性以及在肝微粒体中的代谢速率,为苦参生物碱类成分的药物代谢动力学及药效研究提供数据支持。
1 仪器和试药 1.1 仪器Agilent 1100 Series HPLC/MSD系统(美国安捷伦公司),包括在线脱气机、四元泵、高性能自动进样器、柱温箱、二极管阵列检测器,G1969A单重四极杆质谱仪,配有ChemStation色谱工作站;PHS-3S型pH计(上海精密科学仪器有限公司);高速离心机(美国ABBOTT公司); METYLER AE240型十万分之一电子天平(梅特勒-托利多上海有限公司);DK-S12型电热恒温水浴锅(上海华连医疗器械有限公司);XW-80A型旋涡混合器(上海医科大学仪器厂);细胞电阻仪(美国Millipore公司)。
1.2 药品和试剂苦参碱(批号:110805)、氧化苦参碱(批号:130927)和槐果碱(批号:121018)对照品购于上海源叶生物科技有限公司(纯度>99.01%);内标苯甲酰新乌头碱(批号:13052305)购于上海诗丹德生物科技有限公司(纯度>99.01%);阳性对照药睾酮(批号:80901)购于Sigma-Aldrich上海贸易有限公司(纯度>99.54%);SD大鼠肝微粒体(批号:452501)购于上海碧迪医疗器械有限公司;烟酰胺腺嘌呤二核苷酸磷酸(β-NADPH,N7505-100MG)购于美国Sigma公司;甲醇和乙腈均为色谱纯,购于美国Burdick&Jackson公司;纯净水为实验室自制;磷酸二氢钾、磷酸氢二钾、氯化镁均为分析纯。
2 方法和结果 2.1 溶液的配制 2.1.1 磷酸盐缓冲液(PBS,含3.314 mmol/L MgCl2)的配制精密称取磷酸二氢钾6.832 g,磷酸氢二钾11.41 g,MgCl2 0.153 2 g,加入500 mL量瓶中,加水溶解并定容至刻度,即得。
2.1.2 生物碱类成分及对照药睾酮标准溶液的配制分别精密称取苦参碱、氧化苦参碱、槐果碱标准品12.42、13.23、12.31 mg,置5 mL容量瓶中,加甲醇稀释至刻度并超声溶解,摇匀,即得浓度分别为10.01 mmol/L的标准品母液。
精密吸取苦参碱、氧化苦参碱、槐果碱标准品母液适量,用空白Hank’s 平衡盐溶液(HBSS)配制成浓度分别为10.01、5.005、2.002、1.001、0.505、0.202、0.100 1、0.050 5 μmol/L的溶液,作为Caco-2细胞吸收模型的系列标准溶液。
再精密吸取苦参碱、氧化苦参碱、槐果碱标准品母液适量,用甲醇稀释制备如下浓度的标准溶液:40.04、20.02、10.01、4.004、2.002 μmol/L,作为大鼠肝微粒体模型的系列标准溶液。
2.1.3 内标苯甲酰新乌头碱标准溶液的配制用乙腈稀释制得浓度为0.400 4 μmol/L苯甲酰乌头碱溶液作为氧化苦参碱、槐果碱和苦参碱的内标。
2.1.4 β-NADPH溶液的配制精密称取β-NADPH适量,用PBS(含3.314 mmol/L MgCl2)溶解,制得浓度为20.04 mmol/L的β-NADPH溶液作为反应催化剂。
2.1.5 标准系列样品溶液的制备精密吸取Caco-2细胞吸收模型系列标准溶液100 μL,加入乙腈 300 μL,涡旋30 s,沉淀蛋白后,1 500×g离心5 min,取上清,进样。
精密吸取大鼠肝微粒体模型系列标准溶液10 μL,置于含有10 μL肝微粒体的1.5 mL塑料EP管中,加入PBS(含3.314 mmol/L MgCl2)380 μL,涡旋30 s,分别制得浓度为1.001、0.500 5、0.250 3、0.100 1、0.050 1 μmol/L的标准系列模拟肝微粒体样品溶液,取标准系列模拟肝微粒体样品溶液30 μL至1.5 mL塑料EP管中,加入90 μL乙腈内标溶液30 s,沉淀蛋白后,1 500×g离心5 min,取上清进样。
2.2 分析条件 2.2.1 液相色谱条件色谱柱:Agilent Zorbax SB-C18(3.0 mm×100 mm,3.5 μm);流动相:乙腈∶水=60∶40;进样量:5 μL;流速:0.8 mL/min;柱温:30℃;运行时间9 min。
2.2.2 单重四级杆质谱条件采用ESI离子源,正离子模式下(ESI+):柱后分流比为2∶1,选择离子监测(SIM),具体参数如下:苦参碱[M+Na]+m/z 439.1,氧化苦参碱[M+Na]+m/z 455.1,槐果碱[M+Na]+m/z 559.1,内标苯甲酰新乌头碱[M+H]+m/z 590.4,干燥气温度:350℃;毛细管电压:4 000 V;干燥气流速:9.0 L/min;碎片电压:90 eV。代表性图谱如图 1所示。
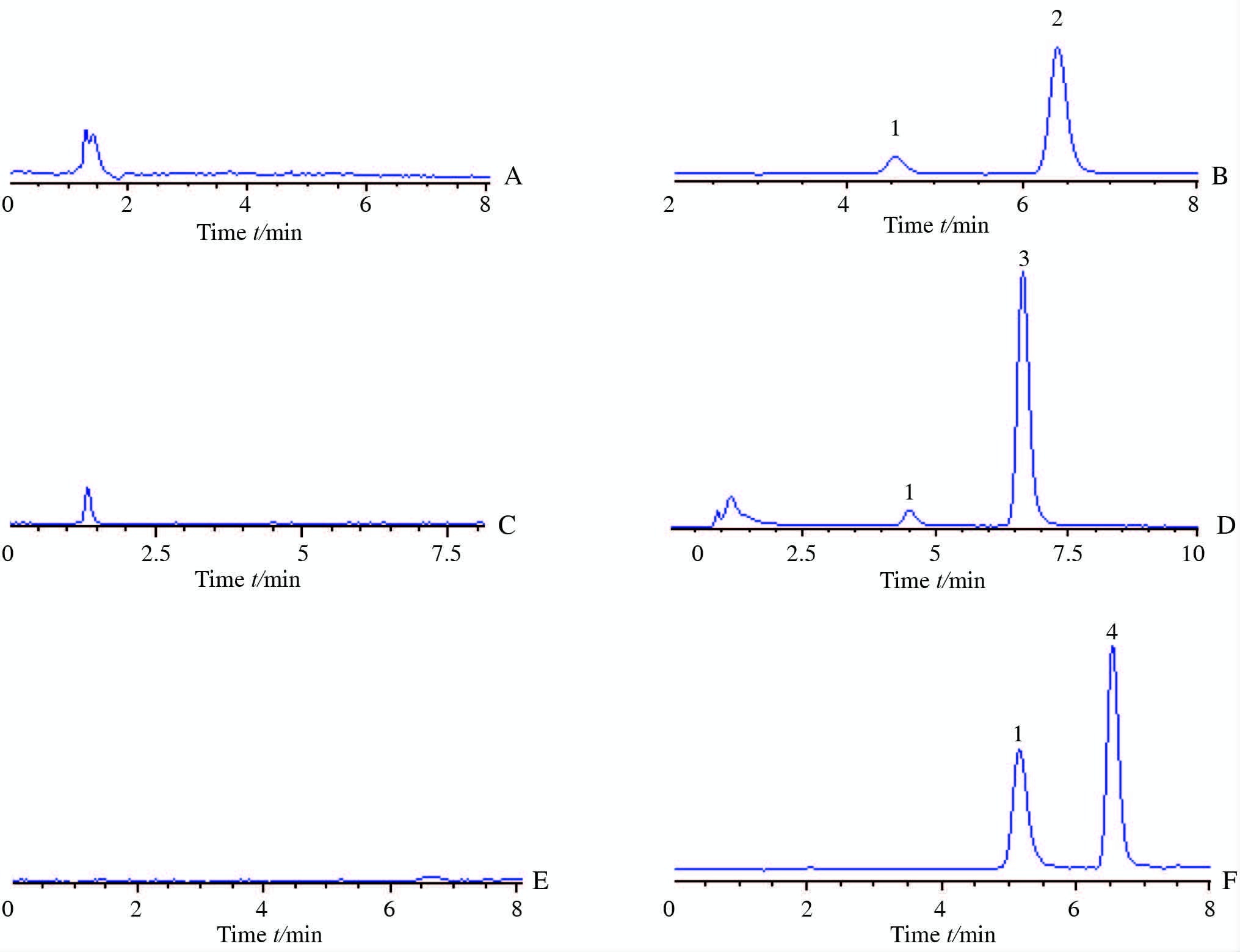
|
图 1 HPLC-MS法测定苦参碱、氧化苦参碱、槐果碱的代表性图谱 Fig 1 Representative HPLC-MS chromatograms of matrine, oxymatrine, and sophocarpine A, C, and E: Blank chroamtograms for matrine, oxymatrine, and sophocarpine in rat liver microsomes, respectively; B: The representative chromatograms for sophocarpine in rat liver microsomes; D: The representative chromatograms for matrine in rat liver microsomes; F: The representative chromatograms for oxymatrine in rat liver microsomes. 1: Benzolaconine; 2: Sophocarpine; 3: Matrine; 4: Oxymatrine |
取Caco-2细胞吸收模型系列标准溶液和系列标准模拟肝微粒体样品溶液,按照2.1.5 项方法取上清进行色谱分析,以模拟Caco-2细胞模型和肝微粒体样品中各成分的浓度(C,μmol/L)对3种待测物峰面积与内标峰面积的比值(Y),用最小二乘法进行线性回归分析,得标准曲线方程及相关系数,结果呈良好的线性关系,见表 1。
|
|
表 1 3种生物碱类成分在细胞吸收模型和肝微粒体模型中的线性关系 Tab 1 Linear relationship of 3 sophora alkaloids in HBSS and rat liver microsomes |
在2.2.1 项色谱条件下,以混合供试品溶液进样5 μL,根据色谱参数计算系统适应性。供试品溶液中3种生物碱类成分苦参碱、氧化苦参碱、槐果碱的理论塔板数分别为69 299、96 479、84 947,保留时间分别为6.692 min、6.842 min、6.497 min。
2.4.2 基质效应与提取回收率(1)用甲醇稀释母液制成苦参3种生物碱类成分的浓度分别为:苦参碱0.250 3、0.500 5、1.001 μmol/L,氧化苦参碱0.250 5、0.501 1、1.003 μmol/L,槐果碱0.250 2、0.500 4、1.001 μmol/L;(2)取空白肝微粒体孵育液,配制与步骤(1)中相同浓度的3种成分的含待测成分的样品溶液;(3)按2.1.5 项下操作,得与步骤(1)中相同浓度的3个成分的样品溶液,进样分析。步骤(2)与(1)中样品进样后所得峰面积比为基质效应,按步骤(3)与(2)中所得峰面积之比计算提取回收率。苦参碱、氧化苦参碱、槐果碱的低、中、高浓度的绝对基质效应分别为80.68%、90.43%和89.95%,提取回收率分别为(88.52±1.42)%、(89.62±2.40)% 和(91.75±2.18)%。
2.4.3 精密度与准确度取2.4.1 项下制备的低、中、高3个浓度的3种生物碱类成分的样品溶液,连续3 d每天进样3次和1 d内连续进样6次,根据所测化合物与内标峰面积的比值分别计算日间精密度、日内精密度和准确度。结果3种生物碱类成分的日内、日间精密度RSD均<5%,准确度在90%~110%范围内,表明方法的精密度和准确度良好。
2.4.4 定量限与检测限取3种生物碱类成分母液分别进行稀释,按照2.2.1 项色谱条件进样,以信噪比10∶1时,确定其最低定量限分别为苦参碱0. 9 nmol/L、氧化苦参碱1.1 nmol/L、槐果碱0.001 0 μmol/L;以信噪比3∶1时,确定其最低检测限分别为0.32 nmol/L、0.33 nmol/L、0.33 nmol/L。
2.4.5 稳定性取低、中、高3个浓度的3种苦参生物碱类成分,按照2.1.5 项下模拟肝微粒体样品溶液的制备方法制备样品溶液,分别于0、2、4、6、8、12 h测定3种成分的浓度,考察其室温放置12 h内的稳定性。结果3个成分浓度的RSD分别为3.561%、2.642%、1.823%,表明3种生物碱类成分溶液在12 h内稳定,符合测定的要求。
2.5 Caco-2细胞吸收模型中3种生物碱类成分的测定 2.5.1 制备Caco-2细胞吸收模型将Caco-2细胞接种于Transwell 12孔板内室膜上,每孔加入0.5 mL Caco-2细胞悬液;在Transwell板的外室加入1.5 mL培养液。接种24 h后更换培养液,接下来1周内隔天换液,1周后每天换液,培养21 d待用。用细胞电阻仪确定单层细胞的紧密性和完整性,即构建成一个良好的Transwell模型。
2.5.2 Caco-2细胞吸收模型的测定吸弃模型小室内的培养基,用HBSS小心冲洗3次,最后1次在37℃培养箱中孵育20 min后轻轻吸干孔内HBSS,以清除细胞表面对测定有干扰的物质。在细胞模型内室(AP侧)加入0.5 mL终浓度为10 μmol/L的3种标准溶液,在外室(BL侧)加入1.5 mL的HBSS溶液;或者在外室(BL侧)加入1.5 mL终浓度为10 μmol/L的3种标准溶液,在内室(AP侧)加入0.5 mL的HBSS溶液,分别于30 min、60 min、90 min、120 min,取未加药侧透析液待测,并用HBSS溶液补充所取的体积。对透析液进行处理:取100 μL样品加入300 μL乙腈内标溶液,涡旋30 s,沉淀蛋白后,1 500×g离心5 min,取上清,进样。计算各个时间点内3种生物碱类成分在透析液中的表观渗透系数(Papp)及渗透速率常数,结果见表 2。
|
|
表 2 3种苦参生物碱类成分透析液测定结果 Tab 2 Determination results of 3 sophora alkaloids transporting across Caco-2 cell membrane |
向孵育体系中加入肝微粒体10 μL,加入PBS(含3.314 mmol/L MgCl2)360 μL,分别加入40.04 μmol/L苦参碱、氧化苦参碱、槐果碱及阳性对照药睾酮10 μL,涡旋混匀,从中取出95 μL作为0时间点样品。向体系中加入15 μL β-NADPH溶液,涡旋混匀,立即放入37℃水浴中,分别于1、3、5、15、30、60 min时取样30 μL,样品加入90 μL内标乙腈溶液沉淀蛋白,1 500×g离心5 min,取上清进样分析,计算各个时间点的浓度及各个生物碱类成分的代谢速率,3种生物碱成分的半衰期分别是苦参碱 4.331 h、氧化苦参碱1.084 h、槐果碱2.478 h,见表 3。
|
|
表 3 3种生物碱类成分代谢速率的测定结果 Tab 3 Metabolic rates of 3 sophora alkaloids |
根据Caco-2细胞吸收模型对药物吸收的要求,透析液中药物的浓度在 10-5 cm/s 级别内属于易吸收的类型,在10-6 cm/s级别内属于较易吸收的类型,在 10-7 cm/s级别内属于较难吸收的类型;从表 3中可知,苦参碱、氧化苦参碱、槐果碱都属于较易吸收的类型,根据计算它们在Caco-2细胞中内外侧渗透系数的比值分别为1.251、0.937 5、1.424,可以判断主动转运是3个生物碱成分的主要吸收转运方式。
进行Caco-2细胞吸收实验时,为考察在Caco-2细胞单层模型中,时间对3种苦参生物碱转运的影响,在给予高、中、低3个浓度,苦参碱0.250 3、5.005、10.01 μmol/L,氧化苦参碱0.250 5、5.011、10.03 μmol/L,槐果碱0.250 2、5.004、10.01 μmol/L后,分别于60 min取样,并测定其中的药物浓度,计算不同浓度的3种苦参生物碱对Caco-2细胞Papp的影响;为考察温度对3种苦参生物碱转运的影响,分别在37℃、25℃和4℃给予1.001 μmol/L苦参碱、氧化苦参碱、槐果碱后,于60 min取样,测定其中的药物浓度,计算不同温度时Caco-2细胞中3种苦参生物碱Papp的变化。结果表明3种生物碱的吸收转运不受浓度的影响,但随着温度的升高其Papp值增大,说明3种生物碱的吸收受温度的影响,本实验的吸收转运温度为37℃,可以模拟药物在体内的吸收转运温度。
苦参中3种生物碱类成分代谢的半衰期均较长,说明3种生物碱成分在大鼠肝微粒体模型中不易发生代谢。
本实验通过采用体外Caco-2细胞吸收模型和肝微粒体代谢模型测定了苦参中3种生物碱成分在体内的吸收和代谢过程,3种生物碱的吸收速率常数均大于10-6 cm/s,内外侧吸收速率常数的比值分别为苦参碱1.251、氧化苦参碱0.937 5、槐果碱1.424,说明主动转运是3种生物碱成分的主要吸收转运方式,3种生物碱成分的代谢半衰期分别为:苦参碱4.331 h、氧化苦参碱1.084 h、槐果碱2.478 h,说明3种生物碱成分不易发生代谢。本研究结果可为苦参生物碱类成分的药物代谢动力学和药物效应动力学研究、临床合理用药以及发挥药物最佳疗效提供数据支持。
| [1] | 赵凤春,万楷杨,刘晓谦,张启伟,高慧敏,王智民.近红外漫反射光谱法快速测定苦参和白土苓药材中多指标成分的含量[J].光谱学与光谱分析,2014,10:102. |
| [2] | 张 翅,马 悦,高慧敏,张启伟,王智民.苦参化学成分研究进展[J].中国实验方剂学杂志,2014,20:205-214. |
| [3] | 高红宁,殷 奕.苦参药材中氧化苦参碱和苦参总黄酮含量比较[J].中国实验方剂学杂志,2013,19:66-69. |
| [4] | 陈 磊,刘 怡,梁生旺.苦参化学成分研究[J]. 广东药学院学报,2011,27:471-473 |
| [5] | 周 军,梅 艳,易 丽. 苦参生物碱药理作用研究进展[J]. 儿科药学杂志,2008, 14:61-64. |
| [6] | 祝 倩,郭宇星,潘道东,曾小群,孙杨赢,周慧敏.Caco-2细胞模型构建及抗高血压肽VPP和IPP小肠吸收机制研究[J].食品科学,2014,35:226-231. |
| [7] | 郭慧玲,胡律江,胡志方,闫柏屹,曾 辉. Caco-2细胞模型在中药成分吸收机制研究中的应用[J]. 江西中医学院学报,2014,26:64-66. |
| [8] | 田义超,周 静,徐凌云.银杏内酯B注射液对大鼠体外肝微粒体CYP1A2活性的影响[J]. 中国临床药理学杂志,2014,30:204-207. |
| [9] | 于宗琴.HPLC法测定大鼠肝微粒体中阿司匹林酯酶活性及体外动力学研究[J]. 山东医学高等专科学校学报,2014,36:43-45. |
| [10] | 石 亮,张远冬,王二豪,惠俊敏,郭延垒,于 超.没食子酸及其氧化产物对大鼠肝微粒体CYP3A的抑制效应[J].第三军医大学学报,2014,36:130-134.. |
| [11] | 史丽娟,石 磊,宋光耀.氧化苦参碱肝脏药理作用的研究进展[J]. 世界科学技术-中医药现代化,2014,16:448-451. |
| [12] | 陈淑云,陈激扬,采 云,李鹏宇.肝脏药物代谢功能与临床个体化用药[J]. 首都医药,2012,2:33-34. |
| [13] | 温艳清,孟志云,陈淑珍,朱晓霞,窦桂芳.力达霉素的体外代谢[J]. 药学学报,2011,46:1132-1134. |
| [14] | Liang Y, Hao H, Xie L, Kang A, Xie T, Zheng X, et al. Development of a systematic approach to identify metabolities for herbal homologs based on liquid chromatography hybrid ion trap time-of-flight mass spectrometry: gender-related difference in metabolism of Schisandra lignans in rats [J]. Drug Metab Dispos, 2010, 38:1747-1759. |
 2015, Vol. 36
2015, Vol. 36


