2. 上海交通大学医学院附属第九人民医院麻醉科, 上海 200011;
3. 上海交通大学医学院附属第九人民医院口腔颌面外科, 上海 200011
2. Department of Anesthesiology, Ninth People's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 200011, China;
3. Department of Oral and Maxillofacial Surgery, Ninth People's Hospital of Shanghai, Shanghai Jiaotong University School of Medicine, Shanghai 200011, China
吸入性肺损伤是指气道内吸入各种炎性刺激物引起的肺部临床病理综合征。在全球,近年来因吸入性肺炎导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的病死率无明显下降。ARDS目前被公认是机体炎症反应失控的结果,炎症反应与代偿性抗炎反应失衡是发病机制的核心。以往的研究认为多种细胞因子和炎性介质参与肺损伤的病理进程[1],有的研究还认为血浆肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)蛋白水平或白细胞介素-6(IL-6)蛋白水平可反映炎症反应的程度和趋势[2],但是如何调控这些致炎因子与抗炎因子的平衡失调仍不甚明了。国内外研究均提示核因子κB(NF-κB)的激活在 ARDS 中起着关键性的作用[3]。在研究NF-κB上游的调控因子中发现,过氧化物酶增殖体激活受体(peroxisome proliferators activated receptor,PPAR)可以直接或通过辅助因子与一些转录因子如NF-κB结合,影响其基因表达,从而负反馈调节炎性介质[4]。近期一些研究进一步显示,PPAR配体具有抗炎作用机制[5, 6]。氟比洛芬酯(flurbiprofen axetil,FA)是一种具有解热、消炎、镇痛作用的环氧合酶(COX)抑制剂,同时也是一种PPAR激动剂,因此我们推测FA能作为PPAR的配体与PPAR结合,促进肺组织内相关PPAR(PPAR-α或PPAR-γ)的表达,抑制下游NF-κB活性,负调控炎症介质,从而产生一定的肺保护作用。
因此,本实验在建立大鼠吸入性肺损伤模型的基础上,观察FA预处理对肺的保护作用,以及对血浆中促炎因子TNF-α浓度的影响,并在基因水平观察肺组织PPAR-α或PPAR-γ的表达,探讨可能的作用机制,为临床防治吸入性肺损伤提供一个新思路以及相关的理论依据与实验基础。
1 材料和方法 1.1 实验动物及试剂健康雄性SD大鼠96只,由中国科学院上海实验动物中心提供,体质量为200~250 g,标准化饲养。FA注射液(北京泰德制药股份有限公司),中/长链脂肪乳注射液(华瑞制药有限公司),脂多糖(lipopolysaccharides,LPS; Sigma,美国),TRIzol试剂(Invitrogen,美国),SP免疫组化试剂盒(北京中杉金桥生物技术有限公司),反转录试剂盒(TaKaRa,日本),Ex Teqase(TaKaRa,日本),DNA相对分子质量标准(TaKaRa,日本),SYBR greenⅠ Primix Ex Taq酶(TaKaRa,日本),RT-PCR试剂盒(TaKaRa,日本),大鼠TNF-α ELISA检测试剂盒(R&D,美国),全自动血气分析仪(Raduometer ABL 800 FLEX,美国),pQant酶标仪(Biohit BP800,芬兰)。
1.2 实验分组96只健康雄性SD大鼠,按SPF级标准化饲养3 d。将动物随机分为4组:生理盐水对照组(NS组)、模型组(LPS组)、脂肪乳剂预处理对照组(Lip+LPS组)和FA预处理组(FA+LPS组),每组24只。前2组分别于气管内缓慢滴注NS 1 mL/kg和LPS 1 mL/kg,后2组分别在大鼠尾静脉注射20%的脂肪乳剂1 mL/kg和10 mg/mL的FA 1 mL/kg,1 h后均于气管内缓慢滴注LPS 1 mL/kg。以气管内滴入NS或LPS的时间点为0时间点,滴注后第1、6、12、24 h为观察终结时间点,分为1 h亚组、6 h亚组、12 h亚组、24 h亚组,每亚组取材6只。
1.3 标本采集麻醉大鼠,抽取大鼠腹主动脉血0.3 mL,测定动脉血气。心脏采血1 mL,室温下静置1 h后离心,取上清,置于-20℃冰箱。左支气管结扎后切取大鼠左侧下叶,置-80℃冰箱。右支气管结扎后切取大鼠右肺上叶组织,0.9%生理盐水冲洗后称质量备用。于大鼠右心室置入18 G口径的钝头钢针,并在左心耳剪一约2 mm的小切口,同时向右心室快速灌注生理盐水250 mL,冲洗肺血管床约20 min,待肺组织外观洁白透亮后,用2%多聚甲醛继续灌注20 min左右。取右肺下叶组织用4%多聚甲醛固定24 h,常规脱水、包埋、制成蜡块。
1.4 动脉血气分析用Raduometer ABL 800 FLEX型血气分析仪测定动脉血氧分压(pressure of oxygen in arterial blood,PaO2)和动脉二氧化碳分压(pressure of carbon dioxide in arterial blood,PaCO2)。
1.5 肺组织湿/干质量比(Wet-dry mass ratio,W/D)测定取大鼠右肺上叶组织,使用滤纸沾干表面水分,置于一干燥洁净的玻璃试管中,经电子天平精确称量后,置于80℃恒温烤箱内,烘干24 h后再称质量,计算前后两者的比值,即为W/D。
1.6 病理形态学检查光镜下观察肺组织病理形态改变,按照Mikawa的方法[7]行肺组织病理半定量评分。评分标准:对肺泡充血、出血、肺泡腔或血管壁中性粒细胞浸润或聚集、肺泡壁增厚和(或)透明膜形成4项指标,分别依病变轻重评0~4分(0分指无病变或非常轻微病变;1分指轻度病变;2分指中度病变;3分指重度病变;4分指极重度病变),总分16分。四项评定分数总和为肺损伤的总评分。
1.7 定量PCR检测肺组织中PPAR-α与PPAR-γ mRNA的表达取出于-80℃冰箱保存的大鼠左肺下叶肺组织,置入液氮中,提取总RNA,定量PCR法检测PPAR-α mRNA与PPAR-γ mRNA的表达。
1.8 ELISA法检测血清中TNF-α的表达采用双抗体夹心 ABC-ELISA(enzyme-linked immunosorbent assay)方法,利用BIO-STR系统,检测血清中TNF-α的表达。
1.9 统计学处理应用SPSS 16.0统计软件分析数据,数据以x±s表示。NS对照组与LPS实验组比较采用t检验。多个组间比较采用单因素方差分析,差异有统计学意义的进一步采用q检验进行两两比较。检验水准(α)为0.05。
2 结 果 2.1 动脉血气分析NS组内大鼠各时间点PaO2差异无统计学意义(P>0.05);LPS组和Lip+LPS组各相应时间点PaO2比较差异无统计学意义(P>0.05);LPS组、Lip+LPS组和FA+LPS组大鼠PaO2较NS组相应时间点均下降(P<0.05),其中6 h时PaO2降至最低,此后逐步回升直至实验结束。在6、12和24 h时FA+LPS组PaO2高于相应时间点的LPS组和Lip+LPS组(P<0.05)。见表 1。
|
|
表 1 各组大鼠各时间点PaO2和PaCO2的比较 Tab 1 Comparison of PaO2 and PaCO2 in rats of all groups |
NS组大鼠各时间点PaCO2差异无统计学意义(P>0.05);LPS组、Lip+LPS组和FA+LPS组大鼠PaCO2较NS组各相应时间点下降(P<0.05);FA+LPS组24 h时PaCO2高于LPS组和Lip+LPS组(P<0.05)。见表 1。
2.2 肺组织W/D比值测定NS组大鼠各时间点W/D比值差异无统计学意义(P>0.05);LPS组、Lip+LPS组和FA+LPS组大鼠W/D比值较NS组各相应时间点均升高(P<0.05),其中6 h时点升至最高,分别达(6.33±0.69)、(6.26±0.66)和(5.96±0.53),此后逐步回落直至实验结束;FA+LPS组24 h时 W/D比值低于相应时间点的LPS组和Lip+LPS组(P<0.05)。见图 1。
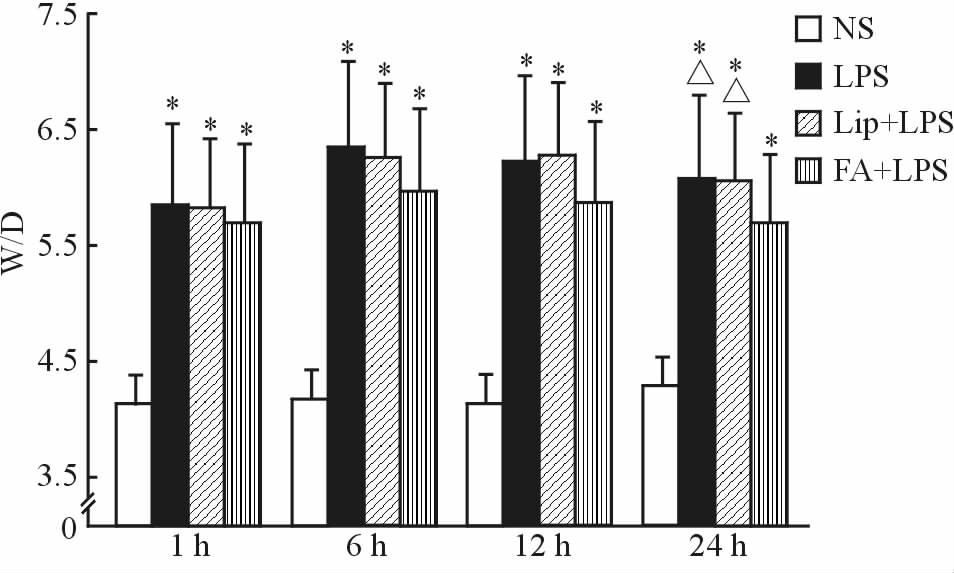
|
图 1 各组大鼠肺组织W/D比值的比较 Fig 1 Comparison of W/D ratios of rat lungs in all groups W/D: Wet-dry mass ratio; NS: Control; LPS: Lipopolysaccharides; Lip: Lipid emulsion; FA: Flurbiprofen axetil. P<0.05 vs NS group at the same time; △P<0.05 vs FA+LPS group at the same time. n=6,x±s |
光镜下,NS组大鼠肺泡结构清晰完整,肺泡隔均匀一致,壁薄光滑,肺泡腔中无渗出液或渗出的白细胞,肺间质少量炎细胞浸润(图 2A)。LPS组和Lip+LPS组各时间点的病理特征相似,在致炎后1 h主要表现为肺泡腔及肺间质渗出、水肿、红细胞外渗(图 2B),6 h时表现为肺组织结构毁损、肺间质大量中性粒细胞浸润及红细胞大量外渗(图 2C),12 h时肺间质内大量淋巴细胞浸润(图 2E),24 h时肺间质淋巴细胞浸润、红细胞外渗明显减少(图 2G)。FA+LPS组在肺组织结构毁损、红细胞外渗、中性粒细胞或淋巴细胞浸润的程度上较LPS组和Lip+LPS组相应时间点均有所减轻(图 2D、2F、2H)。
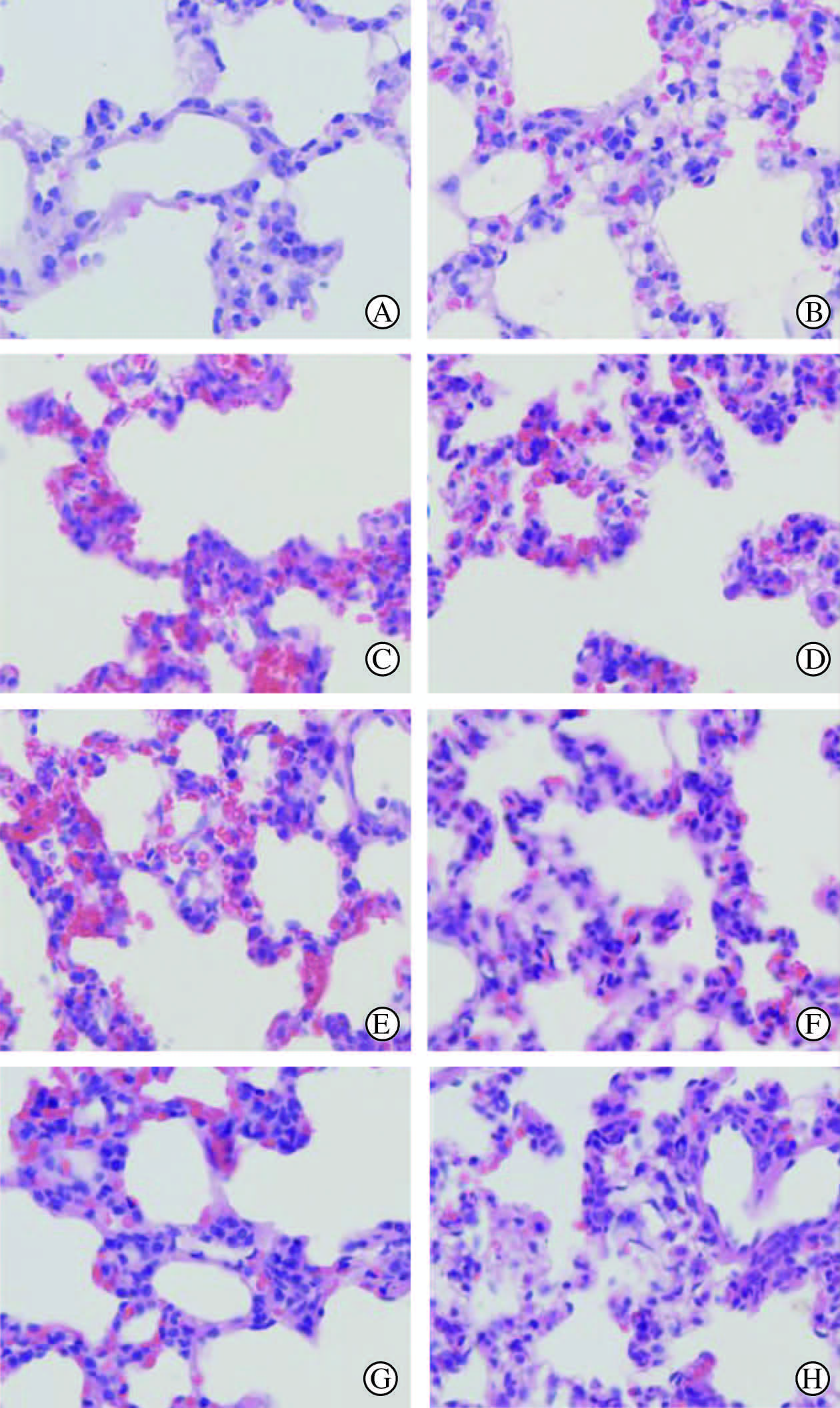
|
图 2 各组大鼠的肺组织病理形态 Fig 2 Histological manifestation of rat lungs in all groups NS: Control; LPS: Lipopolysaccharides; Lip: Lipid emulsion; FA: Flurbiprofen axetil. A: NS group, 1 h; B: LPS group, 1 h; C: Lip+LPS group, 6 h; D: FA+LPS group, 6 h; E: Lip+LPS group, 12 h; F: FA+LPS group, 12 h; G: Lip+LPS group, 24 h; H: FA+LPS group, 24 h. H-E staining. Original magnification: ×400 |
各组大鼠肺组织病理半定量评分比较显示,NS组大鼠各时间点肺组织病理半定量评分差异无统计学意义(P>0.05);LPS组、Lip+LPS组和FA+LPS组大鼠肺组织病理半定量评分较NS组相应时间点均升高(P<0.05);FA+LPS组1 h时大鼠肺组织病理半定量评分低于6 h时(P<0.05),与12、24 h时差异无统计学意义(P>0.05);FA+LPS组在6、12和24 h时间点的肺组织病理半定量评分均低于相应时间点的LPS组和Lip+LPS组(P<0.05)。见图 3。
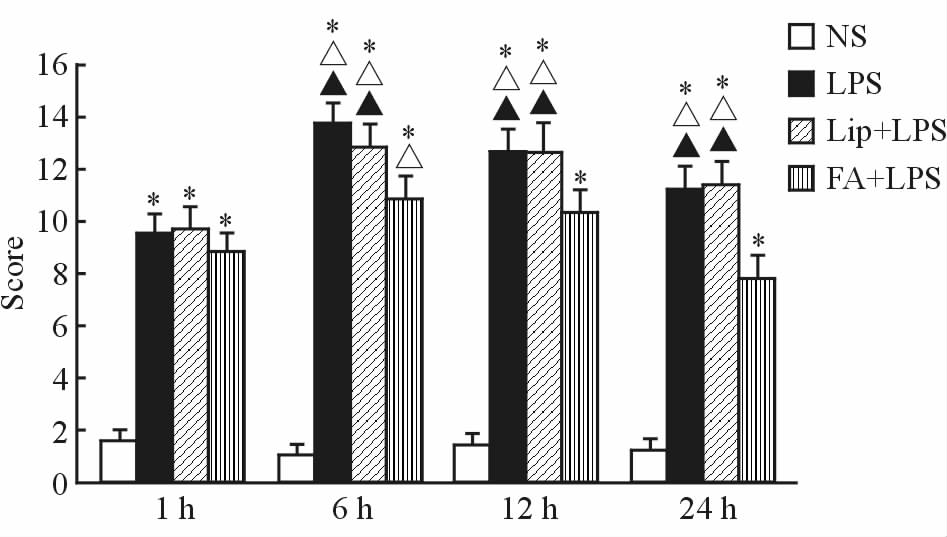
|
图 3 各组大鼠病理半定量评分的比较 Fig 3 Comparison of semi-quantitative pathological scores of lung in rats of all groups *P<0.05 vs NS group at the same time; △P<0.05 vs the same groups at 1 h; ▲P<0.05 vs FA+LPS group at the same time. n=6, x±s |
定量PCR结果显示,FA+LPS组大鼠肺组织PPAR-α mRNA在6、12和24 h时较相应时间点的LPS组和Lip+LPS组上升(差异>2倍);所有时间点的FA+LPS组与NS组无明显差异(差异<2倍),见图 4A。FA+LPS组大鼠肺组织PPAR-γ mRNA在6、12和24 h时较LPS组和Lip+LPS组相应时间点上升(差异>2倍);所有时间点的FA+LPS组与NS组无明显差异(差异<2倍),见图 4B。
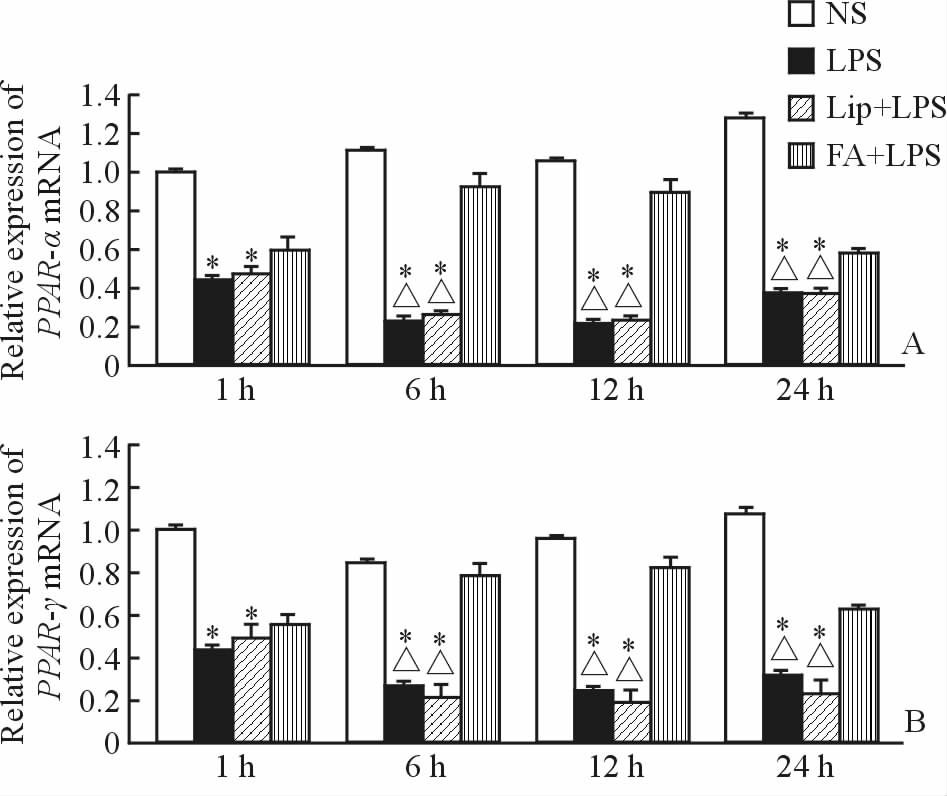
|
图 4 各组大鼠PPAR-α (A) mRNA和PPAR-γ(B) mRNA 定量PCR检测结果 Fig 4 Quantitative PCR results of PPAR-α(A) mRNA and PPAR-γ(B) mRNA in all groups NS: Control; LPS: Lipopolysaccharides; Lip: Lipid emulsion; FA: Flurbiprofen axetil. *Diversity>2 vs NS group at the same time;△Diversity>2 vs FA+LPS group at the same time. n=6, x±s |
结果显示,NS组大鼠各时间点TNF-α浓度差异无统计学意义(P>0.05);致炎后1 h LPS组和Lip+LPS组血清中TNF-α的浓度上升(P<0.05),6 h时回落,但较NS组相应时间点差异仍具有统计学意义(P<0.05),12 h、24 h时差异无统计学意义(P>0.05); FA+LPS组致炎后1 h时TNF-α的浓度也上升,但低于LPS组和Lip+LPS组(P<0.05),6 h后与NS组相应时间点比较差异无统计学意义(P>0.05),见图 5。
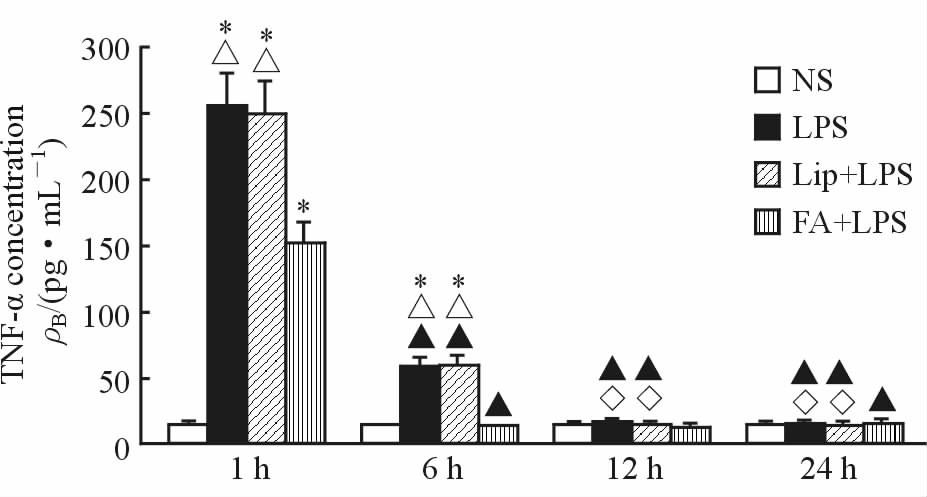
|
图 5 各组大鼠血清中TNF-α的浓度 Fig 5 Concentration of TNF-α in rat sera of all groups NS: Control; LPS: Lipopolysaccharides; Lip: Lipid emulsion; FA: Flurbiprofen axetil. *P<0.05 vs NS group at the same time; △P<0.05 vs FA+LPS group at the same time; ▲P<0.05 vs the same group at 1 h; ◇P<0.05 vs the same group at 6 h. n=6, x±s |
急性吸入性肺损伤以肺毛细血管床损伤、低氧血症以及肺顺应性减低为特点,是由中性粒细胞、肺泡上皮细胞、单核巨噬细胞以及淋巴细胞等介导的肺过度炎症反应,是目前危重症医学领域的治疗难点之一。
本实验结果显示,正常大鼠肺组织有较高水平的PPAR-α和PPAR-γ mRNA表达,主要分布在肺泡上皮细胞;LPS吸入致炎可以下调大鼠肺组织中PPAR-α、PPAR-γ mRNA的表达。FA预处理可以提高大鼠LPS致炎后6、12和24 h的PaO2,并在致炎后24 h使大鼠PaCO2恢复到正常范围(35~45 mmHg)。肺组织W/D比及肺组织病理形态半定量评分也显示FA预处理可以使LPS吸入性肺损伤大鼠的肺组织水肿和炎症细胞浸润的程度减轻,但研究没有发现FA预处理在大鼠吸入致炎后1 h时的肺保护作用。从致病机制上考虑,吸入性肺损伤属于原发性肺损伤,不同于继发性肺损伤,在LPS吸入初期,LPS直接作用于肺组织,释放毒性物质,破坏肺毛细血管床和肺泡结构,此为LPS毒性作用阶段,主要病理表现为肺泡腔及肺间质渗出、水肿、红细胞外渗。在LPS刺激下,肺组织内促炎因子开始逐步释放,并促使中性粒细胞募集活化,而中性粒细胞又能正反馈调节促炎因子,两者相互促进,肺炎症反应链开始形成,此为肺内炎症反应与代偿性抗炎反应失衡阶段,主要病理表现为大量中性粒细胞肺间质内聚集。我们认为,FA预处理不能直接对抗LPS毒性作用,但能够抑制促炎因子和(或)中性粒细胞的活化,下调促炎反应,从而产生一定的抗炎及肺保护作用。
近来研究[8]认为PPAR配体能影响巨噬细胞、内皮细胞功能,阻止炎症反应。PPAR-α和PPAR-γ的配体可竞争性结合PPAR,它们在结构上有一个共同点:都包含有1个羧基功能基团和1个疏水区。PPAR-α能被大部分脂肪酸激活,合成型配体主要包括降血脂药物Wyeth-14643及贝特类(如非诺贝特、苯扎贝特、氯贝特)。PPAR-γ天然配体为花生四烯酸经由COX和脂氧合酶途径的代谢产物,合成型配体主要是四氢噻唑二酮类药物(如曲格列酮、环格列酮)。非甾体类消炎药物如氟比洛芬则能同时激活PPAR-α和PPAR-γ。本实验在LPS吸入致炎前1 h静脉给予FA对吸入性肺损伤大鼠模型进行干预,观察对大鼠肺组织中PPAR-α、PPAR-γ mRNA及TNF-α表达的影响,结果显示,FA预处理可使急性肺损伤肺组织中PPAR-α mRNA和PPAR-γ mRNA表达量在各时相间点均有不同程度的升高,LPS致炎后1 h,大鼠血清中TNF-α的浓度即达到峰值,FA预处理可使血清中TNF-α浓度峰值下降。实验结果提示:FA预处理能上调大鼠肺组织中PPAR-α mRNA和PPAR-γ mRNA的表达,促进PPAR-α和PPAR-γ蛋白的表达上调,并在损伤初期部分抑制TNF-α的释放。
TNF-α是一种早期的促炎细胞因子,来源于肺组织单核细胞、巨噬细胞和T细胞,不仅能促进其他的促炎细胞因子(如IL-1β、IL-6、IL-8)的释放,还与黏附分子如细胞间黏附分子-1(ICAM-1)和E-选择素共同作用,直接诱导中性粒细胞活化[9]。目前认为,在已发现的所有促炎因子中TNF-α最具典型意义,不仅早期释放,还能延长急性炎症的反应时相[10]。TNF-α与ARDS的发病关系密切,其水平的高低可直接反映病情的严重程度[11]。本实验观察到,在LPS吸入致炎后早期(1 h)大鼠血清中TNF-α的浓度大幅上升,FA预处理能降低大鼠血清中TNF-α的浓度。大鼠肺组织受到LPS刺激后,激活T细胞介导的细胞免疫,大量释放TNF-α等炎症细胞因子,这是血清中TNF-α浓度迅速升高的主要原因。同时,血液中FA迅速靶向输送至炎症部位,在羧基酯酶作用下水解成氟比洛芬,上调T细胞内PPAR-α、PPAR-γ的表达与活性,可能影响了NF-κB的活化,并进一步影响下游促炎因子TNF-α的转录和表达,从而对LPS吸入大鼠肺炎症反应起到调控作用。
PPAR调节炎性反应基因的分子机制目前尚未完全清楚,最近确认了PPAR-γ通过一种苏素化(ligand-dependent sumoylation)依赖途径介导炎性反应基因的转录抑制。PPAR-γ配体通过一些苏素连接酶使PPAR-γ的LBD区赖氨酸365(K365)苏素化,苏素化的LBD引导PPAR-γ与炎性反应基因启动子上的核受体辅阻遏物(nuclear receptor corepressor,NCoR)-组蛋白脱乙酰酶-3(histone deacetylase-3,HDAC3)复合物结合,而抑制辅阻遏子复合物泛素化并被19S蛋白酶体降解,使靶基因保持在抑制状态,导致NF-κB启动炎性基因转录的过程被抑制[12]。值得注意的是,尽管PPAR-α的抗炎机制尚有争论,但在鼠氨基酸的研究中发现,在PPAR的苏素化共有序列中,PPAR-α有与PPAR-γ的K365相似的赖氨酸残基-K358,提示PPAR-α可能与PPAR-γ拥有相似的抑制炎症基因转录的分子机制。
结合本研究和其他的相关研究,推测FA预处理对吸入性肺损伤大鼠肺组织的保护作用主要通过抑制NF-κB炎症反应通路来实现的。其可能机制是:(1)FA是以脂微球为药物载体的非甾体类消炎镇痛剂,因其良好的靶控性、缓释性及速效性,能在炎症发生初期迅速靶向分布至炎症部位。FA从脂微球中释放出来后,在羧基酯酶作用下迅速水解生成氟比洛芬,发挥生物学活性;(2)氟比洛芬与PPAR-γ的LBD区结合后,引导PPAR-γ与炎性基因启动子上的NCoR-HDAC3复合物结合,抑制辅阻遏子复合物被19S蛋白酶体降解,结果启动子区的NCoR复合物没有得到清除,靶基因保持在抑制状态,NF-κB启动炎性基因转录的过程被抑制;(3)进一步抑制了其下游细胞因子TNF-α的表达,从而抑制了中性粒细胞等炎症细胞对肺组织的浸润,产生抗炎与肺保护作用。
本实验明确了FA作为PPAR-α、PPAR-γ的激活剂与吸入性肺损伤炎症反应信号通路的关系,尚需进一步了解FA干预下炎症组织内NF-κB的表达变化,对此我们将在后续研究中对此进行探索。
| [1] | 俞 敏, 田兆方. 急性肺损伤标志物的研究进展[J]. 中国当代儿科杂志, 2014, 16:94-98. |
| [2] | Blum J L, Rosenblum L K, Grunig G, Beasley M B, Xiong J Q, Zelikoff J T. Short-term inhalation of cadmium oxide nanoparticles alters pulmonary dynamics associated with lung injury, inflammation, and repair in a mouse model[J]. Inhal Toxicol, 2014, 26: 48-58. |
| [3] | Moine P, McIntyre R, Schwartz M D, Kaneko D, Shenkar R, Le Tulzo Y, et al. NF-kappaB regulatory mechanisms in alveolar macrophages from patients with acute respiratory distress syndrome[J]. Shock, 2000,13: 85-91. |
| [4] | Huwiler A, Pfeilschifter J. Lipids as targets for novel anti-inflammatory therapies[J]. Pharmacol Ther, 2009, 124: 96-112. |
| [5] | Lakshmi S P, Reddy A T, Zhang Y, Sciurba F C, Mallampalli R K, Duncan S R, et al. Down-regulated peroxisome proliferator-activated receptor γ(PPARγ)in lung epithelial cells promotes a PPARγ agonist-reversible proinflammatory phenotype in chronic obstructive pulmonary disease(COPD)[J]. J Biol Chem, 2014, 289: 6383-6393. |
| [6] | Rinaldi B, Donniacuo M, Esposito E, Capuano A, Sodano L, Mazzon E, et al. PPARα mediates the anti-inflammatory effect of simvastatin in an experimental model of zymosan-induced multiple organ failure[J]. Br J Pharmacol, 2011,163: 609-623. |
| [7] | Mikawa K, Nishina K, Takao Y, Obara H. ONO-1714, a nitric oxide synthase inhibitor,attenuates endotoxin-induced acute lung injury in rabbits[J]. Anesth Analg, 2003, 97: 1751-1755. |
| [8] | Hasegawa-Moriyama M, Kurimoto T, Nakama M, Godai K, Kojima M, Kuwaki T, et al. Peroxisome proliferator-activated receptor-gamma agonist rosiglitazone attenuates inflammatory pain through the induction of heme oxygenase-1 in macrophages[J]. Pain, 2013, 154: 1402-1412. |
| [9] | Lin H, Lian W S, Chen H H, Lai P F, Cheng C F. Adiponectin ameliorates iron-overload cardiomyopathy through the PPARα-PGC-1-dependent signaling pathway [J]. Mol Pharmacol, 2013, 84: 275-285. |
| [10] | Howard W A, Peiris M, Hayden F G. Report of the'mechanisms of lung injury and immunomodulator interventions in influenza' workshop, 21 March 2010, Ventura, California, USA [J]. Influenza Other Respir Viruses, 2011, 5: 453-454. |
| [11] | Li T, Luo N, Du L, Zhou J, Zhang J, Gong L, et al. Tumor necrosis factor-α plays an initiating role in extracorporeal circulation-induced acute lung injury[J]. Lung, 2013, 191: 207-214. |
| [12] | Bloch M, Prock A, Paonessa F, Benz V, Bähr I N, Herbst L, et al. High-mobility group A1 protein: a new coregulator of peroxisome proliferator-activated receptor-γ-mediated transrepression in the vasculature [J]. Circ Res, 2012, 110: 394-405. |
 2015, Vol. 36
2015, Vol. 36


