2. 复旦大学脑科学研究院, 上海 200032;
3. 上海交通大学医学院附属仁济医院神经内科, 上海 200001
2. Institute of Brain Science, Fudan University, Shanghai 200032, China;
3. Department of Neurology, Renji Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200001, China
早在20世纪70年代,科学家们就提出了基因治疗的概念,即通过病毒作为载体进行基因转移来治疗一些人类疾病[1]。基因治疗研究常用的载体包括反转录病毒、慢病毒、单纯性疱疹病毒、腺病毒、腺相关病毒等[2]。目前,一些临床试验正尝试通过基因手段来治疗一些神经系统疾病,如阿尔茨海默病、脑肿瘤、慢性疼痛等,这些试验中用到的载体主要是腺相关病毒(adeno-associated virus,AAV)[2]。慢病毒载体不仅可以感染分裂期细胞,还可以感染静止期细胞和分裂后细胞,并把携带的基因整合到宿主的基因组中实现长期而稳定的表达[3]。慢病毒载体介导的基因转移和RNA沉默技术被越来越多地应用到神经功能障碍的研究中,如帕金森病、肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)[4]、蜡样脂-脂褐素增多症(Batten病)[5]。研究报道用慢病毒作为基因载体在SD大鼠海马神经元培养细胞[6]、人间充质干细胞[7]和小鼠海马[8]对癎 样放电或者癫癎发生进行研究。
癫癎作为一种常见的神经系统疾病,其发生的直接原因是神经元兴奋性的增强。多项研究发现星形胶质细胞和癫癎 的发生有着密切的关系[9, 10],如颞叶癫癎 常伴有反应性星形胶质细胞增生的现象[11]。因此,能够长期稳定表达携带基因的慢病毒载体技术在癫癎 发生的研究中有广阔的应用前景。尽管有研究表明在实验动物的慢病毒注射区无强烈的免疫反应发生[12],慢病毒注射区域的胶质细胞的分布也不会发生改变,而且没有出现明显的病理学变化[3],但慢病毒感染神经细胞是否对脑电图产生影响尚缺乏相关研究。本实验通过在海马齿状回(dentate gyrus,DG)区注射以胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)为启动子的慢病毒,研究了其对小鼠脑电图的影响,从而探讨用这种方法研究星形胶质细胞功能在癫癎 中作用的可行性。
1 材料和方法 1.1 实验材料4周龄普通清洁级雄性C57BL/6小鼠和孕期17~19 d的SD孕鼠,购于上海斯莱克实验动物责任有限公司。实验动物置于明暗交替(0:00~12:00为光照周期,12:00~24:00为暗周期)、室温25℃左右、湿度50%左右的独立通风系统中适应2周。
以GFAP为启动子表达GFP(GAFP promoter-green fluorescent protein,pGFAP-GFP)慢病毒颗粒(2×109 TU/mL)购自上海吉凯基因化学技术有限公司。抗NeuN、GFAP、MAP2抗体购自Millipore公司;荧光二抗Alexa Fluor 594 购自 Life Technologies公司。戊巴比妥钠、阿托品、匹罗卡品购自Sigma公司,水合氯醛(chloral hydrate)购自生工生物工程(上海)股份有限公司。
O.C.T冷冻切片包埋剂、冰冻切片机购自德国Leica公司,单臂数字式脑立体定位仪68003购自深圳市瑞沃德生命科技有限公司,微量注射泵控制器Micro 4TM购自美国WPI公司; 荧光显微镜购自日本Olympus公司; Neurolog电生理记录系统NL900D购自英国CED公司; 模拟-数字转换器1401 plus购自英国CED公司。
1.2 神经细胞的病毒感染及免疫荧光测试取孕期17~19 d的SD孕鼠,2%戊巴比妥钠(0.1 g/kg)麻醉后,取出胚胎迅速放入0℃解剖液中,并在0℃环境下分离胚胎海马。将分离的海马在37℃环境下用胰蛋白酶消化后用含血清的培养液(D12F培养液)清洗数次,最后一次离心后加入2 mL D12F培养液重悬,然后进行细胞计数,并将细胞接入放有盖玻片的24孔板中,密度为4×104/cm2。病毒感染前先把24孔板中培养的细胞上清液吸走,保留500 μL培养液。吸走的上清转移到其他孔中备用。根据MOI=10加入病毒感染细胞,摇动板子,混匀。6~8 h后用之前吸走的上清进行细胞换液,后面再按正常的细胞培养,病毒感染4 d后取出盖玻片,用 PBS洗2次,4%多聚甲醛固定10 min。PBS漂洗5 min,用含0.2% Triton X-100的PBS穿孔5 min。PBS漂洗2次,每次5 min。滴加封闭液于盖玻片上再将盖玻片置于湿盒中,室温封闭30 min。滴加一抗NeuN或者MAP2后置于湿盒内,4℃过夜。次日,用PBS漂洗3次,每次5 min。滴加荧光二抗,置于湿盒内,37℃保温45 min,注意避光。PBS漂洗3次,每次5 min,然后用蒸馏水漂洗1次。加入防荧光淬灭剂后封片,拍照。
1.3 病毒注射及电极埋置6周龄的C57BL/6小鼠随机分成两组,人工脑脊髓液注射组(ACSF组)19只,以GFAP为特异启动子的慢病毒注射组(pGFAP-GFP组)24只。两组小鼠称体质量后经1%的戊巴比妥钠(0.1 g/kg)腹腔注射麻醉后,将其固定于脑立体定位仪上。剪开头皮,用3%的双氧水擦拭头骨,然后参照脑立体定位图谱,以前囟bregma为基准点,以前囟后2.0 mm,中缝旁开1.5 mm,深度2.8 mm定位小鼠两侧海马的DG区和以前囟前1.5 mm,中缝右侧旁开1.5 mm定位前额叶区。使用自动微量注射泵以0.5 μL/min的注射速度将人工脑脊髓液或者pGFAP-GFP慢病毒注射到小鼠海马两侧,每侧各注射1 μL,每次注射完后留针3 min,然后缓慢退出注射针。最后在左侧颞叶(AP:-2.0 mm,ML:-1.5 mm)和前额叶(AP:1.5 mm,ML:1.5 mm)处各埋置一个直径为1 mm、长度为2 mm的颅骨电极,以颞叶处电极为记录电极,前额叶处为参考电极。用电烙铁将这两个电极焊于排针上,用牙科水泥固定电极和排针便于后期脑电记录。
1.4 冰冻脑组织切片的制备与免疫荧光6只pGFAP-GFP组小鼠在病毒注射2周后经1%的戊巴比妥钠(0.1 g/kg)腹腔注射麻醉,打开胸腔暴露心脏,先将灌流针插入左心室,同时剪开右心耳,灌注生理盐水至肝脏变白,排尽血液,约50 mL,然后再灌流4%多聚甲醛,期间伴有四肢抽搐、尾巴翘起的现象,约50 mL,灌流完后取脑,取出的脑组织置于4℃冰箱中,用4%多聚甲醛中固定过夜。次日将脑组织置于20%的蔗糖溶液中,待其沉底后再转入到30%的蔗糖溶液中,待其再次沉底后取出用包埋剂包埋后做冠状冰冻切片,从出现海马时开始取脑片,切片厚度为20 μm,贴于载玻片上备用。
用PBS漂洗脑片每次10 min,洗3次,洗去包埋剂。用含0.3% Triton X-100的PBS破膜30 min。再用含5%羊血清的PBS室温封闭脑片2 h。然后孵育一抗NeuN或者GFAP,4℃过夜。次日脑片复温30 min后,用PBS洗去一抗,洗4次,每次10 min。室温孵育荧光二抗2 h,再用PBS洗去二抗,洗4次,每次10 min。晾干片子后加入防荧光淬灭剂后封片,拍照。
1.5 小鼠体质量称量用电子天平分别称取手术前6周龄ACSF组和pGFAP-GFP组小鼠以及手术后3~4周后两组小鼠的体质量,并计算每组小鼠体质量的平均值。
1.6 脑电图(EEG)记录手术后2周分别对ACSF组和pGFAP-GFP组小鼠用Neurolog系统进行脑电记录,采样频率为2 500 Hz,滤波范围为0.1~500 Hz,每只小鼠记录2~3 d光照周期的EEG。
1.7 统计学处理脑电数据使用Spike 2版本 8.00进行分析,统计学分析采用SPSS 16.0软件。两组间体质量以x±s来表示,并采用t检验分析;两组小鼠脑电功率谱数据采用两个独立样本的t检验分析;脑电图高频振荡(high-frequency oscillations,HFOs)数据采用Mann-Whitney分析。检验水准(α)为0.05。
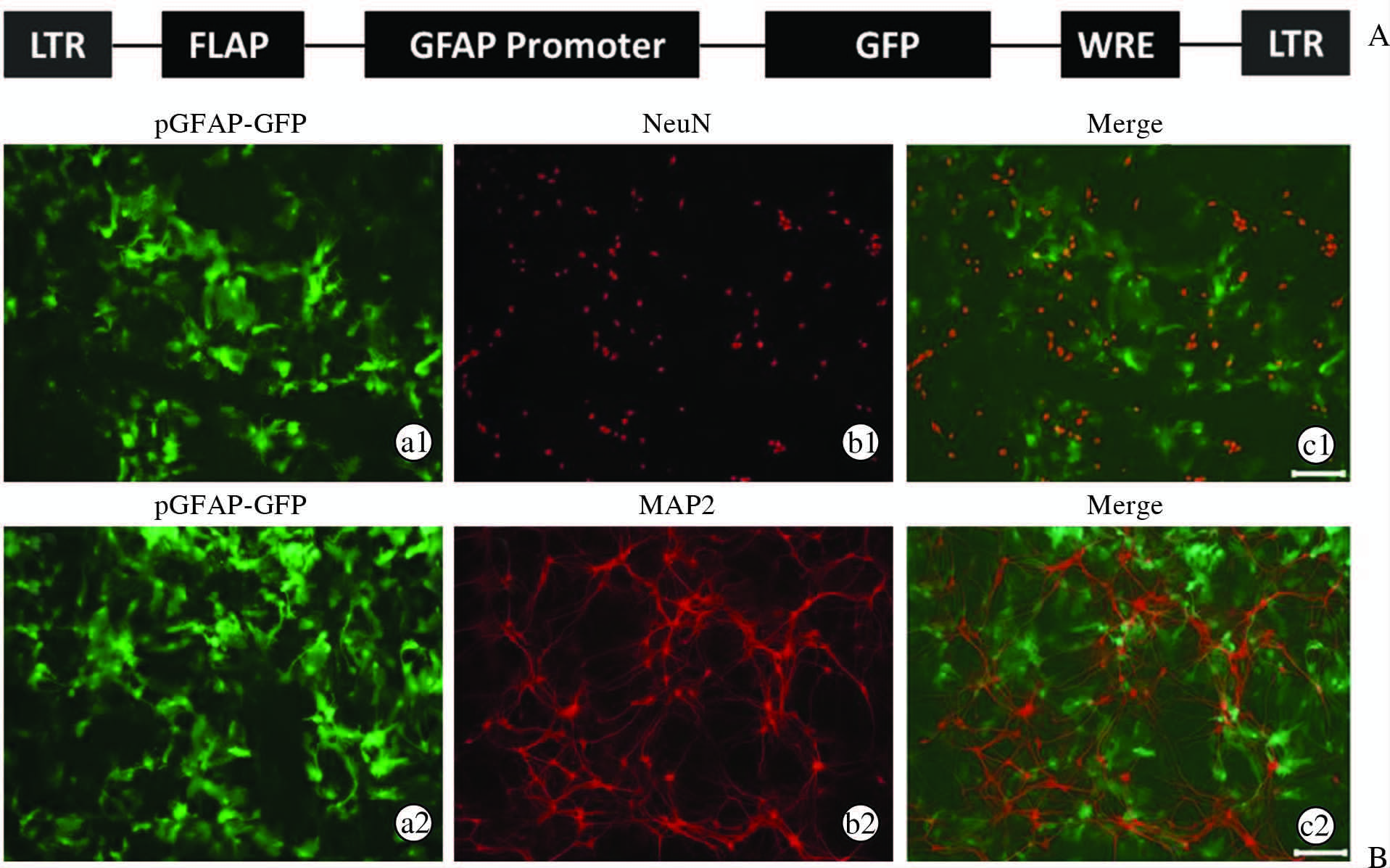
2 结 果 2.1 pGFAP-GFP慢病毒特异性感染海马非神经元细胞本实验在培养细胞水平检测了此慢病毒对神经细胞感染的特异性。采用pGFAP-GFP慢病毒,其基因结构图谱如图 1A所示。慢病毒侵染胎鼠海马细胞培养物4 d后,采用免疫荧光的方法标记神经元的标志蛋白NeuN和MAP2定位神经元,慢病毒感染的细胞与红色荧光所显示的神经元之间几乎没有重合,如图 1B所示。由此说明,此慢病毒在培养海马神经元体系中特异性感染非神经元细胞。
|
图 1 pGFAP-GFP慢病毒在培养海马神经元体系中特异性感染非神经元细胞 Fig 1 Non-neuron cells specifically infected by lentivirus containing GFAP promoter in cultured hippocampal cells A: The gene structure of lentiviral vector; B: Fluorescence images of cultured hippocampal cell infected by the lentivirus. Neurons were labeled with NeuN(b1)and MAP2(b2)4 days after the infection. The co-localization of neither NeuN nor MAP2 with GFP was observed(c1 and c2). Scale bars: 100 μm. LTR: Long-terminal repeats; WRE: Woodchuck hepatitis virus posttranscriptional regulatory element; GFP: Green fluorescent protein; NeuN: Neuronal nuclear antigen; MAP2: Microtubule-associated protein 2; pGFAP-GFP: Glial fibrillary acidic protein promoter-green fluorescent protein |
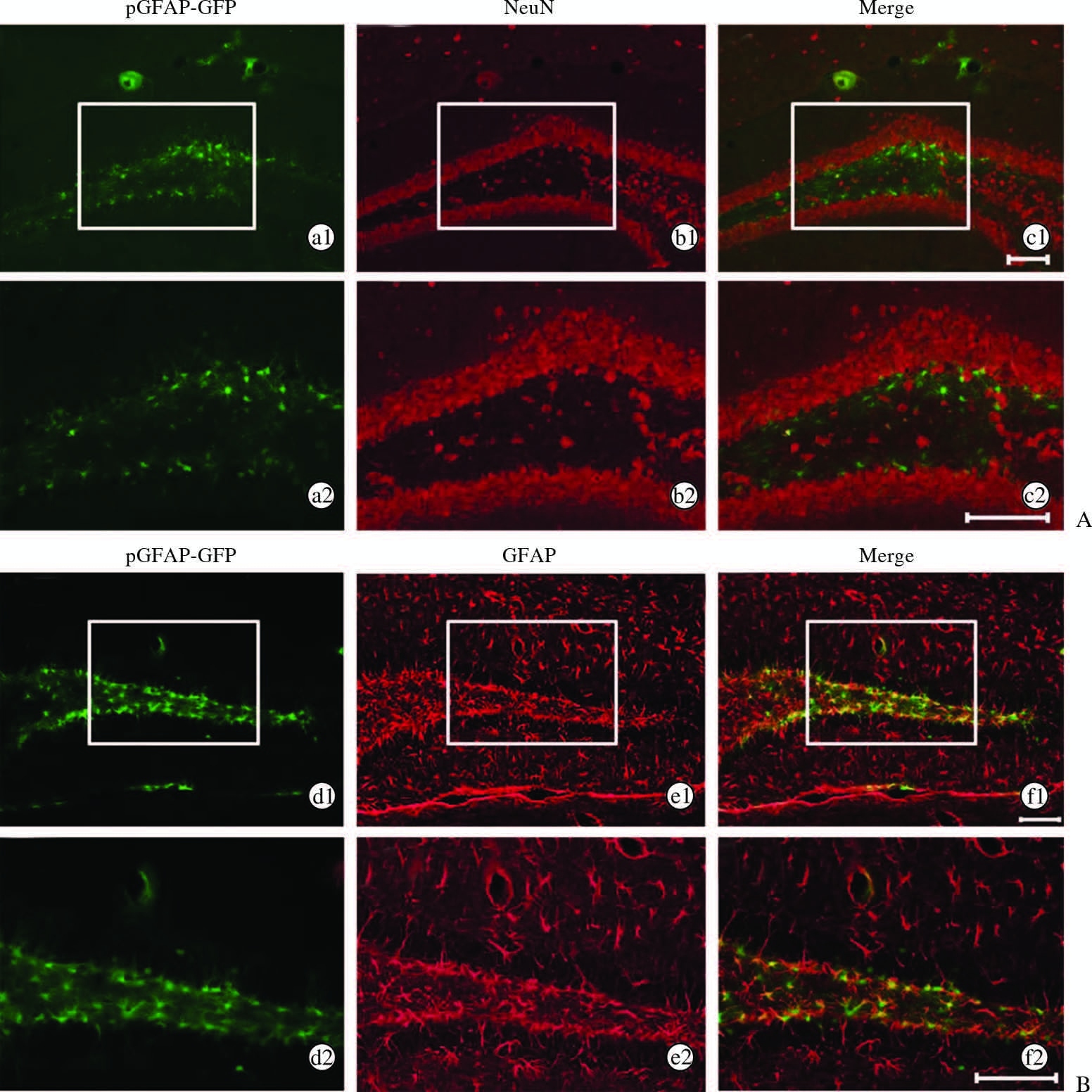
慢病毒注射小鼠海马2周后,取小鼠脑片做免疫荧光,结果如图 2所示,被慢病毒感染的细胞与星形胶质细胞重合(图 2B),但与NeuN阳性的成熟神经元几乎没有重合(图 2A)。以上结果说明慢病毒对成熟神经元不具有感染性而特异性地感染DG区星形胶质细胞。
|
图 2 pGFAP-GFP慢病毒特异性感染小鼠海马DG区星形胶质细胞 Fig 2 Astrocytes specific infection by lentivirus containing pGFAP in mouse hippocampal dentate gyrus (DG) Immunofluorescence images of hippocampal dentate gyrus 2 weeks after the lentivirus injection (1 μL in each hippocampus). a2 to f2 are high-magnification images of boxes regions in a1 to f1, respectively. Neurons were labeled with NeuN (b1,b2) while astrocytes were labeled by GFAP (e1,e2).The co-localization of GFP with GFAP (f1,f2), but not with NeuN (c1,c2) was observed. Scale bars: 100 μm. pGFAP-GFP: Glial fibrillary acidic protein promoter-green fluorescent protein; NeuN: Neuronal nuclear antigen |
在实验随机分组中,ACSF组[(20.49±0.33)g,n=19]和pGFAP-GFP组[(20.53±0.36)g,n=24]小鼠的体质量差异无统计学意义(P>0.05)。由于手术以及脑电记录过程中有小鼠死亡(ACSF组2只,pGFAP-GFP组4只),手术3~4周后,ACSF组小鼠的平均体质量为[(24.46±0.45)g,n=17],pGFAP-GFP组平均体质量为[(24.27±0.50)g,n=20],两组小鼠体质量差异无统计学意义(P>0.05),说明pGFAP-GFP慢病毒海马内注射短期内对小鼠体质量无明显影响。
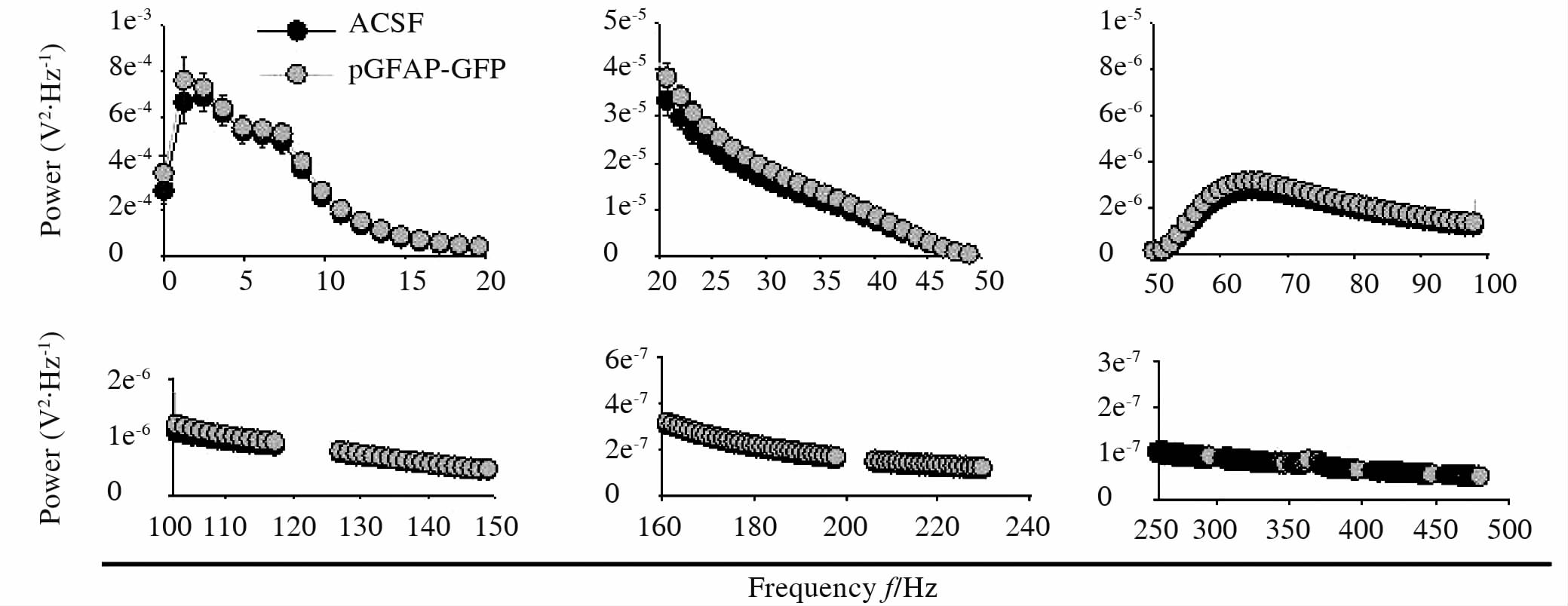
2.4 pGFAP-GFP慢病毒注射对小鼠脑电图功率谱的影响我们记录了慢病毒注射后2周小鼠光照周期的脑电图,并进行了0.1~500 Hz频率段的功率谱分析。对比ACSF组(n=27,N=11;N表示小鼠的个数,n表示获取的脑电数据个数,平均每只小鼠记录2~3 d)和pGFAP-GFP组(n=35,N=18)小鼠的脑电图功率谱结果,如图 3所示,我们发现两组小鼠在脑电图功率谱上不存在明显的差异。由于脑电图记录仪器本身存在电噪声,在100 Hz、120 Hz、200 Hz、500 Hz附近的频率段噪声干扰较大,因此去除了与之对应的功率谱分析数据。
|
图 3 ACSF或pGFAP-GFP慢病毒注射小鼠脑电图功率谱分析比较 Fig 3 Power spectrum analysis of EEG in ACSF or pGFAP-GFP lentivirus injected mice EEG was recorded continuously for 2 to 3 days for each mouse. The light cycle EEG data from ACSF group(n=27,N=11)and pGFAP-GFP group(n=35,N=18)were analyzed by using power spectrum analysis(from 0.1 to 500 Hz). Because of the electrical noise, artifacts around 100 Hz, 120 Hz, 200 Hz, and 500 Hz were eliminated. EEG: Electroencephalography; ACSF: Artificial cerebrospinal fluid; pGFAP-GFP: Glial fibrillary acidic protein promoter-green fluorescent protein |
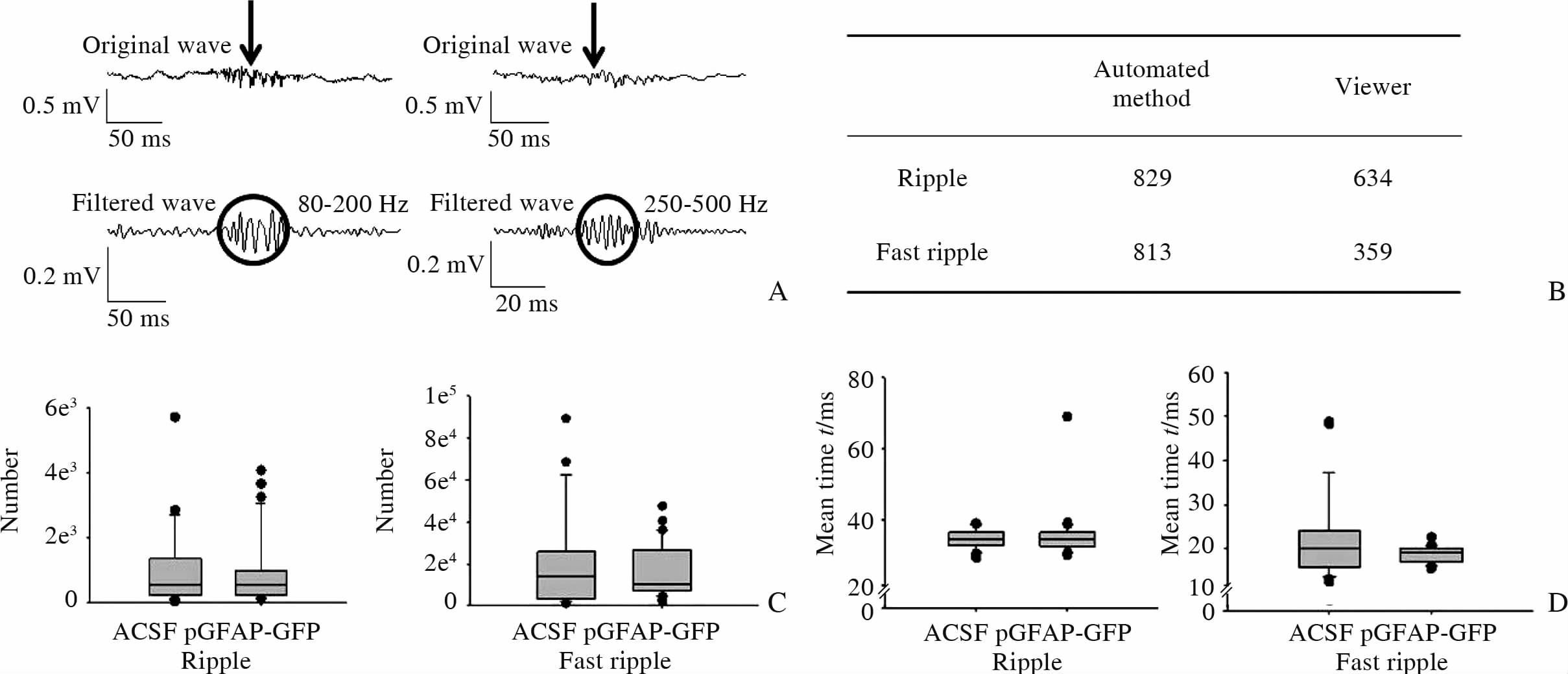
通过Spike 2软件的FIR digital filtering从原始的脑电数据中分离出80~200 Hz(ripple)和250~500 Hz(fast ripple)这两个频率段的波。根据文献[13, 14],定义一个ripple或者一个fast ripple为连续4个振幅都明显高于基线8个SD(standard deviation)的波。典型的ripple和fast ripple如图 4A所示。人工核查部分Spike 2软件自动检索的ripple和fast ripple,如图 4B所示,发现软件自动检索和人工识别存在一定的差异,ripple和fast ripple软件识别的精确度分别是76.5%和81.0%,这与Salami等[13]的结果类似。因此,我们用这一软件分析比较了ACSF组(n=26,N=11)和pGFAP-GFP组(n=31,N=15)小鼠脑电中ripple和fast ripple的数目,结果发现两组间差异无统计学意义(图 4C)。同样,两组小鼠的脑电中ripple和fast ripple的平均持续时间的差异无统计学意义(图 4D)。
|
图 4 ACSF或pGFAP-GFP慢病毒注射小鼠脑电HFOs分析 Fig 4 HFOs analysis of EEG in ACSF or pGFAP-GFP lentivirus injected mice A: Representative original traces(upper)and traces filtered in 80-200 Hz and 250-500 Hz from the original waves(lower). The black circles show the typical example of ripple and fast ripple and the black arrows show the position of ripple and fast ripple in the original waves; B: The numbers of ripples(57 EEG segments and each lasting 100 s)and fast ripples(57 EEG segments and each lasting 3 s)counted by the Spike 2-based software and viewers were compared; C,D: The box-plots show the average number and mean lasting time of ripple and fast ripple in each group(ACSF, n=26,N=11; pGFAP-GFP, n=31,N=15). ACSF: Artificial cerebrospinal fluid; pGFAP-GFP: Glial fibrillary acidic protein promoter-green fluorescent protein; HFO: High-freguency oscillations |
慢病毒载体对海马DG区具有很强的感染效率[15],这和我们的实验结果一致。本实验采用的慢病毒其启动子是由GFAP基因序列改造而来,因此它可以特异性地将GFP基因整合到海马DG区表达GFAP的星形胶质细胞中并令其持续而稳定地表达,这一特性有助于此慢病毒将其他功能基因整合到星形胶质细胞中。但鉴于海马DG区的颗粒下区(subgranular zone,SGZ)是成年哺乳动物脑中产生新生神经细胞的区域之一,此处GFAP阳性的星形胶质细胞虽然在电子显微镜下表现出成熟星形胶质细胞的超微结构,如有中间丝束、间隙连接的复合体等[16],但它们和成熟的星形胶质细胞存在一定的差异:如成熟的星形胶质细胞表达S100β而SGZ处放射样星形胶质细胞不表达[16],而且SGZ处放射样星形胶质细胞尚具有分化成为其他细胞(如颗粒细胞)的能力。慢病毒感染海马DG区的星形胶质细胞后,小鼠脑电图功率谱以及高频振荡都没有受到显著影响。但是其他海马区的星形胶质细胞被此慢病毒感染后小鼠脑电活性是否会变化还需要进一步的探究。
脑电图中的HFOs是神经元高频率活动同步化的表现,被认为在正常和病理的脑功能中都有重要作用。 HFOs频率段的ripple最初是在正常海马和其他海马旁结构中发现的,后来在癫癎 动物海马的齿状回区也有发现,而HFOs频率段的fast ripple可以反映癫癎 相关的病理进程[17],所以ripple和fast ripple在癫癎 的研究中被广泛关注。 本研究通过颅骨电极来记录EEG,并且关注了慢病毒在体注射对ripple(80~200 Hz)和fast ripple(250~600 Hz)这两个频率段的影响。ripple在正常的动物和人的海马以及海马旁结构中都可以发现,而fast ripple最初是在内侧颞叶癫癎 患者和大鼠癫癎 模型中报道的[17, 18]。也有研究报道fast ripple在癫癎 发作间歇期的EEG中出现频繁,它和能产生自发癫癎 的区域有着紧密的联系[18]。在啮齿动物的发作起始区也常常有fast ripple的发生[18]。近年来的研究表明自发性的HFOs也可以被头皮电极记录到[17, 19]。从分析的结果来看,慢病毒感染星形胶质细胞以后,脑电中ripple和fast ripple的数目以及每个ripple和fast ripple的平均持续时间没有发生显著的改变。但由于实验中慢病毒主要感染两侧海马的DG区,而颅骨电极记录的位置是左侧颞叶皮层,所以DG区的HFOs是否发生变化还需要进一步通过埋置颅内电极,记录DG区的场电位进行更为深入的探究。
EEG在癫癎 研究中是一种常用的手段,本研究通过分析pGFAP慢病毒注射后小鼠EEG在功率谱及HFOs数目及平均持续时间上的变化,从颅骨脑电方面论证了用此方法研究星形胶质细胞在癫癎 中的作用可行。虽然有研究表明在实验动物的慢病毒注射区不会发生强烈的免疫反应[12],慢病毒注射区域的胶质细胞的分布也不会发生改变[3],但是被慢病毒感染的星形胶质细胞的电生理特性(如膜电位)及生化分子特性(如星形胶质细胞反应性增生)是否发生改变,以及这些变化是否会对后期癫癎 研究的实验产生影响还需要更进一步的研究。
( 志谢 感谢上海交通大学Bio-X研究院杨北猛与王帅博士在病毒注射方面给予的指导。感谢英国CED公司软件工程师Simon Gray在Spike 2软件脚本编写上给予的帮助。感谢上海交通大学Bio-X研究院周佩硕士对论文选题上给予的启发。)
| [1] | Lentz T B, Gray S J, Samulski R J. Viral vectors for gene delivery to the central nervous system [J]. Neurobiol Dis, 2012, 48: 179-188. |
| [2] | Snyder B R, Boulis N M, Federici T. Viral vector-mediated gene transfer for CNS disease [J]. Expert Opin Biol Ther, 2010, 10: 381-394. |
| [3] | Naldini L, Blömer U, Gage F H, Trono D, Verma I M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector [J]. Proc Natl Acad Sci USA, 1996, 93: 11382-11388. |
| [4] | Gray S J, Woodard K T, Samulski R J. Viral vectors and delivery strategies for CNS gene therapy [J]. Ther Deliv, 2010, 1: 517-534. |
| [5] | Linterman K S, Palmer D N, Kay G W, Barry L A, Mitchell N L, McFarlane R G. Lentiviral-mediated gene transfer to the sheep brain: implications for gene therapy in Batten disease [J]. Hum Gene Ther, 2011, 22: 1011-1020. |
| [6] | Wang X M, Jia R H, Wei D, Cui W Y, Jiang W. MiR-134 blockade prevents status epilepticus like-activity and is neuroprotective in cultured hippocampal neurons [J]. Neurosci Lett, 2014, 572: 20-25. |
| [7] | Ren G, Li T, Lan J Q, Wilz A. Lentiviral RNAi-induced downregulation of adenosine kinase in human mesenchymal stem cell grafts: a novel perspective for seizure control [J]. Exp Neurol, 2007, 208: 26-37. |
| [8] | Makinson C D, Tanaka B S, Lamar T, Goldin A L, Escayg A. Role of the hippocampus in Nav1.6(Scn8a)mediated seizure resistance [J]. Neurobiol Dis, 2014, 68: 16-25. |
| [9] | Li T, Quan Lan J, Fredholm B B, Simon R P, Boison D. Adenosine dysfunction in astrogliosis: cause for seizure generation? [J]. Neuron Glia Biol, 2007, 3: 353-366. |
| [10] | Binder D K, Steinhauser C. Functional changes in astroglial cells in epilepsy [J]. Glia, 2006,54: 358-368. |
| [11] | Robel S, Berninger B, Gotz M. The stem cell potential of glia: lessons from reactive gliosis [J]. Nat Rev Neurosci, 2011,12: 88-104. |
| [12] | Kullmann D M, Schorge S, Walker M C, Wykes R C. Gene therapy in epilepsy—is it time for clinical trials? [J]. Nat Rev Neurol, 2014,10: 300-304. |
| [13] | Salami P, Lévesque M, Gotman J, Avoli M. A comparison between automated detection methods of high-frequency oscillations(80-500 Hz)during seizures [J]. J Neurosci Methods, 2012, 211: 265-271. |
| [14] | Dumpelmann M, Jacobs J, Kerber K, Schulze-Bonhage A. Automatic 80-250 Hz "ripple" high frequency oscillation detection in invasive subdural grid and strip recordings in epilepsy by a radial basis function neural network [J]. Clin Neurophysiol, 2012, 123: 1721-1731. |
| [15] | van Hooijdonk L W, Ichwan M, Dijkmans T F, Schouten T G, L de Backer M W, Adan R A, et al. Lentivirus-mediated transgene delivery to the hippocampus reveals sub-field specific differences in expression [J]. BMC Neurosci, 2009, 10: 2. |
| [16] | Ihrie R A, Alvarez-Buylla A. Cells in the astroglial lineage are neural stem cells [J]. Cell Tissue Res, 2008, 331: 179-191. |
| [17] | Engel J Jr, da Silva F L. High-frequency oscillations-where we are and where we need to go [J]. Prog Neurobiol, 2012, 98: 316-318. |
| [18] | Engel J Jr, Bragin A, Staba R, Mody I. High-frequency oscillations: what is normal and what is not? [J]. Epilepsia, 2009, 50: 598-604. |
| [19] | Zelmann R, Lina J M, Schulze-Bonhage A, Gotman J, Jacobs J. Scalp EEG is not a blur: it can see high frequency oscillations although their generators are small[J]. Brain Topogr, 2014, 27: 683-704. |
 2015, Vol. 36
2015, Vol. 36


